Benzol
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Benzol | |||||||||||||||
| Andere Namen |
Benzen (systematischer Name) | |||||||||||||||
| Summenformel | C6H6 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit charakteristischem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 78,11 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,88 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
80 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
schlecht in Wasser (1,77 g·l−1)[1] | |||||||||||||||
| Brechungsindex |
1,5011[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Benzol (nach IUPAC Benzen) ist eine chemische Verbindung aus der Stoffgruppe der Kohlenwasserstoffe. Es handelt sich um eine aromatische Verbindung mit der Summenformel C6H6, wobei die sechs Kohlenstoffatome einen planaren Ring (Benzolring) mit sechs delokalisierten Elektronen bilden. Benzol ist die Stammverbindung der aromatischen Kohlenwasserstoffe. Die farblose Flüssigkeit riecht charakteristisch süßlich-aromatisch, ist leicht entzündlich und brennt mit einer stark rußenden Flamme. Es ist unpolar und mischt sich mit vielen organischen Lösungsmitteln, aber kaum mit Wasser. Die wissenschaftliche Diskussion um die Struktur des Benzols spielte eine zentrale Rolle bei der Entwicklung der Theorie der organischen Chemie.
Industriell fällt Benzol bei der Koksproduktion für die Stahlindustrie an. Seit den 1950er Jahren erfolgt die Benzolproduktion überwiegend auf Erdölbasis in Raffinerie- und petrochemischen Prozessen wie dem Steamcracken und dem katalytischen Reforming als Nebenprodukt der Benzin-, Ethylen- und Xylolherstellung. Daneben gibt es gezielte industrielle Herstellungswege für Benzol wie die Dealkylierung und Transalkylierung von Toluol.
Benzol ist ein wichtiges Zwischenprodukt für die petrochemische Industrie, der globale Bedarf lag 2019 bei etwa 50 Millionen Tonnen. Durch Additions-, Substitutions- und Oxidationsreaktionen wird es zu zahlreichen Folgeprodukten umgesetzt.
Seine Derivate wie Ethylbenzol, Cumol, Cyclohexan, ortho- und para-Xylol, Chlorbenzol, Benzolsulfonsäure, Nitrobenzol und Oxidationsprodukte wie Maleinsäureanhydrid werden zu vielfältigen Zwischenprodukten für Farbstoffe, Arzneistoffe, Sprengstoffe, Reinigungsmittel, Insektizide und Kunststoffe für verschiedene Industrien weiterverarbeitet. Weiterhin ist es in Motorenbenzin enthalten, wobei der Gehalt in den meisten Ländern begrenzt ist.
Benzol ist ein giftiger Stoff, der sowohl akute als auch chronische Gesundheitsschäden verursachen kann. Für den Menschen ist es krebserregend.
Geschichte
Frühe Arbeiten und Namensgebung
In der zweiten Hälfte des 17. Jahrhunderts bemerkte Johann Rudolph Glauber, der Entdecker des Glaubersalzes (Natriumsulfat), dass bei der Destillation von Steinkohlenteer eine farblose Flüssigkeit entstand, die er ein „feines und liebliches Oleum“ nannte und bei dem es sich wahrscheinlich um Benzol handelte.[5] Eine genauere Bestimmung gelang dem britischen Physiker Michael Faraday im Mai 1825, als er eine ihm von der Portable Oil Company of London zugesandte Ölprobe analysierte. Durch wiederholte fraktionierte Destillation und fraktionierte Kristallisation stellte er nahezu reines Benzol her, das er englisch „Bicarburet of Hydrogen“ nannte. Faraday wählte diesen Namen, der ein Verhältnis von 2 : 1 von Kohlenstoff zu Wasserstoff bedeutet, auf der Grundlage der Elementaranalyse von Benzol.[6] Das Ergebnis der Elementaranalyse und die darauf kalkulierten Verhältnisse beruhen jedoch auf einer falschen Annahme der Atomgewichte von Kohlenstoff und Wasserstoff. Er ermittelte den Siedepunkt mit 80 °C und den Schmelzpunkt mit 5,5 °C.[7][8]

Die erste Synthese von Benzol geht auf den deutschen Chemiker Eilhard Mitscherlich zurück, der es 1833 durch die Reaktion von Benzoesäure und Kalk herstellte. Mitscherlich nannte die Verbindung „Benzin“ nach dem Benzoinharz, aus dem er die Benzoesäure extrahiert hatte. Außerdem setzte er Benzol zu Nitrobenzol, Azobenzol und Benzolsulfonsäure um und erstellte die richtige Summenformel C6H6.[9] Justus von Liebig benannte die Substanz in „Benzol“ um, weil die Endung -in den Alkaloiden vorbehalten war.[10]
Der französische Chemiker Auguste Laurent schlug den Namen phène, von altgriechisch φαίνω phaínô „ich erleuchte“ vor, da die Verbindung aus Leuchtgas entstand. Dieser Name ist Bestandteil des Begriffs des Phenols und der Phenylgruppe, der in der organischen Chemie die Atomgruppe –C6H5 bezeichnet. Daneben bestanden die Bezeichnungen Phenylwasserstoff, Benzine und im Französischen benzene sowie phène. Gegen Ende des 19. Jahrhunderts setzte sich die Verwendung des Namens Benzol im Deutschen durch.[11] Im Angelsächsischen und Französischen wurde jedoch weiterhin der von Mitscherlich geprägte Name in angepasster Form verwendet (französisch benzène, englisch benzene). Da in der systematischen chemischen Nomenklatur die Endung -ol für Alkohole verwendet wird, legte die IUPAC als offizielle deutsche Nomenklatur den Namen Benzen fest, der jedoch kaum verwendet wird.
Im Jahr 1845 gewann der englische Chemiker Charles Mansfield unter der Leitung von August Wilhelm von Hofmann erstmals Benzol aus Steinkohlenteer.[12] Von Hofmann prägte 1855 auch den Begriff „aromatisch“, um die chemischen Eigenschaften dieser Substanzklasse zu beschreiben und nicht deren Geruchsmerkmale.[13] Mansfield begann 1849 mit der industriellen Produktion von Benzol, basierend auf der Destillation von Steinkohlenteer. Bis dahin war Steinkohlenteer ein unerwünschtes Nebenprodukt, das in großen Mengen bei der Herstellung von Koks und Stadtgas anfiel. Steinkohlenteer wurde zum Ausgangsstoff für eine breite Palette von Kohlenwasserstoffen wie Toluol, Naphthalin und Anthracen. Diese wiederum bildeten ab Mitte der 1880er Jahre die Basis für die Entwicklung der Teerfarbenindustrie.[8]
Struktur des Benzols

Um die korrekte Strukturformel des Benzols schwelte ein langer Gelehrtenstreit. Frühe Ideen wie die von Albert Ladenburg vorgeschlagene Prisman-Struktur und das von James Dewar neben anderen Strukturen beschriebene Dewar-Benzol erwiesen sich als Fehlschlüsse.[14][15] Der österreichische Chemiker Johann Josef Loschmidt, damals noch Schullehrer, formulierte erst im Jahre 1861 einige Strukturformeln des Benzols, die der deutsche Chemiker und Professor für Chemie August Kekulé 1865 – möglicherweise als Anregung für seine Kekulé-Strukturformel – übernahm und damit den Benzolring als Basis der Konstitution der aromatischen Verbindungen[16] erkannte. Einer Legende nach kam Kekulé dieser Einfall im Traum. Er träumte von einer Schlange, die sich selbst in den Schwanz biss. Kekulé (ab 1895 Kekule von Stradonitz) beschreibt dies in seiner Rede zum 25-jährigen Jubiläum des Benzolrings 1890. Eine Abbildung der Ringstruktur durch sechs Affen, die abwechselnd entweder mit beiden oder mit einer Hand an die Füße des Nachbarn fassen, beruht auf einem 1886 bei einem Bierabend der Deutschen Chemischen Gesellschaft gemachten Scherz.[17]
Kekulés Struktur trug als erste dem experimentellen Befund Rechnung, dass im Benzol alle Kohlenstoffatome gleichwertig sind. Sie erklärte nicht alle Besonderheiten des Benzols, wie beispielsweise seine ungewöhnlich niedrige Reaktivität im Vergleich zu Olefinen. Das Ausbleiben einer Additionsreaktion mit Bromwasser, wie sie nach der Kekulé-Strukturformel zu erwarten wäre, blieb rätselhaft. Im Jahre 1872 formulierte Kekulé seine „Oszillationshypothese“ eines dauernden Platzwechsels von Einfach- und Doppelbindungen.
Armit und Robinson führten 1925 die vereinfachte Schreibweise mit einem Kreis in der Formel ein, welcher zum Ausdruck bringen soll, dass alle Bindungen absolut gleichwertig sind und keine lokalisierbaren Doppelbindungen existieren.[18] Die britische Kristallographin Kathleen Lonsdale wies 1929 durch Röntgenbeugung die Symmetrie des Rings nach.[19] Weitere Arbeiten von Lonsdale und K.S. Krishnan über die Untersuchung der magnetischen Suszeptibilität von Benzolderivaten und deren Interpretation durch Lonsdale und Pauling konnten zeigen, dass die Elektronen delokalisiert sind.[20][21] Eine hypothetische Form mit drei fixierten Doppelbindungen und drei Einfachbindungen würde als 1,3,5-Cyclohexatrien bezeichnet.
| Historische Strukturvorschläge | ||

|

|

|
| Von Adolf Karl Ludwig Claus (1867)[22] | Von James Dewar (1869)[23] | Von Albert Ladenburg (1869)[24] |

| ||
| Von August Kekulé (1865/1872)[25][26] | ||

|

|

|
| Von Henry Edward Armstrong (1887)[27] | Von Adolf von Baeyer (1888)[28] | Von Friedrich Karl Johannes Thiele (1899)[29] |
Schätzungen zufolge gibt es über 200 verschiedene mögliche Strukturen von (CH)6-Verbindungen, die als Valenzisomere des Benzols bezeichnet werden. Davon wurden einige, wie auch das Benzvalen oder das Dicyclopropenyl in den 1960er und 1970er synthetisiert.[30]
Industrielle Produktion

Als erste technische Anwendung patentierte der schottische Chemiker Charles Macintosh 1823 eine Methode zur Herstellung wasserdichter Kleidung, bei der er im benzolreichen Destillat des Steinkohlenteers Naturkautschuk auflöste und damit Baumwollstoff wasserdicht imprägnierte. Daraus ließ er Mackintosh genannte Regenmäntel fertigen.[31]
Das industrielle Interesse an Benzol begann mit Michael Faradays Synthese des Nitrobenzols aus Benzol und Salpetersäure, ein Ausgangsstoff für aus Anilin gewonnene Teerfarben. Im Jahr 1849 begann die industrielle Herstellung des Benzols und anderer Aromaten auf der Basis von Steinkohlenteer, einem Nebenprodukt der Koksgewinnung aus Steinkohle. Dessen Verfügbarkeit hing vom Koksbedarf der Stahlindustrie ab. Montanunternehmen gründeten bereits 1898 die Westdeutsche Benzol-Verkaufsvereinigung, die den Vertrieb von Benzol zum Geschäftszweck hatte. Durch den Zusammenschluss mit anderen Kohle- und Stahlunternehmen entstand 1918 der Benzol-Verband. Dieser formulierte 1924 ein Gemisch mit einem Mischungsverhältnis „von sechs Teilen Benzin und vier Teilen Benzol“ als Motorenbenzin und nannte es BV-Aral. Der Name Aral war ein Kunstwort, das sich aus den Anfangsbuchstaben der Komponenten Aromaten und Aliphaten zusammensetzte. Die Vereinigten Stahlwerke unter der Leitung von Albert Vögler traten 1927 dem Benzol-Verband bei. Hierdurch und durch den Zugriff auf die Patente des Kaiser-Wilhelm-Instituts für Kohlenforschung und damit auf die Patente für das Fischer-Tropsch-Verfahren wurde der Benzol-Verband zur größten Kraftstoffvertriebsorganisation in Deutschland ohne ausländische Beteiligung.[32]
Mit dem Beginn des Ersten Weltkriegs erhöhte sich der Bedarf an Aromaten. Besonders Toluol war für die Herstellung des Sprengstoffs TNT von kriegswirtschaftlicher Bedeutung, und die Kapazitäten aus der Koksherstellung deckten nicht mehr die Nachfrage. Daher wurden Verfahren zur Herstellung von Benzol und anderen Aromaten auf der Basis von Erdöl entwickelt. Im Jahr 1904 wurde Alexander Nikiforoff ein Patent für die Herstellung von Benzol aus Petroleum durch Pyrolyse erteilt. Er setzte dazu einen Naphthasiedeschnitt unter hohen Temperaturen und Drücken in ein Gemisch aus Benzol und seinen Derivaten wie Toluol, Xylol und Cumol um. Weiterhin fielen polycyclische aromatische Kohlenwasserstoffe wie Naphthalin und Anthracen dabei an. Aromaten wurden in England durch Pyrolyse von Schwerbenzin nach dem Hall-Verfahren gewonnen.[33]
Ein Meilenstein der Aromatenchemie war die Herstellung von Phenol aus Benzol, das während des Ersten Weltkriegs als Ausgangsstoff für Pikrinsäure verwendet wurde, ebenfalls ein Sprengstoff.[31] Der Umgang mit Benzol führte jedoch bei den Arbeitern in Kokereien zu vermehrtem Auftreten von benzolbedingten Berufskrankheiten. Den ersten Bericht über die mögliche Rolle der beruflichen Exposition gegenüber Benzol bei der Entstehung von Purpura bei einem jungen Mann, der in einer chemischen Reinigung in Frankreich beschäftigt war, veröffentlichten A. Le Noir und J. Claude im Jahr 1897.[34] Im selben Jahr berichtete Santessen von seinen Beobachtungen einer aplastischen Anämie bei jungen Frauen, die in Schweden bei der Herstellung von Fahrradreifen tätig waren.[35]

(c) Erik Liljeroth, Nordiska museet, CC BY 4.0
Von großer Bedeutung für die industrielle Nutzung von Benzol war die Styrolproduktion durch die I.G. Farben. Nachdem der Konzern zunächst ein Verfahren zur Herstellung von Styrol aus Ethylbenzol und anschließend von Polystyrol aus Styrol perfektioniert hatte, brachte er 1931 Polystyrol auf den Markt. Der Entdeckung der Nylon-Synthese aus Hexamethylendiamin und Adipinsäure durch Wallace Hume Carothers von DuPont im Jahr 1935 folgte ein Verfahren zur Hydrierung von Benzol zu Cyclohexan als Ausgangsstoff für die Nylonherstellung.[31]
Der Trend zu einer erhöhten Nachfrage nach Toluol setzte sich im Zweiten Weltkrieg fort, außerdem stieg die Nachfrage der chemischen Industrie nach Benzol und anderen Aromaten für die Herstellung von Ethylbenzol, Arylsulfonaten und Phenol. Während des Zweiten Weltkriegs entwickelte sich der von der Firma M. W. Kellogg konzipierte Hydroforming-Prozess, der auf dem DHD-Verfahren beruht, innerhalb weniger Jahre zum größten Lieferanten von hochoktanigen Motorenbenzinen, Toluol, Benzol und anderen Aromaten.[36] Dazu wurden naphthenreiche Naphthaschnitte unter Wasserstoffdruck mit einem Katalysator aus Molybdän(VI)-oxid auf Aluminiumoxid dehydriert beziehungsweise dehydrocyclisiert. Das dabei entstandene flüssige Produkt, das so genannte „Hydroformat“, enthielt über 50 Volumenprozent Aromaten.[37]
Die Nachfrage der chemischen Industrie nach gasförmigen Olefinen bedingte die Entwicklung weiterer Crackprozesse, entweder auf Basis gasförmiger oder flüssiger aliphatischer Kohlenwasserstoffe. Neben den Zielprodukten Ethylen, Propylen und den Butenen fielen als flüssiges Nebenprodukt bei allen Pyrolyseprozessen Aromaten, darunter Benzol, in großen Mengen an. In den Vereinigten Staaten entwickelte die Firma United Gas Improvement Co. den so genannten Ugite-Prozess, eine Pyrolyse von Erdölfraktionen. In England lieferte der Catarol-Prozess die nachgefragten Olefine sowie die Aromaten.[38][39]
In den Nachkriegsjahren begann Vladimir Haensel bei UOP mit der Entwicklung des Platforming-Prozesses. Bei dem Verfahren wird ein überwiegend aliphatisches Naphtha unter Wasserstoffdruck bei etwa 500 °C über einem Platin-Aluminiumoxid-Katalysator zu einem aromatenreichen Produkt umgesetzt. Die erste Anlage wurde 1949 in Betrieb genommen und der Prozess wurde bald zum größten Lieferanten von Aromaten, hochoktanigen Benzin und Wasserstoff.[40] So lag die Produktion von Benzol unter Verwendung von Steinkohlenteer 1953 in den Vereinigten Staaten noch bei 76,9 %, war aber bis 1986 bereits auf etwa 6 % gesunken. In Deutschland erhöhte sich die Produktion durch petrochemische Prozesse von 330.000 Tonnen im Jahr 1965 innerhalb von fünf Jahren auf 820.000 Tonnen. Die Reduktion und das letztendliche Verbot von Tetraethylblei in Benzin, das eine Zeit lang zum Teil durch Benzol und andere Aromaten als Oktanzahlverbesserer ersetzt wurde, trug zu der erhöhten Nachfrage bei.[41]
Durch die zunehmende industrielle Nutzung nahm die Zahl der durch Benzol verursachten Berufskrankheiten zu. Die American Conference of Governmental Industrial Hygienists legte 1946 den ersten Arbeitsplatzgrenzwert für Benzol auf 325 Milligramm pro Kubikmeter fest. Im Jahr 1963 wurde der Grenzwert auf ein Drittel des Werts gesenkt. Die meisten europäischen Länder haben 1997 Grenzwerte von 1,63 bis 3,25 Milligramm pro Kubikmeter festgelegt, berechnet anhand eines Bezugszeitraumes von acht Stunden.[42]
21. Jahrhundert
Seit dem 1. Januar 2010 gibt es europaweit einen Grenzwert für Benzol in der Außenluft, der zum Schutz der menschlichen Gesundheit festgelegt wurde. Die Konzentration darf im Jahresdurchschnitt 5 Mikrogramm pro Kubikmeter nicht mehr übersteigen. Dieser Wert wird in Deutschland in vielen Messstationen überwacht, wobei nach industrienahen, Hintergrund- und Verkehrswerten unterschieden wird. Die Messungen im Jahr 2019 lagen alle unterhalb des Schwellenwerts. Im Industriestandort Leuna etwa wurde ein Jahresmittelwert von 0,5 Mikrogramm pro Kubikmeter ermittelt, in der Kölner Innenstadt ein Wert von 1 Mikrogramm pro Kubikmeter. Die niedrigsten Werte von 0,28 Mikrogramm pro Kubikmeter wurden in der Eifel gemessen, der Höchstwert von 3,3 Mikrogramm pro Kubikmeter in Bottrop.[43]
Zwar ist der Gesamtgehalt an Benzol in der Luft in Europa und den Vereinigten Staaten seit vielen Jahren rückläufig, jedoch kann die lokale Belastung erhöht sein. So enthalten in vielen Teilen der Welt Schiefervorkommen beträchtliche Reserven an Erdgas und Erdöl und die Gewinnung von Erd- oder Schiefergas aus Schiefervorkommen ist durch Hydraulic Fracturing wirtschaftlich möglich geworden, jedoch besteht die Gefahr der Luftverschmutzung durch Freisetzungen von organischen Verbindungen aus Bohrlöchern oder Verdichterstationen. Unter anderem enthalten die bei diesem Verfahren freigesetzten flüchtigen organischen Verbindungen Benzol, das wegen der damit verbundenen Gesundheitsrisiken Anlass zur Sorge gibt.[44] Bei Luftuntersuchungen in der Nähe von Hydraulic-Fracturing-Förderstätten in Wyoming im Jahr 2016 überschritten etwa 40 % der Proben die von der Agency for Toxic Substances and Disease Registry, einer US-amerikanischen Bundesbehörde für öffentliche Gesundheit, festgelegten Grenzwerte für Benzol.
In den Jahren seit 2000 hat die Nachfrage nach Benzol stetig zugenommen, und allein von 2015 bis 2021 stieg das weltweite Benzolmarktvolumen von 48,82 auf 58,38 Millionen Tonnen.[45]
Vorkommen
Terrestrische Vorkommen
Benzol kommt im Erdgas, Erdöl und Steinkohlenteer vor. Der Benzolanteil im Leichtöl aus der Verkokung der Steinkohle beträgt etwa 58 %; pro Tonne verkokter Steinkohle fallen zwischen 5 und 9 Kilogramm Benzol an.[46] Der Benzolgehalt von kanadischem Rohöl kann bis zu 0,9 % betragen, während andere Rohöle aus den USA, Kuwait oder der Nordsee einen Gehalt von bis zu 0,7 % aufweisen. Der Aromatengehalt in Naphthasiedeschnitten zwischen 40 und 200 °C von kanadischem „Turner Valley“ oder mexikanischem „Altamira“-Öl beträgt etwa 14 %, Öle aus Pennsylvania weisen einen Gehalt von etwa 8 % auf.[47] In der Europäischen Union darf Erdgas Benzol in Höhe von über 0,1 Gewichtsprozent enthalten, jedoch muss der Gehalt unterhalb von 0,1 Volumenprozent liegen.[48] In Motorenbenzin liegen die Werte zwischen 0,1 und 8,6 %, wenngleich viele Länder den Benzolgehalt seit den späten 1990er Jahren begrenzt haben. Benzin, dem Benzol als Oktanzahlverbesserer zugesetzt wurde, konnte früher bis zu 33 % Benzol enthalten.[49] Vor der Einführung der Oktanzahl als Maß für die Klopffestigkeit erfolgte die Einteilung der Benzinqualitäten durch das sogenannte Benzoläquivalent. Dabei wurde dem Benzin so lange Benzol zugegeben, bis die Mischung die Klopffestigkeit eines Vergleichsbenzins erreichte.[46] Die Oktanzahl von reinem Benzol beträgt 97.[50] Das durch die Isobutan/Buten-Alkylierung hergestellte Alkylatbenzin dagegen, das für den Betrieb von etwa Rasenmähern oder Kettensägen eingesetzt wird, enthält nur sehr wenig oder kein Benzol.[51]
Beim Rauchen von Zigaretten wird Benzol in Mengen von 10–100 Mikrogramm pro Zigarette freigesetzt. Die durchschnittliche Benzolbelastung durch Rauchen beträgt für Raucher 1,8 Milligramm pro Tag bei einem Konsum von 32 Zigaretten pro Tag und 0,05 Milligramm pro Tag für Passivraucher. Die durchschnittliche Belastung etwa beim Tanken beträgt nur einen Bruchteil der Belastung durch Rauchen.[52]
In Erfrischungsgetränken, beispielsweise in Kirschsaft,[53] wurde Benzol nachgewiesen, das vermutlich aus dem lichtinduzierten radikalischen Zerfall von Benzaldehyd stammt. Durch die Verwendung von getönten Glasbehältern ist es möglich, die Bildung von Benzol in benzaldehydhaltigen Getränken zu verhindern.[54]
Extraterrestrische Vorkommen

Das am häufigsten vorkommende schwere Molekül in der Atmosphäre des Titan ist das Benzol. Es wurde mittels des Infrarotspektrometers an Bord von Cassini detektiert. Die Vorkommen nehmen von Süden nach Norden um etwa eine Größenordnung zu, wobei der Stoffmengenanteil zwischen 6,1 × 10−10 und 3,5 × 10−9 liegt.[55] Das Voyager Infrarot-Interferometer-Spektrometer-Experiment entdeckte Benzol 1985 erstmals in der Jupiteratmosphäre. Neuere Beobachtungen durch das Infrared Space Observatory wiesen 1997 ebenfalls Benzol nach, ebenso das Massenspektrometer der Galileo-Sonde im darauffolgenden Jahr. Die Benzolbildung in der Jupiteratmosphäre wird auf sukzessive Additionsreaktionen von Acetylen zurückgeführt, wobei die detaillierte Reaktion nicht bekannt ist.[56] In der oberen Atmosphäre des Saturn wurde Benzol mit dem Cassini Ultraviolet Imaging Spectrograph nachgewiesen.[57] Mittels eines Ionen-Neutral-Massenspektrometers an Bord der Cassini-Sonde konnten in den Wasserdampffahnen von Enceladus verschiedene kleinere organische Moleküle wie Formaldehyd und Spuren komplexerer organischer Moleküle wie Benzol nachgewiesen werden.[58] In extraterrestrischen Objekten wie dem protoplanetarischen Nebel CRL 618 sowie in kohlenstoffhaltigen Chondriten wurde Benzol ebenfalls nachgewiesen.[59][60]
Benzol ist ein häufig vorkommendes Molekül im interstellaren Medium. Ein möglicher Bildungsweg verläuft über die strahlenchemische Umwandlung von Propargylalkohol. Dieses zerfällt bei Bestrahlung in Propragylradikale des Typs C3H3, die eine Vorstufe für die Bildung von Benzol darstellen.[61] Durch die Reaktion des entstehenden Benzols mit interstellarem Ethin entstehen polycyclische aromatische Kohlenwasserstoffe, die etwa 30 % des interstellaren Kohlenstoffs auf sich vereinen.[62]
Gewinnung und Herstellung

Raffinerien erzeugen Benzol als Nebenprodukt bei der Benzinherstellung und lieferten 2019 etwa 60 % der US-amerikanischen Benzolproduktion. Die Petrochemieproduzenten bevorzugen in erster Linie die selektive Toluol-Disproportionierung, bei der neben Benzol gezielt p-Xylol erzeugt wird. Zu den führenden Herstellern von Benzol gehören BASF, Chevron Corporation, Citgo, ExxonMobil, LyondellBasell, LG Chem, Marathon Petroleum, Royal Dutch Shell, TotalEnergies und Valero Energy. 2002 wurden global rund 94 % des Benzols aus Erdöl gewonnen, davon 40 % aus Pyrolysebenzin, 54 % aus Reformatbenzin inklusive De- und Transalkylierung, 5 % aus Kohle und Kohlenteer und etwa 1 % auf Basis von C3/C4-Schnitten. Im Jahr 2001 wurden weltweit etwa 40 Millionen Tonnen Benzol hergestellt.[64]
Destillation von Steinkohlenteer

Für den kommerziellen Einsatz bis zum Zweiten Weltkrieg wurde Benzol als Nebenprodukt bei der Produktion von Koks für die Stahlindustrie erhalten, meist aus der Destillation von aus Koks erzeugtem Steinkohlenteer.[65] Der Steinkohlenteer fällt bei der Verkokung im Bereich von etwa 350 bis 480 °C an. Zur Weiterverarbeitung müssen zunächst Wasser sowie Ammoniak und Schwefelwasserstoff entfernt werden. Die Trennung der im Steinkohlenteer enthaltenen Fraktionen erfolgt durch Destillation. Ein in Deutschland entwickeltes Verfahren ist das Rüttgers-Verfahren, bei dem der Steinkohlenteer im Sumpfumwälzverfahren erhitzt wird. Das Rüttgers-Verfahren erlaubt eine gute Trennung der verschiedenen Fraktionen. Benzol fällt als Bestandteil der Leichtöl- und der Naphthalinölfraktion beziehungsweise der Carbolölfraktion an.[66]
Pyrolyse
Bei erhöhten Temperaturen und unter Einhaltung einer bestimmten Verweilzeit und ohne die Anwesenheit von Katalysatoren oder Druck bilden gesättigte und ungesättigte gasförmige Kohlenwasserstoffe wie Ethan, Ethen, Propan, Propen sowie Butane und Butene eine flüssige Phase, die hauptsächlich aus Benzol und anderen niedermolekularen Aromaten besteht. Die optimale Temperatur für die Aromatenbildung liegt bei 800 bis 1000 °C, bei Verweilzeiten im Bereich von einer bis mehreren Sekunden. Für das Cracken von flüssigen Kohlenwasserstoffgemischen wie beispielsweise Naphthafraktionen beträgt die Temperatur für eine Aromatenausbeute von etwa 70 % ungefähr 700 °C bei Verweilzeiten von bis zu 20 Sekunden.[67]
Benzol kann gemeinsam mit anderen Aromaten aus nachwachsenden Rohstoffen und Reststoffen hergestellt werden. Dafür sind verschiedene Pyrolysereaktionen bekannt.[68][69] Die industrielle Produktion wurde von verschiedenen Firmen untersucht, allerdings gibt es noch keine Produktion im industriellen Maßstab.[70][71] In diesen Projekten werden nur Biomasse, die nicht in Flächenkonkurrenz zur Nahrungsmittelerzeugung steht, und Plastikmüll als Rohstoffe genutzt. Durch diese Produktionsweise kann die CO2-Bilanz im Vergleich zur petrochemischen Herstellung der Aromaten um 70–90 % reduziert werden.[72]
Steamcracken

Benzol wird in Europa vorwiegend aus dem Pyrolysebenzin des Steamcrackens gewonnen, eines Verfahrens zur Herstellung von Ethylen und anderen Olefinen aus aliphatischen Kohlenwasserstoffen. In Steamcrackern werden Aromaten nicht zu Olefinen umgesetzt, so dass ihr Vorhandensein die Betriebskosten und die erforderliche Größe der Cracker erhöht. Daher müssen die Aromatenfraktionen aus dem Naphthazulauf zunächst entfernt werden. Dies geschieht normalerweise durch Flüssig-Flüssig-Extraktion.[31]
Abhängig von dem Ausgangsmaterial, das zur Herstellung der Olefine verwendet wird, wird ein benzolreiches flüssiges Nebenprodukt, das Pyrolysebenzin genannt wird, erhalten. Beim Einsatz schwererer Rohstoffe erhöht sich die Menge der erzeugten Aromaten.[64] Pyrolysebenzin kann mit anderen Kohlenwasserstoffen als Benzinzusatz gemischt, durch ein Extraktionsverfahren oder durch Reaktivdestillation zur Gewinnung von Benzol und anderen Aromaten verwendet werden.
Katalytisches Reforming
Benzol wird durch katalytisches Reforming von Naphtha, eine Mischung aus paraffinischen und naphthenischen Kohlenwasserstoffen mit Siedepunkten zwischen 60 und 200 °C, gewonnen. In Gegenwart von Wasserstoff werden die Kohlenwasserstoffe bei 500–525 °C und Drücken im Bereich von etwa 8 bis 50 bar über einen bifunktionellen Platin/Rhenium- oder Platin/Zinnchloridkatalysator geleitet. Benzol entsteht dabei durch Dehydrocyclisierung von n-Hexan zu Cyclohexan oder durch Umlagerung von Methylcyclopentan zu Cyclohexan und anschließender Dehydrierung.
Zur Optimierung der BTEX-Aromatenausbeute wird als Rohstoff ein C6/C8-Schnitt eingesetzt, welcher vor allem Hexane, Heptane und Octane enthält.[73] Die Abkürzung BTEX steht für Benzol, Toluol, Ethylbenzol, und Xylole.
Trennung der Aromaten

Für die Trennung von Aromaten und Nichtaromaten stehen vier bewährte Verfahren zur Verfügung. Zu diesen gehören die Flüssig-Flüssig-Extraktion, die Extraktivrektifikation, die Azeotroprektifikation und die Adsorption an Adsorbentien wie Aktivkohle, Kieselgel oder Molekularsieben. Von diesen Verfahren haben die Flüssig-Flüssig-Extraktion und die extraktive Destillation die größte technische und wirtschaftliche Relevanz.
Die Flüssig-Flüssig-Extraktion erfolgt im Gegenstromverfahren in Extraktionskolonnen. In einer Extraktionskolonne erfolgt die Zugabe des Lösungsmittels im oberen Teil der Kolonne, das zu trennende Gemisch tritt in der Mitte ein. Die Nichtaromaten verlassen den Extraktor am Kopf der Kolonne, das mit Aromaten beladene Lösungsmittel wird im Sumpf der Kolonne abgezogen. Das Verfahren findet beispielsweise Anwendung bei der Abtrennung der Aromaten aus dem Reformat des katalytischen Reformings, bei dem der Aromatengehalt etwa 20 bis 65 % beträgt.[74]
| Schmelz- und Siedepunkte der BTEX-Aromaten[75] | ||
|---|---|---|
| Aromat | Schmelzpunkt | Siedepunkt |
| Benzol | 5,5
|
80,1
|
| Toluol | −95,0
|
110,6
|
| p-Xylol | 13,3
|
138,4
|
| o-Xylol | −25,2
|
144,4
|
| m-Xylol | −47,9
|
139,1
|
| Ethylbenzol | −95,0
|
136,2
|
Die Flüssig-Flüssig-Extraktion von Aromaten aus Petroleumfraktionen nach dem Udex-Prozess unter Verwendung eines Gemischs aus Diethylenglykol und Wasser als Lösungsmittel geht auf Dow Chemical zurück, deren Lizenzen später von der UOP erworben wurden.[76] Im Udex-Prozess, der bei einer Temperatur zwischen 130 und 150 °C und einem Druck von etwa 5 bis 7 bar durchgeführt wird, beträgt die Rückgewinnung der Aromaten etwa 91 bis 99 %, mit einer Reinheit von 96 bis 98 %. Im von der Shell entwickelten Sulfolan-Prozess dient Sulfolan als Lösungsmittel, die Extraktion erfolgt bei Temperaturen zwischen 50 und 100 °C.[74]
Die Extraktivrektifikation ist eine Extraktion unter den Bedingungen einer Rektifikation. Dazu wird dem zu trennenden Gemisch ein Lösungsmittel zugegeben, in dem sich die Aromaten lösen. Dadurch wird der Partialdampfdruck der Aromaten erniedrigt und eine destillative Trennung wird möglich. Die Nichtaromaten werden dabei am Kopf der Kolonne abgezogen, das Aromaten-Lösungsmittelgemisch im Sumpf der Kolonne. Das Verfahren wird zum Beispiel zur Trennung von Aromaten aus Steamcrackerbenzinen mit einem Aromatengehalt von 65 bis 90 % angewendet.[74]
Bei der Azeotroprektifikation wird dem zu trennenden Gemisch ein polares Lösungsmittel wie Aceton zugegeben, welches mit den Nichtaromaten ein Azeotrop bildet. Damit gelingt etwa die Trennung eines Benzol-Cyclohexan-Gemisches. Das Verfahren wird typischerweise bei hohen Aromatenkonzentrationen von über 90 % angewendet.[74] Phenol wurde in den 1940er Jahren als geeignetes Lösungsmittel zur Steigerung der Benzolausbeute und -reinheit bei der Extraktivdestillation eingesetzt. Kieselgel vermag selektiv Aromaten aus Kohlenwasserstoffgemischen zu adsorbieren; dies wurde etwa im Arosorb-Verfahren genutzt. Dieses Verfahren hat jedoch seine Bedeutung verloren.[76] Benzol lässt sich destillativ von den so gewonnenen Aromatengemischen abtrennen.
Transalkylierung und thermische Dealkylierung
Bei der Transalkylierung werden zwei Toluolmoleküle zu einem Benzol- und einem Xylolmolekül transalkyliert. Als Nebenprodukt entstehen höher alkylierte Produkte, Methan wird kaum gebildet. Die Transalkylierung erfolgt in der Gasphase mit Aluminosilikat- oder Zeolithkontakten bei erhöhten Temperaturen. Die Reaktionen der Kohlenwasserstoffe finden an Brønsted-saure Stellen auf den Zeolithen statt. Die Art, Stärke und Anzahl dieser Stellen lassen sich durch temperaturprogrammierte Desorption von Ammoniak nachweisen.[77]
Es gibt verschiedene industrielle Verfahren, die sich durch die Reaktionsbedingungen, die verfahrenstechnischen Anlagen und die Katalysatoren unterscheiden. Da p-Xylol ein technisch wichtiges Xylol-Isomer ist, wird die selektive Bildung von etwa 90 % dieses Isomers durch die Verwendung geeigneter Katalysatoren wie beispielsweise ZSM-5-Zeolithen angestrebt.[77]
Ein weiteres Verfahren zur Benzolherstellung ist die thermische Dealkylierung von Toluol. Hierbei wird bei 780 °C und einem Druck von 40 bar die Methylgruppe des eingesetzten Toluols abgespalten.[78] Trägergas im Reaktor ist hierbei 90-prozentiger Wasserstoff. Nach Abkühlung und der Gas-Flüssigkeits-Trennung sowie Reinigung wird so Reinstbenzol gewonnen.
Weitere Prozesse
Bei der nach dem deutschen Chemiker Walter Reppe benannten Reppe-Chemie wird Ethin in Anwesenheit eines Katalysator zu Benzol umgesetzt.[79]
Diese Herstellmethode hat keine technische Relevanz. Jedoch ist die Cyclisierung von Alkinen ein möglicher Weg in der organischen Synthese von substituierten Benzolen.[80] Die Oxidation von Propen zu Benzol wird durch Oxide des Indiums und des Bismuts katalysiert. Als Zwischenprodukte der Reaktion entstehen 1,5-Hexadien und Acrolein, die weiter zu Benzol oxidiert werden.[81]
Das Methanol-to-Aromatics-Verfahren gilt als erfolgversprechender Ansatz zur Gewinnung von Benzol aus Biomasse, Abfall, Kohle, Erdgas oder Kohlenstoffdioxid über die Zwischenstufe Methanol und dessen Umwandlung an modifizierten Zeolithen des ZSM-5-Typs.[82] Die Mehrzahl der Methanol-to-Aromatics-Studien befanden sich im Jahr 2021 jedoch noch im Labor- oder Pilotanlagenmaßstab.[83] Durch die Dehydrocyclodimerisierung von Erdgaskomponenten wie Propan und Butan lässt sich im Cyclar-Prozess ebenfalls Benzol gewinnen.[84]
Eigenschaften
Physikalische Eigenschaften

Benzol kristallisiert bei −3 °C in einer orthorhombischen Kristallstruktur mit der Raumgruppe Pbca (Raumgruppen-Nr. 61) und den Gitterparametern a = 746, b = 967 und c = 703 pm.[85] Benzol ist eine farblose, klare, mit einem Brechungsindex von 1,5011 stark lichtbrechende, leicht flüchtige und leicht brennbare Flüssigkeit und brennt mit leuchtender, stark rußender Flamme.[1] Der Brechungsindex von Benzol stimmt recht gut mit dem von Fensterglas überein. Ein Glasstab, der in Benzol eingetaucht ist, ist daher nahezu unsichtbar. Die Viskosität des Benzols ist geringer als die des Wassers, es ist dünnflüssiger. Es erstarrt bei 5,5 °C und siedet bei 80,1 °C.[1] Bei Zimmertemperatur (20 °C) hat es eine Dichte von 0,88 Kilogramm pro Liter und einen Dampfdruck von 100 hPa.[1]
Der thermische Ausdehnungskoeffizient γ des flüssigen Benzols beträgt bei 25 °C; 0,00114 K−1. Die spezifische Wärmekapazität (flüssig) beträgt bei 20 °C; 1,738 kJ/(kg·K), die Wärmeleitfähigkeit bei 20 °C ist 0,144 W/(m·K), die dynamische Viskosität bei 20 °C; 0,648 mPa·s, dies ergibt die Prandtl-Zahl bei 20 °C von 7,8.[86] Die Permittivitätszahl beträgt 2,28. Die Verdampfungsenthalpie beträgt am Verdampfungspunkt (80 °C); 30,75 kJ/mol, dies entspricht einer Verdampfungsentropie von 87 J/(K·mol).[87] Der Heizwert des Benzols beträgt 40.580 kJ/kg, die Verbrennungsenthalpie −3257,6 kJ/mol bei flüssigem Benzol und −3301 kJ/mol bei gasförmigem.
Benzol bildet mit 8,83 % Wasser ein Azeotrop, das bei 69,25 °C siedet. Mit gesättigten Kohlenwasserstoffen wie Methylcyclopentan, Cyclohexan und 2,4-Dimethylpentan sowie Ethanol bildet Benzol ebenfalls Azeotrope. Der Siedepunkt kann bis zu 12 °C gegenüber dem des reinen Benzols erniedrigt sein.[88] Die Trennung der aliphatischen und aromatischen Komponenten von Ölfraktionen wird dadurch erschwert.
Spektroskopische Eigenschaften
Im 1H-NMR-Spektrum zeigen die Wasserstoffatome eine ungewöhnlich schwache Abschirmung (Singulett bei 7,28 ppm in CDCl3 für alle sechs Wasserstoffatome), die durch den vom Magnetfeld des Spektrometers induzierten Ringstrom verursacht wird.[89]
Im 13C-NMR-Spektrum zeigt Benzol in CDCl3 ein Signal bei 128,5 ppm für alle sechs Kohlenstoffatome.[89]
Im IR-Spektrum erscheint die Phenyl-Wasserstoffschwingung bei etwa 3.035 cm−1. Die C–C-Valenzschwingung erscheint bei 1.500 bis 2.000 cm−1. Bei 650 bis 1.000 cm−1 befinden sich die C–H-Deformationsschwingungen.[89]
UV-spektroskopisch lässt sich Benzol noch in hoher Verdünnung an zwei typischen Absorptionen (π-π* Übergänge) im Bereich von 200 bis etwa 250 nm nachweisen.
Molekulare Eigenschaften
Benzol ist der einfachste der benzoiden aromatischen Kohlenwasserstoffe, die auch Arene genannt werden. Das Molekül ist planar: sowohl der sechsatomige Kohlenstoffring als auch die sechs Wasserstoffatome liegen in einer gemeinsamen Ebene. Es weist sechs gleich lange Kohlenstoff-Kohlenstoff-Bindungen von 139 pm auf. Dieser Wert liegt zwischen dem für eine Einfachbindung von etwa 147 pm und eine Doppelbindung von etwa 135 pm und ist ein Kennzeichen für den aromatischen Charakter von Benzol. Die Länge aller Kohlenstoff-Wasserstoff-Bindungen beträgt 109 pm. Der Bindungswinkel zwischen den benachbarten Kohlenstoffatomen sowie zwischen der Kohlenstoff-Kohlenstoff- und der Wasserstoff-Kohlenstoffbindung beträgt 120°.[85][92][93]
Das Benzolmolekül verfügt über zahlreiche Symmetrieelemente: Die Ebene, in der alle Atome liegen, ist zugleich eine horizontale Spiegelebene (). Sechs weitere Spiegelebenen stehen senkrecht dazu: drei vertikale (), die jeweils entlang zweier gegenüberliegende C–H-Bindungen verlaufen, und drei diagonale (), die jeweils zwei gegenüberliegende C–C-Bindungen halbieren. Ihre gemeinsame Schnittgerade bildet eine sechszählige Drehachse (). Das Molekül ist überdies punktsymmetrisch, sodass sich alle genannten Symmetrieelemente und noch weitere im Inversionszentrum () in der Mitte des Moleküls schneiden. Insgesamt gehört es zur Punktgruppe .
Soll die Struktur mit Hilfe einer Valenzformel dargestellt werden, so ist dies als 1,3,5-Cyclohexatrien möglich mit lokalisierten Doppelbindungen an festgelegten Positionen als eine von zwei gleichwertigen mesomeren Grenzstrukturen, die – jede für sich genommen – die Bindungsverhältnisse nur unzureichend beschreiben. Tatsächlich ist Benzol stabiler als es bei hypothetischem 1,3,5-Cyclohexatrien zu erwarten wäre, was als Mesomerie- oder auch Resonanzstabilisierung bezeichnet wird. Diesen Effekt der Mesomerie im Benzolmolekül erkannte Linus Pauling in den 1930er Jahren.[94]

Schemazeichnung zur Mesomerie des Benzols. Das Molekül mit delokalisierten π-Elektronen (betont durch den Kreis innerhalb des Rings, blau) hat eine niedrigere Energie als die Grenzstrukturen mit lokalisierten Doppelbindungen (rot). Der Unterschied ist die Mesomerieenergie EM (Resonanzenergie).
Empirisch lässt sich die Resonanzenergie etwa über die Hydrierungsenthalpie ermitteln. Die Hydrierungsenthalpie von Cyclohexen beträgt −119,6 kJ/mol; für eine Cyclohexatrien-Struktur ohne Resonanz müsste die Hydrierungsenthalpie also das Dreifache dieses Wertes betragen, somit −358,8 kJ/mol. Die gemessene Hydrierungsenthalpie beträgt jedoch −208,4 kJ/mol. Die Differenz von 150 kJ/mol entspricht der Resonanzenergie.[95]
Eine theoretische Beschreibung der elektronischen Verhältnisse im Molekül, die diesen Effekt sowie weitere chemische und physikalische Eigenschaften des Benzolmoleküls quantitativ erklärt, liefert die Molekülorbitaltheorie. Die hohe Symmetrie des Moleküls erlaubt dabei eine Reihe sowohl mathematischer als auch physikalischer Vereinfachungen. Eine qualitativ richtige Beschreibung ist bereits im Rahmen der Hückel-Näherung möglich:[96][97] Aufgrund der Planarität werden die Wechselwirkungen der Valenzelektronen in zwei Gruppen unterteilt, die als unabhängig angenommen werden. Diejenigen Atomorbitale, die – im Hinblick auf den winkelabhängigen Anteil der Wellenfunktion – in der Molekülebene liegen (H1s, C2s, C2px, C2py), werden getrennt von denjenigen betrachtet, die senkrecht zur Molekülebene orientiert sind (C2pz), sodass die Molekülebene zugleich ihrer Knotenebene entspricht. Zur weiteren Vereinfachung werden die C-Atome als sp2-hybridisiert beschrieben. Die entlang der Kernverbindungsachsen orientierten Hybridorbitale (aus C2s, C2px, C2py) bilden dann ein Gerüst aus 18 σ-Orbitalen in der Molekülebene, die C2pz-Orbitale ein davon näherungsweise unabhängiges System von sechs π-Orbitalen. Während die Elektronen in σ-Orbitalen in guter Näherung als zwischen direkt benachbarten Atomkernen lokalisiert betrachtet werden können, sind jene in π-Orbitalen in hohem Maße delokalisiert. Die resultierende Mehrzentrenbindung muss mithilfe von Molekülorbitalen beschrieben werden. Der einfachste Ansatz hierfür besteht darin, die Molekülorbitale als symmetrieadaptierte Linearkombinationen von Atomorbitalen darzustellen. Man gelangt zu sechs π-Orbitalen, von denen im Vergleich mit den sechs isolierten 2pz-Orbitalen drei niedrigere Energie besitzen und drei höhere; erstere haben bindenden Charakter, da ihre Besetzung mit Elektronen das Molekül insgesamt stabilisiert, letztere dagegen antibindenden. Die Symmetrie des Benzolmoleküls bringt es dabei mit sich, dass je ein Paar bindender und antibindender π-Orbitale energetisch entartet ist. Im Grundzustand sind die drei bindenden π-Orbitale mit sechs Elektronen besetzt, sodass die entarteten π-Orbitale die Grenzorbitale (Highest Occupied Molecular Orbitals und Lowest Unoccupied Molecular Orbitals) des Moleküls bilden, woher ihre große Bedeutung für chemische Reaktionen von Benzol und anderen Stoffen mit Phenylgruppe rührt; die σ-Elektronen sind demgegenüber nur wenig reaktiv. Die aufsummierte Elektronendichte aller sechs π-Elektronen ist dabei gleichmäßig über alle sechs C-Atome verteilt, weswegen auch von einer „Ladungswolke“ über und unter dem Ring die Rede ist.
Einen schnellen Zugang zu diesen Ergebnissen der Methode von Erich Hückel liefert die Hückel-Regel: Bei Benzol handelt es sich um ein planares, cyclisch durchkonjugiertes Molekül mit [4n+2] π-Elektronen, ergo um ein besonders stabiles Molekül, das als Aromat bezeichnet wird. Die Energieniveaus des π-Systems lassen sich dem entsprechenden Musulin-Frost-Diagramm entnehmen.

Energieniveauschema der π-Orbitale mit Darstellung der symmetrieadaptierten Linearkombinationen von C2pz-Orbitalen im Benzol.
Im energieärmsten a2u-Orbital (π1) ist die einzige Knotenebene die in der Molekülebene liegende Spiegelebene (). Bei den beiden e1g-HOMOs (π2/3) tritt jeweils eine dazu senkrechte Spiegelebene ( bei π2, bei π3) als zusätzliche Knotenebene auf; bei den beiden e2u-LUMOs (π4/5*) sind es je zwei Spiegelebenen als zusätzliche Knotenebenen (je eine und bei π4*, zwei bei π5*). Im energiereichsten b2g-Orbital (π6*) bilden alle drei -Ebenen Knotenebenen.
Die Hückel-Regel für Aromaten wird dadurch erfüllt, dass im Grundzustand alle bindenden Orbitale (π1/2/3) doppelt besetzt und alle antibindenden Orbitale (π4/5/6*) unbesetzt sind.Die Energien der Molekülorbitale von Benzol können photoelektronenspektroskopisch bestimmt werden. Beim Benzol befindet sich zwischen den π-Orbitalen bei 9,3 und 12,1 Elektronenvolt ein σ-Orbital bei 11,4 Elektronenvolt.[98]
Chemische Eigenschaften
Mit unpolaren, organischen Lösungsmitteln wie Ether, sowie mit Methanol, Ethanol, Essigsäureethylester, Aceton ist Benzol in jedem Verhältnis unbegrenzt mischbar, mit Wasser jedoch nur schlecht (maximal 1,8 Gramm Benzol pro Liter). Mit der Supersäure, die sich aus gasförmigem Bromwasserstoff und festem Aluminiumbromid (HBr/AlBr3) bildet, lässt sich Benzol zu einem Salz der Zusammensetzung [C6H7]+[Al2Br7]− protonieren.[99] Bei Temperaturen ab etwa 650 °C bilden sich in Gegenwart von Katalysatoren Diphenyl und andere polyaromatische Verbindungen aus Benzol.[41] Benzol hat einen charakteristischen Geruch. Die Geruchswahrnehmungskonzentration ist sehr niedrig und liegt bei 9 Milligramm pro Kubikmeter Luft.[100]
Oxidation
Benzol verbrennt mit gelber Flamme zu Wasser und Kohlenstoffdioxid, wobei die starke Rußentwicklung auf den hohen Kohlenstoffanteil der Verbindung hinweist. Die motorische Verbrennung als Benzin stellt quantitativ eine der wichtigsten Reaktionen von Benzol dar.
Vollständige Oxidation (Verbrennung) des Benzols:
Durch katalytische Oxidation von Benzol mit Luftsauerstoff mittels Vanadiumpentoxid- sowie Molybdänoxid-Katalysatoren bei etwa 450 °C entsteht Maleinsäureanhydrid.[41] Aufgrund des Verlustes von Kohlenstoff und der dadurch geringen Atomökonomie werden Verfahren mit einem C4-Rohmaterial bevorzugt.
Radikalische Substitution
Radikalische Substitutionen am Benzol finden im Vergleich zu Alkenen aufgrund der Stabilisierung durch die Aromatizität nicht statt. Eine Ausnahme bildet hierbei die sogenannte Sandmeyer-Reaktion, bei der aus Diazoniumsalzen in einer durch Kupfer katalysierten homolytischen Abspaltung von molekularem Stickstoff ein Phenyl-Radikal entsteht. Dieses ist hochreaktiv und reagiert sofort weiter. Ein wichtiges Merkmal der Aromatizität von Benzol ist das Ausbleiben einer Additionsreaktion mit Bromwasserstoffsäure oder Bromwasser.
Radikalische Addition
Beispiel für eine radikalische Additionsreaktion (Chlorierung):
Die Addition von Chlor an Benzol verläuft als Radikalkettenreaktion:[101]
- […]
Die Reaktion wird bei einer Temperatur von 15 bis 20 °C durchgeführt. Bei einem Umsatz von 12 bis 15 % wird die Reaktion abgebrochen und das Reaktionsgemisch aufgearbeitet.[101]
Elektrophile aromatische Substitution
Infolge seines elektronenreichen π-Systems wird Benzol bevorzugt von Elektrophilen angegriffen. Bei diesem Prozess wird ein Wasserstoffatom durch das Elektrophil substituiert. Bei der elektrophilen aromatischen Substitution handelt es sich um eine mehrstufige Reaktion. Im ersten Schritt bildet Benzol 1 in Wechselwirkung mit dem Elektrophil E+ den π-Komplex 2a. Unter Aufhebung der Aromatizität von 1 bildet sich aus diesem oder direkt aus den Ausgangsstoffen der Mesomerie-stabilisierte σ-Komplex 2b. Wird dieser Komplex deprotoniert, findet eine Rearomatisierung des Systems statt, und es entsteht das Endprodukt 3.
Auch bei der Friedel-Crafts-Alkylierung handelt es sich um eine elektrophile aromatische Substitution. Unter der katalytischen Wirkung einer Lewis-Säure wie Eisen(III)-chlorid (FeCl3) oder Aluminiumchlorid (AlCl3) oder einer starken Brønsted-Säure wie Schwefelsäure (H2SO4), Phosphorsäure (H3PO4) oder Fluorwasserstoff (HF) wird Benzol mit einem Alkylhalogenid, einem Alkohol, einem Alken oder einem Alkin zu einem Alkylaromaten umgesetzt.
Die entstehenden Alkylaromaten wie n-Dodecylbenzol finden nach Sulfonierung Verwendung als Rohstoffe für Waschmittel.
Durch eine Friedel-Crafts-Acylierung wird Benzol ebenfalls unter Lewis-Säure-Katalyse mit Carbonsäurehalogeniden umgesetzt. Dadurch wird eine Acylgruppe eingeführt.
Metallorganische Reaktionen
Im Bereich der metallorganischen Chemie wurden zahlreiche Übergangsmetallkomplexe synthetisiert, die Benzol als Ligand in verschiedenen Koordinationsmodi enthalten. Die Benzolringe können in den Komplexen verzerrt oder gebogen auftreten. Die mehrkernigen Benzol-Metall-Komplexe können als ein Ausschnitt einer Übergangsmetalloberfläche betrachtet werden, die chemisorbiertes Benzol aufweist, das an mehrere Oberflächenatome gebunden sein kann.
Benzol bildet mit Silberperchlorat einen Komplex aus Silberionen-Benzol-Ketten und Perchlorat-Ionen. Die Silberionen befinden sich oberhalb und unterhalb der Ringebenen über den Bindungen eins und vier des Benzolrings. Die Abstände zwischen den Kohlenstoffatomen der Bindungen des Benzolrings, die den Silberionen am nächsten liegen, sind im Vergleich zu den anderen Bindungen verkürzt. Durch die polarisierende Wirkung der Silberionen kommt es in diesen Bindungen zu einer Erhöhung der Elektronendichte.[102]
Eine weitere Metall-Benzol-Verbindung ist das erstmals 1955 von Ernst Otto Fischer und Walter Hafner dargestellte Bis(benzol)chrom, ein sogenannter Sandwichkomplex.[103]
Für die Synthese und die Untersuchung der Chemie des Bis(benzol)chroms und der Chemie der metallorganischen Sandwich-Verbindungen erhielt Ernst Otto Fischer 1973 den Nobelpreis für Chemie.[104]
Durch die Reaktion von Chromhexacarbonyl und Bis(benzol)chrom oder durch die Reaktion von Chromhexacarbonyl und Benzol lässt sich der sogenannte Klavierstuhlkomplex Tricarbonyl(η6-benzol)chrom synthetisieren.[105]
Der aromatische Ring des Komplexes kann nukleophile Additionsreaktionen eingehen, der Wasserstoff ist saurer als im freien Benzol, der Ring lässt sich durch die Reaktion mit Butyllithium lithieren.
Die Haptizität von Benzol als Ligand kann bei Redox-Reaktionen wechseln, etwa bei der Reduktion des Bis(benzol)ruthenium-Kations.[106]
Durch die Bestrahlung eines Rhodium-Cyclopentadienyl-Diethylenkomplexes in Benzol lassen sich zwei und dreikernige Rhodiumkomplexe herstellen. Im zweikernigen [CpRh]2-Benzolkomplex mit einer Rhodium-Rhodium-Metallbindung koordiniert das Benzol die beiden Rhodiumkerne verbrückend als μ2-Ligand. Die Kohlenstoffatome 1 bis 3 und 4 bis 6 des Benzols bilden dabei zwei Enylsysteme mit einer syn-(1-3-η:4-6-η)-Haptizität, das Benzol nimmt dabei eine Bootkonformation an.[107]
Im dreikernigen Rhodiumkomplex [(CpRh)3(μ3-η2:η2:η2-C6H6)] überbrückt das Benzol alle Rhodiumatome als μ3-Ligand.[107]
Substitutionsmuster
Bei der Monoderivatisierung des Benzols, bei der ein Wasserstoffatom durch eine andere Gruppe ersetzt wurde, entsteht auf Grund der Äquivalenz aller Wasserstoffatome nur ein mögliches Derivat. Bei der Einführung von zwei gleichen Substituenten treten drei verschiedene Derivate auf. Die relative Stellung der Substituenten wird mit ortho-, meta- und para- gekennzeichnet.
Bei der Einführung von drei gleichen Substituenten treten wiederum drei Isomere auf, die vicinal, symmetrisch und asymmetrisch genannt werden. Sind nur zwei der drei Substituenten gleich, ergeben sich sechs, bei drei verschiedenen Substituenten zehn mögliche Derivate.[108]


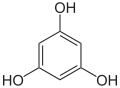
Pyrogallol,
1,2,3-Trihydroxybenzol,
vicinal-TrihydroxybenzolHydroxyhydrochinon,
1,2,4-Trihydroxybenzol,
asymmetrisch-TrihydroxybenzolPhloroglucin,
1,3,5-Trihydroxybenzol,
symmetrisch-Trihydroxybenzol
Benzolringöffnung
Benzolringe sind chemisch außerordentlich stabil und lassen sich nur mit wenigen Reaktionen aufbrechen. Bekannt ist die Hydroisomerisierung bei hohen Temperaturen. Diese ist jedoch nicht selektiv und liefert eine Reihe von Kohlenwasserstoffen als Reaktionsprodukt. Aus der Biochemie sind Dioxygenase-Enzyme bekannt, die aus Benzol Muconsäure herstellen. Weiterhin ist die Reaktion von Benzolderivaten mit Sauerstoff und Natriumazid bekannt, die Alkenylnitrile liefert.[109][110] Daneben kann Benzol durch längere Reaktion mit Wasserstoffperoxid und Osmium(VIII)-oxid als Katalysator in allo-Schleimsäure umgewandelt werden.[111]
Verwendung

Früher diente Benzol als gutes Lösungs- und Reinigungsmittel in einer Vielzahl von Anwendungen. In zunehmendem Maße wird Benzol als Lösungsmittel für Wachse, Harze und Öle durch weniger giftige Stoffe verdrängt. Im sogenannten Roselius-Verfahren fand es Verwendung zur Entkoffeinierung von Kaffee.[112] Im 19. und frühen 20. Jahrhundert gewann Benzol wegen seines angenehmen Geruchs als Aftershave an Bedeutung.[113] Es erhöht die Klopffestigkeit von Motorenbenzin, weshalb Benzol in der Entwicklung der Ottokraftstoffe eine wichtige Rolle einnahm. Einige frühere Lokomotiven mit Verbrennungsmotor benutzten einen Treibstoff, der hauptsächlich aus Benzol bestand. Seit 1998 ist es nur noch als Kraftstoffzusatz in einer Konzentration bis zu 1 % zulässig. Mit Ausnahme der Kraftstoffe dürfen in Deutschland wegen der damit verbundenen Gefahren Benzol und benzolhaltige Zubereitungen mit einem Gehalt von über 0,1 % Benzol nicht in Verkehr gebracht werden.[114] Die Verwendung von Benzol in großen Mengen erfolgt nur in geschlossenen Systemen und zu industriellen oder Forschungszwecken.
Benzol wird in der Petrochemie für die Synthese zahlreicher Stoffe verwendet. Zu den in großen Mengen aus Benzol hergestellten Chemikalien gehören Ethylbenzol, Cumol, Cyclohexan und Nitrobenzol.[115] Diese Verbindungen sind wiederum Ausgangsstoffe zur Synthese von Styrol, Phenol, Aceton, Cyclohexanol, Cyclohexanon und Anilin. Auf ihrer Basis werden Kunststoffe wie Polystyrol, Styrol-Butadien-Kautschuk, Nylon und Epoxidharze hergestellt. Darüber hinaus basieren viele andere Produkte, wie die waschaktiven Alkylbenzolsulfonate, technische Lösungsmittel, bestimmte Pestizide wie Lindan und Farbstoffe auf Benzol und seinen Derivaten.
Ethylbenzol
In industriellem Maßstab wird Ethylbenzol fast ausschließlich durch die säurekatalysierte Reaktion von Benzol und Ethylen hergestellt, geringe Mengen fallen bei der Aromatenfraktionierung an. Bezogen auf das Produktionsvolumen ist Ethylbenzol das größte Folgeprodukt von Benzol, und mehr als die Hälfte des Benzolverbrauchs entfällt auf seine Herstellung.[115]
Die Alkylierung erfolgt entweder in der Flüssigphase mit Aluminiumchlorid oder anderen Friedel-Crafts-Katalysatoren, wobei entstehender Chlorwasserstoff als Co-Katalysator dient. In der Gasphase erfolgt die Reaktion mit Phosphorsäure, Aluminiumsilikat oder einem Zeolithen wie ZSM5 als Katalysatoren.[116]
Die Alkylierungsreaktion in flüssiger Phase erfolgt bei einer Temperatur von etwa 90 °C und einem Druck von 1 bis 7 bar. Die Reaktion findet meist im Benzolüberschuss statt, um Mehrfachalkylierungen zu vermeiden.[116]
Der Gasphasenprozess mit Aluminiumsilikat (Al2O3 SiO2) oder auf Silikagel adsorbierter Phosphorsäure findet bei einer Temperatur von etwa 300 °C und einem Druck von 40 bis 65 bar statt. Die Reaktion wird im fünffachen molaren Benzolüberschuss durchgeführt. Wird ZSM5 als Katalysator eingesetzt sind Temperaturen von etwa 435 bis 450 °C erforderlich sowie Drücke von 14 bis 28 bar.[116]
Cumol
Cumol ist ein gutes Lösungsmittel für Fette und Harze und wurde teilweise als Ersatz für Benzol in industriellen Anwendungen verwendet. Die Nachfrage nach Cumol beruht jedoch weitgehend auf dem Bedarf an Phenolderivaten und Phenolharzen. Es wird durch Alkylierung von Benzol mit Propen synthetisiert. Wie bei Ethylbenzol kann die Reaktion in der Flüssig- oder Gasphase mit Lewis- oder Brønsted-Säuren durchgeführt werden, die Reaktionsbedingungen sind jedoch milder.
Die Temperaturen für die Flüssigphasenreaktion liegen je nach Katalysator zwischen 35 und 70 °C, bei Propendrücken von bis zu 7 bar. Die Temperatur des Gasphasenprozesses mit einem Phosphorsäurekatalysator liegt zwischen 200 und 250 °C, bei Drücken von 20 bis 40 bar.[117]
Cyclohexan
Cyclohexan ist ein Bestandteil von Naphthafraktion und kann destillativ von diesen abgetrennt werden. Die Ausbeute wird durch die Isomerisierung des ebenfalls vorhandenen Methylcyclopentans zu Cyclohexan erhöht, jedoch wird nur ein kleiner Teil des Bedarfs über diesen Weg gedeckt. Der überwiegende Teil des Cyclohexans stammt aus der Hydrierung von Benzol. Schwefelarme Benzolfraktionen können mit Nickel- oder Platinkatalysatoren in der Flüssigphase bei Temperaturen von 170 bis 230 °C und Drücken von 20 bis 40 bar umgearbeitet werden. Die Reaktion erfolgt zum Beispiel in Blasensäulenreaktoren mit suspendierten Raney-Nickelkatalysatoren. Die Isomerisierung von Cyclohexan zu Methylcyclopentan stellt eine unerwünschte Nebenreaktion dar, die durch kurze Verweilzeiten und eine gute Temperaturkontrolle der exothermen Hydrierreaktion unterdrückt wird.[118]
Nitrobenzol
Nitrobenzol wird durch die Nitrierung von Benzol mit Hilfe von Nitriersäure, einer Mischung aus Salpetersäure und konzentrierter Schwefelsäure, hergestellt. Schwefelsäure protoniert Salpetersäure, aus der durch Abspaltung von Wasser der eigentliche Reaktant, das Nitroniumion, gebildet wird.
Das entstandene Nitroniumion reagiert mit dem Benzol in einer elektrophilen aromatischen Substitution weiter zu Nitrobenzol:[119]
Weitere Derivate
Zahlreiche weitere Grundstoffe sind Derivate des Benzols. Diese sind ihrerseits Ausgangsstoffe für andere Chemikalien.

Sicherheitstechnische Kenngrößen
Die Verbindung hat einen Flammpunkt bei −11 °C.[120] Benzol bildet leicht entzündliche Dampf-Luft-Gemische. Der Explosionsbereich liegt zwischen 1,2 Volumenprozent (39 g/m3) als untere Explosionsgrenze (UEG) und 8,6 Volumenprozent (280 g/m3) als obere Explosionsgrenze (OEG).[120] Die Grenzspaltweite wurde mit 0,99 mm bestimmt.[120] Es resultiert damit eine Zuordnung in die Explosionsklasse IIA.[1] Die Mindestzündenergie liegt bei 0,2 mJ.[120] Damit können energetisch schwächere Zündquellen wie Büschelentladungen und Schleif- beziehungsweise Schlagfunken eine Entzündung von Dampf-Luft-Gemischen innerhalb der Explosionsgrenzen bewirken. Die Zündtemperatur beträgt 555 °C.[120] Der Stoff fällt somit in die Temperaturklasse T1. Benzol muss bei 15 °C bis 25 °C gelagert werden. Der TRK-Wert lag bei 1 Milliliter pro Kubikmeter Luft (beziehungsweise 3,25 mg/m3 Luft). Benzol ist stark wassergefährdend.
Umweltaspekte

Benzol löst sich zwar nur schlecht in Wasser, auf Grund des großen Wasserüberschusses bei einer lokalen Freisetzung von Erdöl löst es sich jedoch nahezu vollständig. Kommt es bei der Förderung oder dem Transport von Erdöl zu einer Freisetzung in mariner Umgebung, kann in Wasser gelöstes Benzol schon in Konzentrationen von wenigen parts per billion einen toxischen Effekt auf Fischlarven und andere marine Organismen haben.[121] In höheren Konzentrationen von über einem part per million wirkt Benzol tödlich auf viele Wasserorganismen.[122] Die Benzolexposition nach einer Freisetzung oder im Umgang mit Rohöl stellt ein gesundheitliches Risiko für die beteiligten Mitarbeiter dar.[123]
Die Konzentrationen von Benzol in den Küstenregionen Louisianas während der Deepwater-Horizon-Katastrophe 2010 waren etwa 2- bis 19-mal höher als die Hintergrundwerte.[124] Beim Chemieunfall von Jilin im November 2005 gelangten durch eine Leckage nach einer Explosion etwa 100 Tonnen Benzol und Nitrobenzol in den Oberlauf des Flusses Songhua. Der Unfall bedrohte die Trinkwasserversorgung der chinesischen Millionenstadt Harbin sowie die der russischen Großstadt Chabarowsk.[125] Beim Eisenbahnunfall von Hustopeče nad Bečvou am 28. Februar 2025 in Tschechien gerieten mit 1000 Tonnen Benzol beladene Kesselwagen in Brand. Das auslaufende Benzol gelangte ins Grundwasser, so dass vom größten Unglück in Europa seit über 30 Jahren und von einer beispiellosen Umweltkatastrophe die Rede ist.[126]
Die Analyse von gelöstem Benzol in Wasserproben von Explorationsbohrungen gilt als zuverlässige Methode zur Vorhersage von Erdölvorkommen.[127] Unter methanogenen Bedingungen fungiert Benzol als Substrat für die mikrobiologische anaerobe Methan- und Kohlenstoffdioxid-Produktion. Der anaerobe Abbau erfolgt ebenfalls unter sulfat- und eisenreduzierenden Bedingungen.[128] In der Atmosphäre wird nach zwei bis fünf Tagen die Hälfte des vorhandenen Benzols abgebaut, da dieses mit Hydroxyl-Radikalen reagiert.
Benzol wird durch Abgase von Benzinmotoren freigesetzt. 75 % der Emissionen gehen auf Kraftfahrzeuge zurück. Der Benzolanteil des Motorenbenzins ist ab dem Jahr 2000 europaweit nach DIN EN 228 auf maximal ein Volumenprozent begrenzt worden; der Durchschnitt im Jahre 2003 betrug etwa 0,7 Volumenprozent. Der Grenzwert lag 2010 in den USA bei fünf Volumenprozent.[129][130] Ab 2013 sollte der US-Durchschnitt des Benzolanteils im Benzin zwar auf 0,62 %[131] reduziert werden, eine Begrenzung des Maximalanteils unter fünf Prozent war immer noch nicht vorgesehen.[132]
Toxikologie
(c) Robin Müller, CC BY-SA 3.0
Mit der Nahrung aufgenommenes Benzol wird verstoffwechselt und vorwiegend über den Urin ausgeschieden. Die Verstoffwechselung von Benzol beginnt mit der Epoxidierung zu Benzoloxid durch Cytochrom-P450-Enzyme (CYP), die in allen Organen, insbesondere in der Leber, vorkommen.[100]
Es besteht ein Gleichgewicht zwischen Benzoloxid und Oxepin, wobei sich letzteres spontan zu Phenol umlagert.
Durch weitere Oxidation des Phenols entstehen Brenzcatechin, Hydrochinon sowie 1,2,4-Trihydroxybenzol. Benzoloxid und Oxepin reagieren mit Glutathion, einem Tripeptid, das aus den Aminosäuren Glutaminsäure, Cystein und Glycin gebildet wird, zu S[S 1] (N-Acetyl-S-phenylcystein), einem Benzolmetaboliten, der für das Biomonitoring der Benzolexposition von Bedeutung ist. Benzoloxid und Oxepin können sich unter Ringöffnung zu Muconaldehyd umlagern und anschließend zu (E,E)-Muconsäure oxidiert werden, einem weiteren Benzolmetaboliten, der im Urin nachweisbar ist.[100]
Akute Wirkung
Benzoldämpfe sind beim Einatmen giftig; die Symptome einer akuten Benzolvergiftung treten erst bei relativ hohen Konzentrationen ein. Zu den neurologischen Symptomen einer Inhalationsexposition gehören Kopfschmerzen, Schwindelgefühl, Brechreiz, Benommenheit bis zur Bewusstlosigkeit und Apathie.[133] Bei einer schweren Vergiftung kommt es zu Fieber und Sehstörungen bis hin zu vorübergehender Erblindung und Bewusstlosigkeit. Bei der sogenannten Benzolsucht, die beim Einatmen von Benzol eintreten kann, kommt es zu Trunkenheits- und Euphoriegefühlen. Schätzungen zufolge wirkt eine fünf bis zehnminütige Exposition gegenüber 20.000 ppm Benzol in der Luft tödlich.[134] Die akute letale Dosis (oral) beträgt beim Menschen 50 Milligramm pro Kilogramm Körpergewicht. Beim Menschen kann das Verschlucken von Benzol zu Erbrechen, Schwindel und Krämpfen führen. Der Kontakt mit flüssigem Benzol oder seinen Dämpfen kann beim Menschen zu Reizungen der Haut, der Augen und der oberen Atemwege führen.
In der chinesischen Schuhindustrie ist die berufsbedingte Benzolexposition durch die Verwendung von Klebstoffen und Reinigungsmitteln, die Benzol enthalten, die häufigste berufliche Ursache für Vergiftungen, und mehr als 60 % aller berufsbedingten Krebserkrankungen wie Leukämie werden durch Benzol verursacht.[135]
Weitere chronische Wirkungen
Die Exposition gegenüber Benzol durch chronische Inhalation verursacht beim Menschen Blutkrankheiten, insbesondere der blutbildenden Stammzellen im Knochenmark. Es kann zu einer aplastischen Anämie, einem Risikofaktor für akute myeloische Leukämie, kommen.[136] Es wurde über Schädigungen des Immunsystems berichtet, die auf Veränderungen der Blutspiegel von Antikörpern und den Verlust von Leukozyten zurückzuführen sind. Beim Menschen verursacht Benzol sowohl strukturelle als auch numerische Chromosomenaberration.[136]
Karzinogene Wirkung
Die karzinogene Wirkung als Klastogen ist auf die Bildung eines karzinogenen Metaboliten zurückzuführen. Im Körper wird Benzol enzymatisch am Ring oxidiert. Das entstehende hochreaktive Epoxid (Arenoxid) reagiert mit zahlreichen biologischen Verbindungen und kann das Erbgut schädigen beziehungsweise Protein-Addukte bilden. Das Arenoxid wird weiter zu Phenol metabolisiert. Durch Hydrolasen kann das hochreaktive Arenoxid zum trans-1,2-Dihydrobenzol-1,2-diol weiter reagieren.[137]
Außerdem kann das Arenoxid reversibel zum Oxepin umlagern. Diese Weiterreaktionen verlaufen nicht-enzymatisch. Eine langzeitige Aufnahme kleinerer Benzolmengen führt vor allem zu Schädigungen der inneren Organe und des Knochenmarks. Letzteres resultiert in einer Abnahme der Zahl der roten Blutkörperchen (Anämie), was sich in Herzklopfen, Augenflimmern, Müdigkeit, Schwindel, Blässe und Kopfschmerzen äußert. Benzol wird im Gehirn, Knochenmark und Fettgewebe gespeichert. Es wird nur langsam über die Niere ausgeschieden. Der Abbau erfolgt über verschiedene Umbauprodukte wie das Brenzcatechin, Phenol, Hydrochinon und Benzochinon. Das Hauptausscheidungsprodukt ist schließlich die S-Phenylmercaptursäure.[138]
Grenzwerte
Die durchschnittliche Belastung der Bevölkerung betrug 2005 im Mittel circa 2 µg/m3 Luft. Dieser Wert kann je nach Umgebung wesentlich höher sein. Um 1980 gab es einen starken Rückgang der Benzolemissionen, der sich in den 1990er Jahren fortsetzte. So reduzierte sich die Benzolbelastung zwischen 1997 und 2005 sowohl an den städtischen, verkehrsnahen Messstationen als auch an den städtischen Hintergrundstationen so erheblich, dass schon im Jahr 2005 die erst seit dem Jahr 2010 geltenden Grenzwerte von 5 µg/m3 weitgehend unterschritten wurden.[139] Im Jahr 2019 lagen die Messwerte im Bereich von 1 µg/m3 Luft, wobei lokal höhere Werte gemessen wurden.[43]
Die Exposition gegenüber Benzol erfolgt in erster Linie durch Einatmen, es kann jedoch ebenfalls oral und dermal absorbiert werden. Neben der beruflich bedingten Exposition, bei der Arbeitsplatzgrenzwert in der EU 2022 0,66 mg/m3 betrug, ist das Rauchen einer der Hauptquellen für die Benzolbelastung des Körpers.[140] Die Benzolexposition beim Rauchen einer Shisha ist pro Anwendungssession um den Faktor 4 – 14-mal höher als bei einer Zigarette.[141] Dies ist wahrscheinlich darauf zurückzuführen, dass die Verbrennung von Shishakohle eine Hauptquelle für Benzol ist.[142] Eingeatmetes Benzol wird zum überwiegenden Teil wieder ausgeatmet. Bei Frauen ist die Aufnahme höher als bei Männern. Nach seiner Aufnahme verteilt sich Benzol rasch im Körper; da Benzol lipophil ist, reichert es sich in den Fettgeweben verschiedener Organe an.[143]
Benzol am Arbeitsplatz
Nach der Technischen Regel für Gefahrstoffe (TRGS) 910 liegt die Akzeptanzkonzentration für Benzol bei 0,2 mg/m3, die Toleranzkonzentration bei 1,9 mg/m3, Überschreitungsfaktor 8. Zurzeit gibt es keinen Biologischen Grenzwert nach TRGS 903. Bei der Bewertung von Benzol und seinen Risiken am Arbeitsplatz hilft die GESTIS-Stoffdatenbank.
Die Exposition gegenüber Benzol kann die Berufskrankheit Nummer 1318 „Erkrankungen des Blutes, des blutbildenden und des lymphatischen Systems durch Benzol“ verursachen.
Branchen mit hohem Risiko für eine erhöhte Exposition gegenüber Benzol sind z. B. Gießereien, Reparaturwerkstätten oder die Erdöl- und Erdgasgasindustrie. Arbeitsplatzmessungen mit Expositionsbezug (Schichtmittelwerte, tätigkeitsbezogene Werte oder Kurzzeitwerte) in den Jahren 2002 bis 2011 dokumentieren für 3 % der Arbeitsplätze ein hohes Risiko (> 1,9 mg/m³) und für 10,5 % ein mittleres Risiko (> 0,2 mg/m³ bis 1,9 mg/m³).[144]
Die Messung von Benzol erfolgt nach einem von den Unfallversicherungsträgern anerkannten Verfahren zur Feststellung der Konzentrationen krebserzeugender, keimzellmutagener oder reproduktionstoxischer Stoffe in der Luft in Arbeitsbereichen mithilfe der Gaschromatographie und Massenspektrometrie nach (Thermo-)Desorption.[145]
Hexadeuterobenzol
Deuteriertes Benzol (Summenformel: C6D6), auch Hexadeuterobenzol oder Benzol-d6[S 2] genannt, findet in der Kernresonanzspektroskopie (NMR) als Lösungsmittel Verwendung.
Die physikalischen Eigenschaften unterscheiden sich geringfügig von der nichtdeuterierten Verbindung:[146]
- Brechungsindex: 1,497 (20 °C)
- Schmelzpunkt: 6,8 °C
- Siedepunkt: 79,1 °C
- Dichte: 0,950 g/ml (25 °C)
Nachweis
Ein qualitativer Nachweis wurde früher über die Nitrierung des Benzols zum Nitrobenzol geführt und dessen anschließende Reduktion zum Anilin. Durch Schütteln der Reaktionsprodukte mit Chlorkalk tritt eine blaue bis violette Färbung ein, die charakteristisch für Anilin ist.[147]
Die Exposition des Körpers gegenüber Benzol lässt sich in der Atemluft nachweisen. Dazu wird reine Luft aus einem Vorratsbehälter eingeatmet, so dass das Benzol vom Blut in die Atemluft auf ihrem Weg durch die Lunge übergehen kann. Auf diese Weise spiegelt die ausgeatmete Luft die Benzolbelastung oder zumindest einen Teil der Benzolkonzentration wider, die sich im Blut befindet. Etwa 40 Liter der ausgeatmeten Luft werden dazu über ein Spirometer an ein Sorptionsmittel adsorbiert. Durch thermische Desorption in einem Gaschromatographen mit Massenspektrometrie-Kopplungssystem kann das ausgeatmete Benzol neben anderen flüchtigen organischen Komponenten identifiziert werden.[148]
Weblinks
Commons: Benzol – Sammlung von Bildern und Videos
Wiktionary: Benzol – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
- Fragen und Antworten zu Benzol in Erfrischungsgetränken und Karottensäften – Bundesinstitut für Risikobewertung (BfR). 16. Dezember 2013
- Eintrag zu Benzene in der Spectral Database for Organic Compounds (SDBS) des National Institute of Advanced Industrial Science and Technology (AIST)
Literatur
- Hans-Jürgen Arpe: Industrial Organic Chemistry. 5. Auflage. Wiley-VCH, Weinheim 2010, ISBN 978-3-527-32002-8.
- Hillis O. Folkins: Benzene. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim, 2012, ISBN 978-3-527-32943-4, S. 237–267.
- Benzene. In: International Agency for Research on Cancer, IARC Working Group on the Evaluation of Carcinogenic Risks to Humans (Hrsg.): IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Band 120. Lyon 2018, ISBN 978-92-832-0187-8, (iarc.fr)
Einzelnachweise
- ↑ a b c d e f g h i j k l m n o p q Eintrag zu Benzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2026. (JavaScript erforderlich)
- ↑ Heinz G. O. Becker, Werner Berger und Günter Domschke: Organikum. 22. Auflage. Wiley-VCH, Weinheim 2004, ISBN 3-527-31148-3, S. 732.
- ↑ Eintrag zu Benzene in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 71-43-2 bzw. Benzol), abgerufen am 15. September 2019.
- ↑ Karsten Strey: Die Welt der Gifte. Verlag Lehmanns, 2015, ISBN 978-3-86541-728-2, S. 202.
- ↑ R. Kaiser: „Bicarburet of Hydrogen.“ Nacharbeitung der Benzolentdeckung 1825 mit den analytischen Methoden von 1968. In: Angewandte Chemie. 80.9, 1968, S. 37–343, doi:10.1002/ange.19680800903.
- ↑ Michael Faraday: On New Compounds of Carbon and Hydrogen, and on Certain Other Products Obtained During the Decomposition of Oil by Heat. In: Philosophical Transactions. 115, 1825, S. 440–466.
- ↑ a b Jennifer Wilson: Celebrating Michael Faraday’s discovery of benzene. In: Ambix. 59.3, 2012, S. 241–265.
- ↑ E. Mitscherlich: Ueber das Benzol und die Säuren der Oel- und Talgarten. In: Annalen der Pharmacie. 1834, 9 (1), S. 39–48, doi:10.1002/jlac.18340090103.
- ↑ Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 1: A–Cl. 8., neubearbeitete und erweiterte Auflage. Franckh’sche Verlagshandlung, Stuttgart 1979, ISBN 3-440-04511-0, S. 402–403.
- ↑ Hermann Schelenz: Benzin und Benzol. In: Angewandte Chemie. 21.51, 1908, S. 2577–2579, doi:10.1002/ange.19080215102.
- ↑ Charles Blachford Mansfield: Untersuchung des Steinkohlentheers. In: Annalen der Chemie und Pharmacie. 69, 1849, S. 162–180, doi:10.1002/jlac.18490690203.
- ↑ A. J. Rocke: It Began with a Daydream: The 150th Anniversary of the Kekulé Benzene Structure. In: Angewandte Chemie International Edition. 54.1, 2014, S. 46–50, doi:10.1002/anie.201408034.
- ↑ Lexikon der Chemie: Prisman, bei spektrum.de, 1998.
- ↑ Lexikon der Chemie: Dewar-Benzol, bei spektrum.de, 1998.
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 40.
- ↑ Stephan Kekule von Stradonitz: Zwei chemische Visionen. In: Zeitschrift für angewandte Chemie. 1927, 40 (25), S. 736–737, doi:10.1002/ange.19270402505.
- ↑ Alan R. Katritzky: Advances in heterocyclic chemistry. Band 17, Academic Press, 1974, ISBN 0-12-020617-X, S. 7.
- ↑ K. Lonsdale: The Structure of the Benzene Ring. In: Nature. 122, 1928, S. 810, doi:10.1038/122810c0.
- ↑ C. K. Ingold: The Bakerian Lecture: The structure of benzene. In: Proceedings of the Royal Society of London. Series A, Mathematical and Physical Sciences. 1938, 169.937, S. 149–173, doi:10.1098/rspa.1938.0200.
- ↑ L. Pauling: The Diamagnetic Anisotropy of Aromatic Molecules. In: Journal of Chemical Physics. 4.10, S. 673–677, doi:10.1063/1.1749766.
- ↑ Adolf Claus: Theoretische Betrachtungen und deren Anwendungen zur Systematik der organischen Chemie. In: Berichte über die Verhandlungen der naturforschenden Gesellschaft zu Freiburg i. B. 1867, S. 315–347, hier S. 236 (Digitalisat).
- ↑ J. Dewar: 5. On the Oxidation of Phenyl Alcohol, and a Mechanical Arrangement adapted to illustrate Structure in the Nonsaturated Hydrocarbons. In: Proceedings of the Royal Society of Edinburgh. Band 6, 1869, S. 82–86, doi:10.1017/S0370164600045387.
- ↑ A. Ladenburg: Bemerkungen zur aromatischen Theorie. In: Berichte der deutschen chemischen Gesellschaft. Band 2, Nr. 1, 1869, S. 140–142, doi:10.1002/cber.18690020171 (PDF).
- ↑ Aug. Kekulé: Sur la constitution des substances aromatiques. In: Bulletin de la Société Chimique de Paris. 1865, S. 98–110 (bnf.fr).
- ↑ Aug. Kekulé: Ueber einige Condensationsproducte des Aldehyds. In: Annalen der Chemie und Pharmacie. Band 162, Nr. 1, 1872, S. 77–124, doi:10.1002/jlac.18721620110 (PDF).
- ↑ Henry E. Armstrong: XXVIII.—An explanation of the laws which govern substitution in the case of benzenoid compounds. In: Journal of the Chemical Society, Transactions. Band 51, 1887, S. 258–268, doi:10.1039/CT8875100258 (PDF).
- ↑ Adolf Baeyer: Über die Constitution des Benzols. In: Justus Liebigs Annalen der Chemie. Band 245, Nr. 1–2, 1888, S. 103–190, doi:10.1002/jlac.18882450110.
- ↑ Johannes Thiele: Zur Constitution des Benzols. In: Justus Liebigs Annalen der Chemie. Band 308, Nr. 1–2, 1899, S. 213–217, doi:10.1002/jlac.18993080112.
- ↑ D. S. Warren, B. M. Gimarc: Valence isomers of benzene and their relationship to isomers of isoelectronic P6. In: Journal of the American Chemical Society. 114.13, 1992, S. 5378–5385, doi:10.1021/ja00039a058.
- ↑ a b c d Heinz-Gerhard Franck, Jürgen Walter Stadelhofer: Production of benzene, toluene and xylenes. In: Heinz-Gerhard Franck, Jürgen Walter Stadelhofer: Industrial Aromatic Chemistry. Springer, Berlin / Heidelberg 1988, ISBN 978-3-642-73434-2, S. 99–131.
- ↑ Titus Kockel: Deutsche Ölpolitik 1928–1938. Akademie-Verlag, Berlin 2005, ISBN 3-05-004071-8, S. 34–39.
- ↑ E. W. Dean: Fuel for automotive apparatus. In: SAE Transactions. 13.1, 1918, S. 143–161, JSTOR:44716065
- ↑ A. Le Noir, J. Claude: On a Case of Purpura Attributed to Benzene Intoxication. In: Bulletins et Mémoires de la Société Médicale des Hôpitaux de Paris. 1897, 3, S. 1251–1261.
- ↑ C. C. Santessen: Chronische Vergiftungen mit Steinkohlentheerbenzin: Vier Todesfälle. In: Arch. Hyg. Bakteriol. 31, 1897, S. 336–376.
- ↑ Proceedings of the Technical Oil Mission, Meeting, Held under the suspices of the Petroleum Administration for War and the Bureau of Mines, Washington, D. C., December 13 and 14, 1945, S. 132–136 (Google-Books).
- ↑ Luther Hill: Story of Hydroforming. In: Scientific American. 174.1, 1946, S. 23–27.
- ↑ V. Haensel, M. J. Sterba: Pyrolytic and Catalytic Decomposition of Hydrocarbons. In: Industrial & Engineering Chemistry. 1949, 41. 9, S. 1914–1922, doi:10.1021/ie50477a024.
- ↑ T. Ukhina, S. Itsek: Influence of the fractional composition of gasolines on the products of their pyrolysis. In: Petroleum Chemistry U.S.S.R. 1960, 2.4, S. 481–489, doi:10.1016/0031-6458(63)90019-4.
- ↑ George J. Antos, Abdullah M. Aitani: Catalytic Naphtha Reforming. Marcel Dekker, 2004, New York, Basel, ISBN 0-8247-5058-6, S. 482–483.
- ↑ a b c Hillis O. Folkins: Benzene. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim, 2012, ISBN 978-3-527-32943-4, S. 237–267.
- ↑ Abduhl Khalade u. a: Exposure to benzene at work and the risk of leukemia: a systematic review and meta-analysis. In: Environmental Health. 2010, 9:31, doi:10.1186/1476-069X-9-31.
- ↑ a b Jahresbilanzen der Luftdaten, bei umweltbundesamt.de, abgerufen am 22. Mai 2022.
- ↑ D. O. Carpenter: Hydraulic fracturing for natural gas: impact on health and environment. In: Reviews on Environmental Health. 31.1, 2016, S. 47–51, doi:10.1515/reveh-2015-0055.
- ↑ Market volume of benzene worldwide from 2015 to 2021, with a forecast for 2022 to 2029 (in million metric tons), abgerufen am 27. Juni 2022.
- ↑ a b Friedrich Asinger: Chemie und Technologie der Monoolefine. Reprint 2021 Auflage. Akademie-Verlag, Berlin 1957, ISBN 978-3-11-256882-8, S. 139–140, doi:10.1515/9783112568828.
- ↑ Evan K. Nyer: Practical Techniques for Groundwater and Soil Remediation. CRC Press, Boca Raton, 2019, ISBN 978-0-87371-731-1, S. 16.
- ↑ Verordnung (EU) 2015/1494
- ↑ Dave K. Verma, Karen des Tombe: Benzene in gasoline and crude oil: occupational and environmental implications. In: AIHA Journal. 63.2, 2002, S. 225–230, doi:10.1080/15428110208984708.
- ↑ Maximilian Marder: Motorkraftstoffe. Springer, Berlin 1942, ISBN 978-3-642-98414-3, S. 396.
- ↑ Reinhold Rühl, Ulf Spod, Corinne Ziegler: Abgase von Baumaschinen und Baufahrzeugen aus Sicht des Arbeitsschutzes. In: Gefahrstoffe – Reinhaltung der Luft. 77, 2017, S. 224–230 (PDF).
- ↑ Lance A. Wallace: Major Sources of Benzene Exposure. In: Environmental Health Perspectives. 1989, 82, S. 165–169, doi:10.1289/ehp.8982165.
- ↑ Benzol in Kirschsaft: Wie kommt es dazu und wie kann man es vermeiden. In: food-monitor. 26. März 2020, abgerufen am 28. Juni 2020.
- ↑ S. Frank, P. Schieberle: Untersuchungen zur Bildung von Benzol aus Benzaldehyd. In: Chemie in unserer Zeit. 2020, 54.6, S. 397–401, doi:10.1002/ciuz.202000042.
- ↑ V. Vuitton, R. V. Yelle, J. Cui: Formation and distribution of benzene on Titan. In: Journal of Geophysical Research. 2008, 113, E5, doi:10.1029/2007je002997.
- ↑ Ah‐San Wong, Yuk L. Yung, A. James Friedson: Benzene and haze formation in the polar atmosphere of Jupiter. In: Geophysical Research Letters. 30.8, 2003, S. 534:L215–L217, doi:10.1029/2002GL016661.
- ↑ T. T. Koskinen u. a.: The detection of benzene in Saturn’s upper atmosphere. In: Geophysical Research Letters. 43.15, 2016, S. 7895–7901, doi:10.1002/2016gl070000.
- ↑ G. Angelis u. a.: Plausible Emergence of Biochemistry in Enceladus Based on Chemobrionics. In: Chemistry – A European Journal. 27.2, 2020, S. 600–604, doi:10.1002/chem.202004018.
- ↑ Pascale Ehrenfreund u a. (Hrsg.): Astrobiology: Future Perspectives. Kluwer Academic Publishers, New York, Boston, Dordrecht, London, Moskau, 2005, ISBN 1-4020-2304-9, S. 19.
- ↑ Jordi Llorca: Organic matter in meteorites. In: International Microbiology. 2004, 7, S. 239–248, PMID 15666244.
- ↑ B. Sivaraman, R. Mukherjee, K. P. Subramanian, S. B. Banerjee: Benzene formation on interstellar icy mantles containing propargyl alcohol. In: The Astrophysical Journal. 2014, 798.2, S. 72–75, doi:10.1088/0004-637x/798/2/72.
- ↑ B. M. Jones u. a.: Formation of benzene in the interstellar medium. In: Proceedings of the National Academy of Sciences. 2010, 108.2, S. 452–457, doi:10.1073/pnas.1012468108.
- ↑ Klaus Weissermel, Hans-Jürgen Arpe: Industrial Organic Chemistry. 3. Auflage. VCH, Weinheim 1997, ISBN 3-527-28838-4, S. 71.
- ↑ a b D. Netzer, O. J. Ghalayini: Improve benzene production from refinery sources. In: Hydrocarbon Processing. 2002, S. 71–78 (Abstract).
- ↑ Marcos Granda u. a.: Chemicals from Coal Coking. In: Chemical Reviews. 114, 2014, S. 1608–1636, doi:10.1021/cr400256y.
- ↑ H. G. Franck, G. Collin: Steinkohlenteer. Chemie, Technologie und Verwendung. Springer, Berlin / Heidelberg / New York 1968, ISBN 978-3-642-88259-3, S. 36–37.
- ↑ Friedrich Asinger: Chemie und Technologie der Monoolefine. Reprint 2021 Auflage. Akademie-Verlag, Berlin 1957, ISBN 978-3-11-256882-8, S. 123–145, doi:10.1515/9783112568828.
- ↑ Chunbao Xu & Fatemeh Ferdosian: Conversion of Lignin into Bio-Based Chemicals and Materials. Springer, Berlin 2017, ISBN 978-3-662-54957-5, S. 13–33.
- ↑ Patent EP2494008B1: Verfahren mit Olefinrückführung zur katalytischen Pyrolyse von Biomasse und Kohlenwasserstoffmaterialien in einem Wirbelbettreaktor zur Herstellung von Aromastoffen. Angemeldet am 9. September 2010, veröffentlicht am 24. Februar 2021, Anmelder: University of Massachusetts, Anellotech Inc, Erfinder: George W. Huber et al.
- ↑ TCat-8® Pilot Plant. Anellotech, abgerufen am 29. Oktober 2019.
- ↑ The BioBTX technology. BioBTX, abgerufen am 29. Oktober 2019.
- ↑ Jacobs Confirms Anellotech’s Bio-TCat™ Process Leads to Significant Carbon Emission Reductions Compared to Petro-based Aromatics. Anellotech, 11. Oktober 2018, abgerufen am 29. Oktober 2019.
- ↑ George J. Antos, Abdullah M. Aitani: Catalytic Naphtha Reforming. Marcel Dekker, New York, Basel, 2004, ISBN 0-8247-5058-6, S. 18.
- ↑ a b c d Klaus Weissermel, Hans-Jürgen Arpe: Industrial Organic Chemistry. 3. Auflage. VCH, Weinheim 1997, ISBN 3-527-28838-4, S. 312–321.
- ↑ CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ a b A. H. Zahed, Y. Yorulmaz, M. A. Gashghari: Extraction of BTX Hydrocarbons from Saudi Arabian Refinery Platformates. In: Journal of King Abdulaziz University: Engineering Sciences. 4.1, 1992, S. 101–114, doi:10.4197/ENG.4-1.7, (Online).
- ↑ a b Abdal Kareem, Shri Chand, I. M. Mishra: Disproportionation of Toluene to Produce Benzene and p-Xylene – A Review. In: Journal of Scientific & Industrial Research. 60, 2001, S. 319–327 (PDF).
- ↑ C. C. Zimmerman, Robert York: Thermal Demethylation of Toluene. In: Ind. Eng. Chem. Process Des. Dev. 3, 1964, S. 254–258, doi:10.1021/i260011a013.
- ↑ Walter Reppe, Walter Joachim Schweckendiek: Cyclisierende Polymerisation von Acetylen. III Benzol, Benzolderivate und hydroaromatische Verbindungen. In: Justus Liebigs Annalen der Chemie. 1948, 560 (1), S. 104–116, doi:10.1002/jlac.19485600104.
- ↑ K. P. C. Vollhardt: Transition-metal-catalyzed acetylene cyclizations in organic synthesis. In: Accounts of Chemical Research. 10.1, 1977, S. 1–8, doi:10.1021/ar50109a001.
- ↑ D. Trimm: The catalytic oxidation of propylene to benzene. In: Journal of Catalysis. 26. 1, 1972, S. 1–10, doi:10.1016/0021-9517(72)90027-9.
- ↑ Marco Conte u. a.: Modified zeolite ZSM-5 for the methanol to aromatics reaction. In: Catal. Sci. Technol. 2, 2012, S. 105–112, doi:10.1039/C1CY00299F.
- ↑ T. Li, T. Shoinkhorova, J. Gascon, J. Ruiz-Martínez: Aromatics Production via Methanol-Mediated Transformation Routes. In: ACS Catalysis. 11.13, 2021, S. 7780–7819, doi:10.1021/acscatal.1c01422.
- ↑ CYCLAR™ Process Produces High-Quality Aromatic Products ( vom 3. Oktober 2017 im Internet Archive).
- ↑ a b E. G. Cox, D. W. J. Cruickshank, J. A. S. Smith: The Crystal Structure of Benzene at −3 °C. In: Proceedings of the Royal Society of London. Series A, Mathematical and Physical Sciences, 1958, 247, 1248, S. 1–21, doi:10.1098/rspa.1958.0167.
- ↑ Joachim Berber, Heinz Kacher, Rudolf Langer: Physik in Formeln und Tabellen. Springer, 1994, ISBN 3-519-03200-7, S. 129.
- ↑ Walter J. Moore, Dieter O. Hummel: Physikalische Chemie. 4. Auflage. de Gruyter, 1986, ISBN 3-11-010979-4, S. 253.
- ↑ R. F. Marschner, W. P. Cropper: Hydrocarbon Azeotropes of Benzene. In: Industrial & Engineering Chemistry. 1946, 38.3, S. 262–268, doi:10.1021/ie50435a013.
- ↑ a b c Eintrag zu Benzene in der Spectral Database for Organic Compounds (SDBS) des National Institute of Advanced Industrial Science and Technology (AIST).
- ↑ Masahiko Taniguchi, Hai Du, Jonathan S. Lindsey: PhotochemCAD 3: Diverse Modules for Photophysical Calculations with Multiple Spectral Databases. In: Photochemistry and Photobiology. Band 94, Nr. 2, März 2018, S. 277, doi:10.1111/php.12862.
- ↑ Masahiko Taniguchi, Jonathan S. Lindsey: Database of Absorption and Fluorescence Spectra of >300 Common Compounds for use in PhotochemCAD. In: Photochemistry and Photobiology. Band 94, Nr. 2, März 2018, S. 290–327, doi:10.1111/php.12860.
- ↑ Eric D. Glendening u. a.: The Role of Delocalization in Benzene. In: Journal of the American Chemical Society. 1993, 115 (23), S. 10952–10957, doi:10.1021/ja00076a061.
- ↑ E. Cox: Crystal Structure of Benzene. In: Reviews of Modern Physics. 1958, 30 (1), S. 159–162, doi:10.1103/RevModPhys.30.159.
- ↑ Linus Pauling: Interatomic Distances in covalent Molecules and Resonance between two or more Lewis electronic structures. In: Proceedings of the National Academy of Sciences. 18, 1932, S. 293–297, doi:10.1073/pnas.18.4.293.
- ↑ Linus Pauling: Die Natur der chemischen Bindung. Verlag Chemie, Weinheim 1973, ISBN 3-527-25217-7, S. 184–185.
- ↑ David M. Bishop: Group Theory and Chemistry. Dover, New York 1993, ISBN 978-0-486-67355-4, S. 206–212.
- ↑ Hermann Haken, Hans Christoph Wolf: Molekülphysik und Quantenchemie. Springer, Berlin/Heidelberg/New York 2006 (5. Auflage), ISBN 978-3-540-30314-5, S. 84–91.
- ↑ E. Lindholm, B. Ö. Jonsson: The electronic structure of benzene. In: Chemical Physics Letters. 1.10, 1967, S. 501–503, doi:10.1016/0009-2614(67)85090-5.
- ↑ F. Scholz, D. Himmel, L. Eisele, W. Unkrig, I. Krossing: Die Supersäure HBr/AlBr3: Protonierung von Benzol und ausgeordnete Kristallstruktur von [C6H7]+[Al2Br7]−. In: Angewandte Chemie. 126.6, 2014, S. 1715–1718, doi:10.1002/ange.201308120.
- ↑ a b c Bekanntmachung des Umweltbundesamtes: Vorläufiger Leitwert für Benzol in der Innenraumluft. In: Bundesgesundheitsblatt. 3, 2020, S. 361–367, doi:10.1007/s00103-019-03089-4.
- ↑ a b Richard Wegler (Hrsg.): Chemie der Pflanzenschutz und Schädlingsbekämpfungsmittel. Band 1, Springer-Verlag, 1970, ISBN 3-642-46212-X, S. 129–132.
- ↑ R. E. Rundle, J. H. Goring: Structure of the Silver Perchlorate-Benzene Complex. In: Journal of the American Chemical Society. 72.11, 1950, S. 5337–5337, doi:10.1021/ja01167a535.
- ↑ Ernst Otto Fischer, Walter Hafner: Di-benzol-chrom. In: Zeitschrift für Naturforschung B. 10, 1955, S. 665–668, doi:10.1515/znb-1955-1201.
- ↑ The Nobel Prize in Chemistry 1973.
- ↑ Ernst Otto Fischer, Karl Öfele: Über Aromatenkomplexe von Metallen, XIII Benzol-Chrom-Tricarbonyl. In: Chemische Berichte. 90, S. 2532–2535, doi:10.1002/cber.19570901117.
- ↑ Gottfried Huttner, Siegfried Lange, Ernst O. Fischer: Molecular Structure of Bis(hexamethylbenzene)-ruthenium(0). In: Angewandte Chemie International Edition in English. 10, 1971, S. 556-, doi:10.1002/anie.197105561.
- ↑ a b Hubert Wadepohl: Benzene and Its Derivatives as Bridging Ligands in Transition‐Metal Complexes. In: Angewandte Chemie International Edition. 31.3, 1992, S. 247–262, doi:10.1002/anie.199202473.
- ↑ Charles S. Gibson: Essential Principles of Organic Chemistry. Cambridge University Press, 2016, ISBN 978-1-316-60386-4, S. 66–69.
- ↑ Spektrum der Wissenschaft: Benzolring geöffnet - Spektrum der Wissenschaft, abgerufen am 12. Dezember 2021
- ↑ Xu Qiu u. a.: Cleaving arene rings for acyclic alkenylnitrile synthesis. In: Nature. 2020, 597.7874, S. 64–69, doi:10.1038/s41586-021-03801-y.
- ↑ Houben-Weyl Methods of Organic Chemistry Vol. V/2b, 4th Edition Arenes and Arynes. Georg Thieme Verlag, 2014, ISBN 3-13-179974-9, S. 565 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Decaffeination 101: Four Ways to Decaffeinate Coffee.
- ↑ John McMurry: Organic Chemistry. Cengage Learning Services, 2003, ISBN 0-534-38999-6, S. 478.
- ↑ Anhang XVII Nr. 5 REACH-Verordnung.
- ↑ a b Thomas Hillenbrand, Frank Marscheider-Weidemann, Manuel Strauch, Kerstin Heitmann, Dora Schaffrin: Emissionsminderung für prioritäre und prioritäre gefährliche Stoffe der Wasserrahmenrichtlinie (PDF; 3,7 MB). Stoffdatenblätter 29-07 des Umweltbundesamts, Abschnitt 18.2.
- ↑ a b c Klaus Weissermel, Hans-Jürgen Arpe: Industrial Organic Chemistry. 3. Auflage. VCH, Weinheim 1997, ISBN 3-527-28838-4, S. 335–339.
- ↑ Klaus Weissermel, Hans-Jürgen Arpe: Industrial Organic Chemistry. 3. Auflage. VCH, Weinheim 1997, ISBN 3-527-28838-4, S. 342–343.
- ↑ Klaus Weissermel, Hans-Jürgen Arpe: Industrial Organic Chemistry. 3. Auflage. VCH, Weinheim 1997, ISBN 3-527-28838-4, S. 345–346.
- ↑ Klaus Weissermel, Hans-Jürgen Arpe: Industrial Organic Chemistry. 3. Auflage. VCH, Weinheim 1997, ISBN 3-527-28838-4, S. 373–374.
- ↑ a b c d e E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003, ISBN 978-3-86509-811-5.
- ↑ Ronald L. Smith, Jane Anne Cameron: Effect of Water Soluble Fraction of Prudhoe Bay Crude Oil on Embryonic Development of Pacific Herring. In: Transactions of the American Fisheries Society. 108, 1979, S. 70–75, doi:10.1577/1548-8659(1979)108<70:EOWSFO>2.0.CO;2.
- ↑ Wyman Harrison, Mitchell A. Winnik, Paul T. Y. Kwong, Donald Mackay: Crude oil spills. Disappearance of aromatic and aliphatic components from small sea-surface slicks. In: Environmental Science & Technology. 9, 1975, S. 231–234, doi:10.1021/es60101a006.
- ↑ B. E. Gjesteland, J. Hollund, J. Kirkeleit, P. Daling, M. Bråtveit: Oil Spill Field Trial at Sea: Measurements of Benzene Exposure. In: Annals of Work Exposures and Health. 2017, 61, 6, S. 692–699, doi:10.1093/annweh/wxx036. PMID 28595265.
- ↑ Earthea Nance u. a.: Ambient air concentrations exceeded health-based standards for fine particulate matter and benzene during the Deepwater Horizon oil spill. In: Journal of the Air & Waste Management Association. 2016, 66.2, S. 224–236, doi:10.1080/10962247.2015.1114044.
- ↑ China warnt Russland vor Umweltkatastrophe. In: Themen › Kultur, 24. November 2005. Deutsche Welle. Auf DW.com, abgerufen am 1. Mai 2022.
- ↑ jmd/dpa: Tschechien: Brand von Güterzug mit Benzol unter Kontrolle. In: Spiegel Online. 1. März 2025, abgerufen am 15. April 2025.
- ↑ Stephen G. Burtell, Victor T. Jones III: EXPLORATION: Benzene content of subsurface brines can indicate proximity of oil, gas. In: Oil and Gas Journal. 1996, 94, 23 (Volltext).
- ↑ J. Kazumi u. a.: Anaerobic Degradation of Benzene in Diverse Anoxic Environments. In: Environmental Science & Technology. 1997, 31.3, S. 813–818, doi:10.1021/es960506a.
- ↑ James W. Weaver, Linda R. Exum, Lourdes M. Prieto: Gasoline Composition Regulations Affecting LUST Sites (PDF; 1,1 MB). Veröffentlichung der EPA, Januar 2010, S. 18.
- ↑ Sicherheitsdatenblatt firstfuelbank (PDF; 36 kB) Stand: Februar 2003.
- ↑ EPA: Summary and Analysis of the 2009 Gasoline Benzene Pre-Compliance Reports (PDF; 389 kB), November 2009.
- ↑ Felicity Barringer: E.P.A. Limits the Benzene in Gasoline by 2011. In: New York Times vom 10. Februar 2007.
- ↑ Helmut Schubothe: Vergiftungen. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. 2. Auflage. Springer-Verlag, Berlin/Göttingen/Heidelberg 1961, S. 1212–1213 (Benzolvergiftung).
- ↑ U.S. Department of Health and Human Services, Public Health Service, Agency for Toxic Substances and Disease Registry: Toxicological Profile for Benzene. August 2007, S. 31. (PDF, abgerufen am 21. Oktober 2022)
- ↑ Anton Pieper, Felix Xu: So wird ein Schuh draus. Broschüre, herausgegeben von Südwind – Institut für Ökonomie und Ökumene, Bonn, 4.2016, S. 16.
- ↑ a b U.S. Department of Health and Human Services, Public Health Service, Agency for Toxic Substances and Disease Registry: Toxicological Profile for Benzene. August 2007, S. 12. (PDF, abgerufen am 21. Oktober 2022)
- ↑ Benzene. In: International Agency for Research on Cancer, IARC Working Group on the Evaluation of Carcinogenic Risks to Humans (Hrsg.): IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Band 120. Lyon 2018, ISBN 978-92-832-0187-8, S. 295–296 (iarc.fr).
- ↑ Benzene. In: International Agency for Research on Cancer, IARC Working Group on the Evaluation of Carcinogenic Risks to Humans (Hrsg.): IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Band 120. Lyon 2018, ISBN 978-92-832-0187-8, S. 219–225 (iarc.fr).
- ↑ Umweltbundesamt: DATEN ZUR UMWELT: Der Zustand der Umwelt in Deutschland Ausgabe 2005 (PDF; 52 MB) abgerufen am 27. Dezember 2015.
- ↑ Arbeitsplatzgrenzwerte der EU.
- ↑ Macé M. Schuurmans, Jürg Barben: Factsheet 3: Wasserpfeife/Shisha. In: Primary and Hospital Care–Allgemeine Innere Medizin. 18.2, 2018, S. 31–35, doi:10.4414/phc-d.2018.01646.
- ↑ N. O. F. Kassem u. a.: Benzene Uptake in Hookah Smokers and Non-smokers Attending Hookah Social Events: Regulatory Implications. In: Cancer Epidemiology, Biomarkers & Prevention. 23.12, 2014, S. 2793–2809, doi:10.1158/1055-9965.epi-14-0576.
- ↑ Suryanarayana V. Vulimiri u. a: Reproductive and Developmental Toxicity of Solvents and Gases. In: Ramesh C. Gupta: Reproductive and Developmental Toxicology. Elsevier, 2017, S. 379–396, ISBN 978-0-12-804239-7.
- ↑ Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA): Benzol. Abgerufen am 3. Mai 2023.
- ↑ Deutsche Gesetzliche Unfallversicherung e. V. (DGUV): DGUV Information 213-505 – Verfahren zur Bestimmung von sechswertigem Chrom. Abgerufen am 3. Mai 2023.
- ↑ Datenblatt Benzene-d6 bei Sigma-Aldrich, abgerufen am 7. März 2018 (PDF).
- ↑ M. Berthelot: Bildung von Kohlenwasserstoffen in der Hitze. In: Journal für Praktische Chemie. 105(1), 1868, S. 305–309, doi:10.1002/prac.18681050142.
- ↑ Kent W. Thomas, Edo D. Pellizzari, Stephen D. Cooper: A canister-based method for collection and GC/MS analysis of volatile organic compounds in human breath. In: Journal of Analytical Toxicology. 15.2, 1991, S. 54–59, doi:10.1093/jat/15.2.54.
Externe Links zu erwähnten Verbindungen
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu (2R)-2-Acetamido-3-(phenylsulfanyl)propansäure: CAS-Nr.: 4775-80-8, PubChem: 2723735, ChemSpider: 2005928, Wikidata: Q27077068.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Benzol-d6: CAS-Nr.: 1076-43-3, EG-Nr.: 214-061-8, ECHA-InfoCard: 100.012.784, PubChem: 71601, ChemSpider: 64671, Wikidata: Q1101314.
Auf dieser Seite verwendete Medien
GHS-pictogram-flamme.svg
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
GHS-pictogram-silhouete.svg
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Historic Benzene Formula Thiele 1899 (original).png
Vorschlag von Johannes Thiele für die Benzol-Strukturformel im Original, entnommen aus:
Vorschlag von Johannes Thiele für die Benzol-Strukturformel im Original, entnommen aus:
Industrial synthesis of cumene (liquid-phase).svg
Umsetzung von Benzol mit Propen zu Cumol in Gegenwart eines Aluminiumchlorid-Katalysators
Umsetzung von Benzol mit Propen zu Cumol in Gegenwart eines Aluminiumchlorid-Katalysators
Historic Benzene Formula Dewar 1869 (original Dewar benzene).png
Einer von sieben Vorschlägen von James Dewar für die Benzol-Strukturformel (heute bekannt als Dewar-Benzol) im Original, entnommen aus:
Einer von sieben Vorschlägen von James Dewar für die Benzol-Strukturformel (heute bekannt als Dewar-Benzol) im Original, entnommen aus:
Reduction of Bis(benzene)ruthenium cation.svg
Reduction of the Bis(benzene)ruthenium cation, change of hapticity
Reduction of the Bis(benzene)ruthenium cation, change of hapticity
Industrial synthesis of cyclohexane.svg
Katalytische Hydrierung von Benzol zu Cyclohexan mit einem Raney-Nickel-Katalysator
Katalytische Hydrierung von Benzol zu Cyclohexan mit einem Raney-Nickel-Katalysator
Bis(benzene)chromium.svg
chemical structure of Bis(benzol)chrom
chemical structure of Bis(benzol)chrom
Tris(cyclopentadienylrhodium)benzene.svg
chemical structure of Tris(cyclopentadienylrhodium)benzene
chemical structure of Tris(cyclopentadienylrhodium)benzene
NMA.0028271, Fashion Photo by Erik Liljeroth 1954.jpg
(c) Erik Liljeroth, Nordiska museet, CC BY 4.0
Control of nylon stockings at Malmö Strumpfabrik. A woman holds a sock against the light to examine the quality. Subjects: Work, Industry, Fashion, Textile
(c) Erik Liljeroth, Nordiska museet, CC BY 4.0
Control of nylon stockings at Malmö Strumpfabrik. A woman holds a sock against the light to examine the quality. Subjects: Work, Industry, Fashion, Textile
Synthesis Benzene from Methylcyclopentane.svg
Synthesis of Benzene from Methylcyclopentane
Synthesis of Benzene from Methylcyclopentane
Deepwater Horizon offshore drilling unit on fire 2010.jpg
Platform supply vessels battle the blazing remnants of the off shore oil rig Deepwater Horizon. A Coast Guard MH-65C dolphin rescue helicopter and crew document the fire aboard the mobile offshore drilling unit Deepwater Horizon, while searching for survivors. Multiple Coast Guard helicopters, planes and cutters responded to rescue the Deepwater Horizon's 126 person crew.
Platform supply vessels battle the blazing remnants of the off shore oil rig Deepwater Horizon. A Coast Guard MH-65C dolphin rescue helicopter and crew document the fire aboard the mobile offshore drilling unit Deepwater Horizon, while searching for survivors. Multiple Coast Guard helicopters, planes and cutters responded to rescue the Deepwater Horizon's 126 person crew.
Benzene 200.svg
Struktur von Benzol
Struktur von Benzol
Benzene Alkylation V.1.svg
Reaktionsgleichung
Reaktionsgleichung
Historic Benzene Formulae Kekulé (original).png
August Kekulés Vorschlag für die Benzol-Strukturformel im Original, entnommen aus:
August Kekulés Vorschlag für die Benzol-Strukturformel im Original, entnommen aus:
Historic Benzene Formula Claus 1867 (original)2.png
Vorschlag von Adolf Claus für die Benzol-Strukturformel im Original, entnommen aus:
Vorschlag von Adolf Claus für die Benzol-Strukturformel im Original, entnommen aus:
Pyrogallol2.svg
Struktur von Pyrogallol
Struktur von Pyrogallol
Synthesis Ethylbenzene.svg
Synthesis of Ethylbenzene
Synthesis of Ethylbenzene
LudwigshafenBASFsteamcracker2-2020-09-22-17-07-33.jpg
Autor/Urheber: Rolf Kickuth, Lizenz: CC BY-SA 4.0
Der Steamcracker II auf dem Werksgelände der BASF in Ludwigshafen am 22. September 2020 (Luftaufnahme aus 3000 Fuß Höhe aus einem Tragschrauber heraus). Das Foto zeigt auch eine Abfackelung. Grund dafür war eine Fehlfunktion eines Steamcrackers. In solchen Fällen kann aus Sicherheitsgründen Rohgas über eine Fackel verbrannt werden.
Autor/Urheber: Rolf Kickuth, Lizenz: CC BY-SA 4.0
Der Steamcracker II auf dem Werksgelände der BASF in Ludwigshafen am 22. September 2020 (Luftaufnahme aus 3000 Fuß Höhe aus einem Tragschrauber heraus). Das Foto zeigt auch eine Abfackelung. Grund dafür war eine Fehlfunktion eines Steamcrackers. In solchen Fällen kann aus Sicherheitsgründen Rohgas über eine Fackel verbrannt werden.
Benzene crystal structure.png
Autor/Urheber: Andif1, Lizenz: CC BY-SA 4.0
Crystal structure of orthorhombic benzene-I. Created using Diamond 4. Structure data from Katrusiak, Andrzej; Podsiad/lo, Marcin; Budzianowski, Armand Association CH···p and No van der Waals Contacts at the Lowest Limits of Crystalline Benzene I and II Stability Regions† Crystal Growth & Design, 10, 3461 (2010)
Autor/Urheber: Andif1, Lizenz: CC BY-SA 4.0
Crystal structure of orthorhombic benzene-I. Created using Diamond 4. Structure data from Katrusiak, Andrzej; Podsiad/lo, Marcin; Budzianowski, Armand Association CH···p and No van der Waals Contacts at the Lowest Limits of Crystalline Benzene I and II Stability Regions† Crystal Growth & Design, 10, 3461 (2010)
Benzolherkunft 2001.svg
Autor/Urheber: Vektorisierung: NadirSH, Lizenz: CC BY-SA 4.0
Industrielle Herkunft von Benzol in Westeuropa, 2001, Quelle: Klaus Weissermel, Hans-Jürgen Arpe: Industrial Organic Chemistry. 3. Auflage. VCH, Weinheim 1997, ISBN 3-527-28838-4, p. 71
Autor/Urheber: Vektorisierung: NadirSH, Lizenz: CC BY-SA 4.0
Industrielle Herkunft von Benzol in Westeuropa, 2001, Quelle: Klaus Weissermel, Hans-Jürgen Arpe: Industrial Organic Chemistry. 3. Auflage. VCH, Weinheim 1997, ISBN 3-527-28838-4, p. 71
Historic Benzene Formulae Armstrong (original).png
Henry Edward Armstrongs Vorschlag für die Benzol-Strukturformel im Original, entnommen aus:
Henry Edward Armstrongs Vorschlag für die Benzol-Strukturformel im Original, entnommen aus:
Disproportionation of toluene.svg
Disproportionation of toluene
Disproportionation of toluene
Historic Benzene Formula Ladenburg 1869 (original).png
Vorschlag von Albert Ladenburg für die Benzol-Strukturformel im Original, entnommen aus:
Vorschlag von Albert Ladenburg für die Benzol-Strukturformel im Original, entnommen aus:
Deuterated benzene.svg
Displayed structural formula of deuterated benzene (C6D6). Created using ACD/ChemSketch 10.0 and Inkscape.
Displayed structural formula of deuterated benzene (C6D6). Created using ACD/ChemSketch 10.0 and Inkscape.
Benzolderivate.svg
Autor/Urheber: Johannes Schneider, Lizenz: CC BY-SA 4.0
Die wichtigsten und einfachsten Derivate des Benzols (Benzens).
Autor/Urheber: Johannes Schneider, Lizenz: CC BY-SA 4.0
Die wichtigsten und einfachsten Derivate des Benzols (Benzens).
Bis(cyclopentadienylrhodium)benzene.svg
chemical structure of Bis(cyclopentadienylrhodium)benzene
chemical structure of Bis(cyclopentadienylrhodium)benzene
Historic Benzene Formula Baeyer 1888 (original).png
Vorschlag von Adolf von Baeyer für die Benzol-Strukturformel im Original, entnommen aus:
Vorschlag von Adolf von Baeyer für die Benzol-Strukturformel im Original, entnommen aus:
Benzenetricarbonylchromium (2).svg
chemical structure of Benzenetricarbonylchromium
chemical structure of Benzenetricarbonylchromium
Substitutionsmuster.svg
Autor/Urheber: Holger87, Lizenz: CC BY-SA 3.0
ortho-, meta- und para-Substitution
Autor/Urheber: Holger87, Lizenz: CC BY-SA 3.0
ortho-, meta- und para-Substitution
Hydroxyhydrochinon.svg
Struktur von Hydroxyhydrochinon (1,2,4-Trihydroxybenzol)
Struktur von Hydroxyhydrochinon (1,2,4-Trihydroxybenzol)
Benzene oxide - oxepin equilibrium.svg
Equilibrium between benzene oxide and oxepine
Equilibrium between benzene oxide and oxepine
Gute-Hoffnungshütte 1920.jpg
Zeche Sterkrade, Gutehoffnungshütte, 1920, Oberhausen, Deutschland
Zeche Sterkrade, Gutehoffnungshütte, 1920, Oberhausen, Deutschland
Historical synthesis of maleic anhydride.svg
Selektive Partial-Oxidation von Benzol mit Luftsauerstoff zu Maleinsäureanhydrid, Kohlenstoffdioxid und Wasser in Gegenwart eines Vanadiumpentoxid / Molybdäntrioxid-Katalysators
Selektive Partial-Oxidation von Benzol mit Luftsauerstoff zu Maleinsäureanhydrid, Kohlenstoffdioxid und Wasser in Gegenwart eines Vanadiumpentoxid / Molybdäntrioxid-Katalysators
Benzoë1.JPG
Autor/Urheber: Maša Sinreih in Valentina Vivod, Lizenz: CC BY-SA 3.0
Benzoë siam, Styrax tonkinensis
Autor/Urheber: Maša Sinreih in Valentina Vivod, Lizenz: CC BY-SA 3.0
Benzoë siam, Styrax tonkinensis
Formation of tholins in Titan's upper atmosphere-de.svg
Tholine, komplexe organische Moleküle, die eine wesentliche Rolle in der präbiotischen Chemie spielen, scheinen in der Atmospähre des Titan in wesentlich größeren Höhen und auf andere Weise als angenommen zu entstehen. [Diese Ergebnisse veröffentlichte die aktuelle Ausgabe des Science-Magazins.]
Tholine, komplexe organische Moleküle, die eine wesentliche Rolle in der präbiotischen Chemie spielen, scheinen in der Atmospähre des Titan in wesentlich größeren Höhen und auf andere Weise als angenommen zu entstehen. [Diese Ergebnisse veröffentlichte die aktuelle Ausgabe des Science-Magazins.]
Friedel-Crafts-Acylierung 1c.svg
Struktur der Friedel-Crafts-Acylierung
Struktur der Friedel-Crafts-Acylierung
Benzene geometrie (2).svg
geometrie of the benzene molecule
geometrie of the benzene molecule
Reppe-chemistry-benzene.svg
Cyclization of Ethine to Benzene with Triphenylphosphine-Nickelcarbonyl as catalyst according to Reppe
Cyclization of Ethine to Benzene with Triphenylphosphine-Nickelcarbonyl as catalyst according to Reppe
Phloroglucin.svg
Struktur von Phloroglucin
Struktur von Phloroglucin
Extraktivrektifikation.svg
Autor/Urheber: WilfriedC, Lizenz: CC BY-SA 3.0
Flussdiagramm einer Extraktivrektifikation
Autor/Urheber: WilfriedC, Lizenz: CC BY-SA 3.0
Flussdiagramm einer Extraktivrektifikation