Aromatische Kohlenwasserstoffe
Die aromatischen Kohlenwasserstoffe oder benzoiden Kohlenwasserstoffe, nach IUPAC Arene[1][2] genannt, sind cyclische, planare Kohlenwasserstoffe mit aromatischem System. Aufgrund ihres delokalisierten π-Elektronensystems sind sie energetisch günstiger als ihre nicht aromatischen Mesomere und deshalb chemisch stabiler. Aromatische Kohlenwasserstoffe lassen sich in mono- (mAh) oder polycyclische aromatische Kohlenwasserstoffe (PAK) einteilen.
Wie alle reinen Kohlenwasserstoffe sind aromatische Kohlenwasserstoffe unpolare, lipophile Verbindungen. Da aromatische Verbindungen den aliphatischen Kohlenstoffverbindungen gegenübergestellt und damit durch eine Negation definiert werden, bedeutet dies, dass alle nicht-aliphatischen organischen Verbindungen aromatisch sind. Die Klassifizierung organischer Verbindungen in Aliphaten und Aromaten erfolgt durch die Aromatizitätskriterien.
Geschichte
Der erste entdeckte Aromat war das 1825 von Michael Faraday in Leuchtgas gefundene Benzol (C6H6). Bald wurden auch Stoffe mit ähnlichen Eigenschaften entdeckt, die einen anderen Aufbau zeigten. Man bemerkte schnell, dass diese formal ungesättigten Verbindungen trotz Doppelbindungen nicht leicht zu Additionsreaktionen zu bewegen waren.
Beispiele
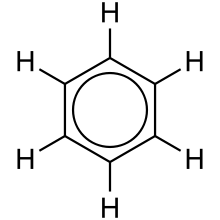
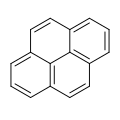
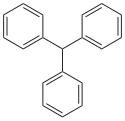
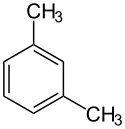
Beispiele von aromatischen Kohlenwasserstoffen Stamm-
verbindung
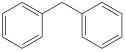
Benzolalkylierte Arene Arene mit mehreren Phenylgruppen (Polyarylalkane)
anellierte Arene (PAK)
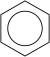
≡
Toluol
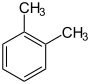


Xylole (o-, m-, p-Xylol)
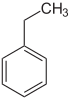

Ethylbenzol Cumol
Biphenyl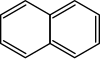
Anm.: Die Strukturformeln von aromatischen Verbindungen werden meist in nur einer mesomeren Form dargestellt.
Annulene, also cyclische Kohlenwasserstoffe mit konjugierten Doppelbindungen, können Aromatizität aufweisen. Nach Benzol ist [14]-Annulen das kleinste aromatische Annulen, ebenfalls aromatisch sind Annulene mit 18 und 22 Kohlenstoffatomen.[3]
Vorkommen und Gewinnung
Aromatische Kohlenwasserstoffe finden sich im Erdöl. Dort sind Arene zu finden, die die Strukturelemente von Indan, Tetrahydronaphthalin, Fluoren, Biphenyl und Acenaphthen aufweisen, sowie Arene mit isoprenoider Struktur.[4] Der überwiegende Teil der technisch wichtigen Verbindungen werden durch petrochemische Prozesse synthetisiert. Bei der Kokerei fallen Aromaten als Nebenprodukt an und sind im Steinkohlenteer und Kokereigas zu finden. Wichtige Massenprodukte sind Benzol, Toluol, die Xylole und Ethylbenzol (BTEX-Aromaten). Sie sind selbst die Rohstoffe für Kunststoffe und für andere Massenchemikalien. Wichtige PAK sind Naphthalin und Anthracen, die aus Steinkohlenteer und Erdöl gewonnen werden.
| Verfahren | Ziel des Verfahrens | Prozessbedingungen | Sonstige Charakteristika | |||
|---|---|---|---|---|---|---|
| Druck (bar) | Temperatur (T°) | Katalysator | Zugabe | |||
| Raffinationsverfahren | ||||||
| Hydrierung von Pyrolysebenzin | Hydrierung von Diolefinen und Entschwefelung | 40–60 | 200–250 | Co, Mo, Ni, Pd | H2 | Zweistufiges Verfahren |
| Benzoldruckraffination | Hydrierung von Kokereirohbenzol | 20–50 | 350 | Co, Mo | H2 | Schwefelreduzierung unter 0,5 ppm; Entfernung von ungesattigten Kohlenwasserstoffen, die die destillative Gewinnung von Benzol erschweren |
| Dealkylierungsprozesse | ||||||
| Houdry-Litol | Benzolerzeugung aus Toluol | 50 | 600 | Co, Mo | H2 | Hydrierung von Ungesättigten; hydrocrackende Spaltung von Nichtaromaten; Entschwefelung, Dealkylierung und Dehydrierung von Naphthenen führen zu hoher Benzol-Ausheute |
| Houdry-Dealkylierung (HDA) | Benzolerzeugung aus Toluol | 45 | max. 750 | H2 | Benzol-Ausbeute bis zu 99 % | |
| Isomerisierungsprozesse | ||||||
| Octafining | Erhöhter Anteil an p-Xylol | 10–30 | 425–480 | Pt/Zeolith | H2 | Vergleichbar mit den Prozessen Isomar (UOP), Isoforming (Exxon) und Isarom (IFP) |
| Transalkylierung | ||||||
| Arco | Herstellung von Benzol und C8-Aromaten aus Toluol | 2 | 480–520 | Al2O3/SiO2 | Fließbett-Verfahren in der Gasphase | |
| Tatoray | Herstellung von Benzol und C8-Aromaten aus Toluol | 10–50 | 350–530 | Zeolith | H2 | adiabatischer Prozess |
| Mobil LTD | Herstellung von Benzol und C8-Aromaten aus Toluol | 46 | 260–315 | Zeolith | Kontaktstandzeit ca. 1,5 Jahre | |
Derivate
Aromatische Kohlenwasserstoffe können mit organischen oder nichtorganischen Substituenten Derivate bilden.
Literatur
- Cornelsen: Chemie Oberstufe – Organische Chemie, 1. Auflage, ISBN 978-3-06-011174-9.
Einzelnachweise
- ↑ Eintrag zu arenes. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.A00435 – Version: 2.3.3.
- ↑ Eintrag zu aromatic. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.A00441 – Version: 2.3.3.
- ↑ F. A. Carey, R. J. Sundberg: Organische Chemie, VCH, Weinheim 1995.
- ↑ Hans-Dieter Jakubke, Ruth Karcher (Hrsg.): Lexikon der Chemie, Spektrum Akademischer Verlag, Heidelberg, 2001.
- ↑ Heinz-Gerhard Franck, Jürgen Walter Stadelhofer: Industrielle Aromatenchemie: Rohstoffe · Verfahren · Produkte. Springer, 1987, ISBN 978-3-662-07876-1, S. 135.
Auf dieser Seite verwendete Medien
chemical structure of biphenyl
Struktur von Anthracen
Struktur von Triphenylmethan
Struktur von Toluol
Skeletal formula of Naphthalene
chemical structure of benzene using aromatic layout
Struktur von Phenanthren
Autor/Urheber: An elite, Lizenz: CC BY-SA 3.0
Benzene molecule. Hydrogen atoms are shown, and π bonds are shown as delocalized.
Struktur von meta-Xylol
Struktur von Ethylbenzol
Struktur von Benzol.
Struktur von Cumol
Diphenylmethane