Glutaminase
| Glutaminase | ||
|---|---|---|
 | ||
| Kristallographische Struktur eines Protein-Dimers der Glutaminase aus Chryseobacterium proteolyticum.[1] | ||
| Sekundär- bis Quartärstruktur | Homodimer | |
| Isoformen | 3 | |
| Bezeichner | ||
| Gen-Name(n) | GLS GLS2 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 3.5.1.2, Hydrolase | |
| Reaktionsart | Desaminierung | |
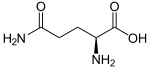
| Substrat | L-Glutamin + H2O | |
| Produkte | L-Glutamat + NH3 | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Lebewesen | |
Die Glutaminasen (L-Glutaminamidohydrolasen) sind Enzyme aus der Gruppe der Amidasen (auch Amidohydrolasen), die aus der Aminosäure Glutamin unter Aufnahme von Wasser (H2O) und Freisetzung von Ammoniak (NH3) Glutamat erzeugen. Glutaminasen finden sich in den Nerven- und Gliazellen aller höherer Lebewesen und sind durch Phosphate und Calciumionen (Ca2+) aktivierbar.[2] Glutaminase wird beispielsweise in den periportalen Hepatozyten, also den äußeren Zellen eines Leberläppchens, exprimiert und produziert hier Ammoniak (NH3) für die Harnstoffsynthese.[3]
Katalysiertes Gleichgewicht
Durch die Hydrolyse von L-Glutamin entstehen L-Glutamat und Ammoniak. Diese Reaktion stellt den ersten Schritt der Glutaminolyse dar.
Einzelnachweise
- ↑ PDB 3A56; Hashizume R, Mizutani K, Takahashi N, Matsubara H, Matsunaga A, Yamaguchi S, Mikami B: Crystal structure of protein-glutaminase. In: to be published. 2010, doi:10.2210/pdb3a56/pdb.
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Glutaminase im Lexikon der Neurowissenschaft, abgerufen am 5. Dezember 2012.
- ↑ Dennis Botman, Wikky Tigchelaar, Cornelis J.F. Van Noorden: Determination of Phosphate-activated Glutaminase Activity and Its Kinetics in Mouse Tissues using Metabolic Mapping (Quantitative Enzyme Histochemistry). In: Journal of Histochemistry & Cytochemistry. Band 62, Nr. 11, 27. August 2014, S. 813–826, doi:10.1369/0022155414551177, PMID 25163927, PMC 4230542 (freier Volltext).
Auf dieser Seite verwendete Medien
Struktur von L-Glutamin
Struktur von L-Glutaminsäure