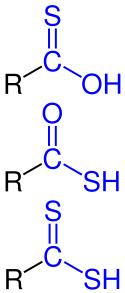
Carboxylic Acid General Structure V.1
Relevante Bilder
Relevante Artikel
CarboxygruppeDie Carboxygruppe ist in der Chemie die funktionelle Gruppe –COOH der Carbonsäuren. Der Name leitet sich formal aus der Kombination der beiden enthaltenen Elemente Carbonylgruppe und Hydroxygruppe her. .. weiterlesen
Funktionelle GruppeIn der Organischen Chemie versteht man unter einer funktionellen Gruppe die Atomgruppe in einer Verbindung, die die Stoffeigenschaften und das Reaktionsverhalten der Verbindung maßgeblich bestimmt. Eine Verbindung kann auch mehrere funktionelle Gruppen mit unterschiedlichen Eigenschaften tragen. In diesem Zusammenhang wird von heterobifunktionalen Molekülen gesprochen bzw. bei mehreren funktionellen Gruppen heteropolyfunktional. Analog kann bei Molekülen mit mehreren gleichen funktionellen Gruppen von homobifunktional bzw. homopolyfunktional gesprochen werden. Verbindungen, die gleiche funktionelle Gruppen, aber unterschiedliche Alkyl- oder Arylreste haben, werden auf Grund ihrer ähnlichen Eigenschaften zu Stoffklassen zusammengefasst. .. weiterlesen
CarbonsäurenCarbonsäuren, auch Karbonsäuren, sind organische Verbindungen, die eine oder mehrere Carboxygruppen (–COOH) tragen und damit einen mehr oder weniger ausgeprägten aciden Charakter haben. Die Salze von Carbonsäuren werden Carboxylate genannt. Verbindungen, in denen die OH-Gruppe der Carboxygruppe durch eine andere Gruppe – z. B. –OR, –NH2 oder ein Halogenid – ersetzt ist, werden Carbonsäurederivate genannt. Zu den Carbonsäurederivaten gehören damit Carbonsäureester, Carbonsäureamide und Carbonsäurehalogenide. .. weiterlesen
SäurenSäuren sind chemische Verbindungen, die in der Lage sind, ein oder auch mehrere ihrer gebundenen Wasserstoff-Atome als Proton (H+) an einen Reaktionspartner zu übertragen, der für jedes zu bindende Proton ein freies Elektronenpaar zur Verfügung stellen muss. Dies wird als Protonenübertragungsreaktion bezeichnet. Dementsprechend werden die Moleküle, die Protonen binden können, auch als Protonenakzeptoren bezeichnet. Zu bedenken bleibt, dass an unterschiedliche Atome gebundene H-Atome auch unterschiedlich leicht als Protonen abgegeben werden können. Pauschal wird dann von mehr oder weniger stark sauren Protonen oder Verbindungen gesprochen. In rein wässrigen Lösungen steht als Reaktionspartner, der die Protonen aufnehmen kann, nur das Lösungsmittel Wasser zur Verfügung. Es bilden sich dann Oxonium-Ionen, die auch Hydroniumionen genannt werden (H3O+), und der pH-Wert der Lösung sinkt. Säuren reagieren mit sogenannten Basen unter Bildung von Wasser und Salzen. Eine Base ist somit das Gegenstück zu einer Säure und vermag die Säure zu neutralisieren. .. weiterlesen