Adenylat-Kinase
| Adenylat-Kinase | ||
|---|---|---|
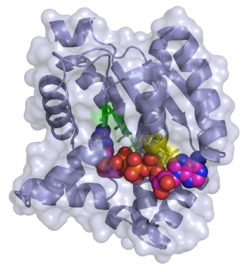 | ||
| Bänder-/Oberflächenmodell mit P1,P4-Di(adenosin-5′)tetraphosphat (ADP-ADP) nach PDB 2C95. Aktives Zentrum (grün), ADP-Bindungsstelle (gelb) | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 194 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Monomer | |
| Bezeichner | ||
| Gen-Name | AK1 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.7.4.3, Kinase | |
| Reaktionsart | (De-)Phosphorylierung | |
| Substrat | ATP + AMP | |
| Produkte | ADP + ADP | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
Das Enzym Adenylat-Kinase (AK1) (auch Myokinase und AMP-Kinase) katalysiert folgende Reaktionen, um die Balance zwischen dem Phosphatakzeptor ADP und dem Phosphatdonator ATP aufrecht zu halten:
- 2 ADP → ATP + AMP
In weiterer Folge wird durch die Hydrolyse des ATPs Energie frei, welche im Muskel oder anderen Geweben genutzt werden kann.
Die Reaktion ist auch in die andere Richtung möglich, falls ATP im Überschuss vorhanden ist und ADP als Energiespeicher notwendig ist:
- ATP + AMP → 2 ADP
In Säugetieren haben sich mindestens drei Isoformen des Enzyms entwickelt, im Mensch sind fünf Allele bekannt. Die älteste Form ist auch in anderen Lebewesen zu finden. Im Mensch ist sie in allen Gewebetypen lokalisiert. Ein durch Mutation am AK1-Gen hervorgerufener Adenylat-Kinase-Mangel führt zu einer Form der hämolytischen Anämie,[1][2] eine Mutation am AK2-Gen liegt der Retikulären Dysgenesie zugrunde.[3]
AK6 und OdinAK
Im November 2022 wurde bekannt, dass Archaeen des Kandidaten-Phylums Odinarchaeota ein Enzym OdinAK besitzen, das strukturelle Ähnlichkeiten mit dem menschlichen AK6 aufweist. Dies war neu, denn zuvor waren bei Archaeen noch keine Isoformen des Enzyms gefunden worden.[4]
Weblinks
Einzelnachweise
- ↑ PROSITE documentation PDOC00104. Adenylat-Kinase. Swiss Institute of Bioinformatics (SIB), abgerufen am 20. September 2011 (englisch).
- ↑ UniProt P00568
- ↑ Reticular dysgenesis. In: Online Mendelian Inheritance in Man. (englisch)
- ↑ Apoorv Verma, Emma Åberg-Zingmark, Tobias Sparrman, Ameeq Ul Mushtaq, Per Rogne, Christin Grundström, Ronnie Berntsson, Uwe H. Sauer, Lars Backman, Kwangho Nam, Elisabeth Sauer-Eriksson, Magnus Wolf-Watz: Insights into the evolution of enzymatic specificity and catalysis: From Asgard archaea to human adenylate kinases. In: Science Advances, Band 8, Nr. 44, eabm4089, 4. November 2022; doi:10.1126/sciadv.abm4089, PMID 36332013, PMC 9635829 (freier Volltext). Dazu:
- Sergio Postak: Human Enzyme Evolved from Ancient Single-Celled Organisms, Study Suggests. Auf Sci.News vom 7. November 2022.
- Anna Manz: Ur-Enzym mit besonderen Fähigkeiten entdeckt - Archaeen tragen urtümlichen Vorläufer eines auch für menschliche Zellen wichtigen Moleküls. Auf scinexx.de vom 2. Januar 2023.
Auf dieser Seite verwendete Medien
3d ribbon/surface model of adenylate kinase in complex with bis(adenosine)teraphosphate (ADP-ADP) after PDB 2C95. The active center is colored yellow, the ATP binding site green. Ref.: g.bunkoczi et al. structure of adenylate kinase 1 in complex with p1, p4-di(adenosine)tetraphosphate. TO BE PUBLISHED, .
