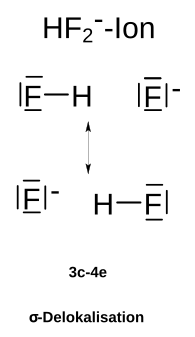
Dreizentrenbindung HF2 Ion
Relevante Bilder
Relevante Artikel
DreizentrenbindungDie Dreizentrenbindung, die einfachste Mehrzentrenbindung, ist ein spezieller Typ der Atombindung (kovalente Bindung), bei der sich nicht zwei Atome, sondern drei Atome ein Elektronenpaar teilen. Nach der modernen Atomtheorie (Orbitaltheorie) beschreibt man Dreizentrenbindungen durch Überlappung dreier Atomorbitale, wobei drei Molekülorbitale entstehen. Hiervon ist eines stets bindend und eines antibindend. Das dritte Molekülorbital kann schwach bindenden, schwach antibindenden oder nichtbindenden Charakter besitzen. Paradebeispiele für Dreizentrenbindungen finden sich im H3+-Ion, im Diboran (B2H6), im Hydrogendifluorid-Ion (FHF−) oder im Nitrit-Ion (NO2−). Man spricht im Zusammenhang mit Drei- oder Mehrzentrenbindungen auch von einer Delokalisation der Bindungselektronen. Zweizentrenbindungen – die normalen kovalenten Bindungen – sowie freie Elektronenpaare werden hingegen als lokalisiert bezeichnet. .. weiterlesen