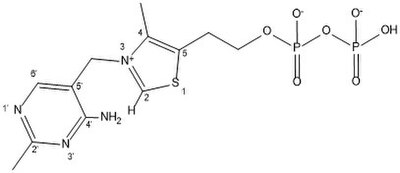
Deprotonation of thiamine pyrophosphate
Relevante Bilder
Relevante Artikel
PyruvatdecarboxylasePyruvatdecarboxylase ist ein homotetrameres Enzym, das die Decarboxylierung von Brenztraubensäure zu Acetaldehyd und Kohlendioxid im Cytoplasma katalysiert. Unter anaeroben Bedingungen ist dieses Enzym ein Teil der Gärung, die in Hefen stattfindet, insbesondere in der Gattung Saccharomyces, um Ethanol durch Gärung zu produzieren. Die Umwandlung von Pyruvat in Acetaldehyd und Kohlenstoffdioxid durch Pyruvatdecarboxylase steht am Anfang dieses Prozesses. Pyruvatdecarboxylase ist abhängig von den Cofaktoren Thiaminpyrophosphat und Magnesium. Das Enzym sollte nicht mit der Pyruvat-Dehydrogenase verwechselt werden, einer Oxidoreduktase, die die oxidative Decarboxylierung von Pyruvat zu Acetyl-CoA katalysiert. .. weiterlesen