Active site of GAPDH of E. coli
Eigenes Werk, erstellt anhand folgender Literatur:
- E. Duée, L. Olivier-Deyris, E. Fanchon, C. Corbier, G. Branlant, O. Dideberg: Comparison of the structures of wild-type and a N313T mutant of Escherichia coli glyceraldehyde 3-phosphate dehydrogenases: implication for NAD binding and cooperativity. In: Journal of molecular biology. Band 257, Nummer 4, April 1996, S. 814–838, doi:10.1006/jmbi.1996.0204, PMID 8636984.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer, Gregory J. Gatto jr.: Stryer Biochemie. Springer-Verlag, 2014, ISBN 978-3-8274-2988-9, S. 465 (eingeschränkte Vorschau in der Google-Buchsuche
Relevante Bilder
Relevante Artikel
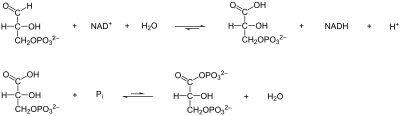
Glycerinaldehyd-3-phosphat-DehydrogenaseDie Glycerinaldehyd-3-phosphat-Dehydrogenase (GAPDH, Syn. 3-Phosphoglycerinaldehyd-Dehydrogenase) ist ein Enzym der Glycolyse und daher unentbehrlich für alle Lebewesen. Sie katalysiert die Umwandlung von Glycerinaldehyd-3-phosphat zu 1,3-Bisphosphoglycerat. Bei dieser Reaktion wird eine energiereiche Phosphat-Bindung aufgebaut, die im folgenden Schritt der Glycolyse auf ADP übertragen wird, wodurch ATP entsteht. Außerdem wird in der katalysierten Reaktion ein NAD+ zu NADH/H+ umgewandelt. .. weiterlesen