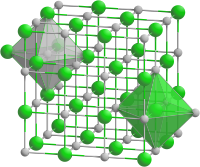
Zinn(II)-sulfid
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
(c) Goran tek-en, CC BY-SA 4.0 | |||||||||||||||||||
| _ Sn2+ _ S2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Zinn(II)-sulfid | ||||||||||||||||||
| Andere Namen | Zinnmonosulfid | ||||||||||||||||||
| Verhältnisformel | SnS | ||||||||||||||||||
| Kurzbeschreibung | dunkelgrauer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 150,76 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Dichte | 5,22 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | etwa 1230 °C[1] | ||||||||||||||||||
| Löslichkeit | nahezu unlöslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Zinn(II)-sulfid ist eine chemische Verbindung aus den Elementen Zinn und Schwefel mit der Formel SnS.
Vorkommen
In der Natur kommt Zinn(II)-sulfid in Form des Minerals Herzenbergit vor.[3]
Gewinnung und Darstellung
Zinn(II)-sulfid kann gewonnen werden durch Reaktion von Zinn mit Schwefel oder durch Reaktion von Zinn(II)-chlorid mit Schwefelwasserstoff.
Eigenschaften
Zinn(II)-sulfid ist ein dunkelgrauer Feststoff, der unlöslich in Wasser, jedoch löslich in konzentrierter Salzsäure ist.[4]
Verwendung
Schwerlösliches (dunkelbraunes) Zinn(II)-sulfid kann als qualitativer Nachweis für Sn2+-Ionen genutzt werden (Fällungsreaktion). Aus Sn2+-haltigen Lösungen kann hierbei mit Schwefelwasserstoff oder löslichen Sulfidsalzen Zinn(II)-sulfid ausgefällt werden.[5]
Des Weiteren findet es als Zusatz in der Pulvermetallurgie Verwendung.[6] Es ist ein binärer Halbleiter mit einer Bandlücke von 1,3 eV bis 1,4 eV und wird in der Halbleitertechnik eingesetzt.[7][8]
Siehe auch
- Zinn(IV)-sulfid SnS2
- Tributylzinnsulfid C24H54SSn2
Einzelnachweise
- ↑ a b c d e Eintrag zu Zinn(II)-sulfid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. September 2007. (JavaScript erforderlich)
- ↑ a b Datenblatt Tin(II) sulfide bei Sigma-Aldrich, abgerufen am 26. April 2011 (PDF).
- ↑ Mineraldatenblatt - Herzenbergite (englisch, PDF 57,5 kB)
- ↑ Robert Strebinger: Praktikum der qualitativen chemischen Analyse einschließlich Mikro- und Tüpfelreaktionen. 1939, S. 49.
- ↑ Gerhart Jander, Ewald Blasius, Lehrbuch der analytischen und präparativen Anorganischen Chemie. 14. Auflage. Hirzel Verlag, Stuttgart 1995, ISBN 3-7776-0612-X.
- ↑ Chemmetall: Verwendung von Metallsulfiden (Memento vom 2. Februar 2012 im Internet Archive)
- ↑ Marcel Gielen: Tin Chemistry: Fundamentals, Frontiers, and Applications. John Wiley & Sons, 2008, ISBN 978-0-470-75808-3, S. 290 f. (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Jacob A. Andrade-Arvizu et al.: SnS-based thin film solar cells: perspectives over the last 25 years. Journal of Materials Science: Materials in Electronics, 2015, doi:10.1007/s10854-015-3050-z.
Auf dieser Seite verwendete Medien
(c) Goran tek-en, CC BY-SA 4.0
Crystal structure of NaCl with coordination polyhedra