Zinn(II)-iodid
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| _ Sn2+ _ I− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Zinn(II)-iodid | ||||||||||||||||||
| Andere Namen | Zinndiiodid | ||||||||||||||||||
| Verhältnisformel | SnI2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 372,52 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest[2] | ||||||||||||||||||
| Dichte | 5,28 g·cm−3 (25 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | 714 °C[2] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Zinn(II)-iodid ist eine anorganische chemische Verbindung des Zinns aus der Gruppe der Iodide.
Gewinnung und Darstellung
Zinn(II)-iodid kann durch Reaktion von Zinn mit Iod bei mehr als 600 °C gewonnen werden, wobei sich erst Zinn(IV)-iodid bildet, das mit überschüssigem Zinn zu Zinn(II)-iodid reagiert.[4]
Es kann auch durch Reaktion einer Zinn(II)-chloridlösung mit Kaliumiodid dargestellt werden[5]:
Eigenschaften
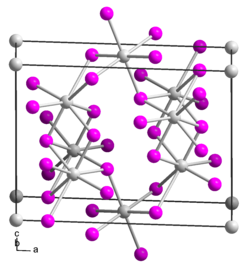
Zinn(II)-iodid ist ein gelber bis roter Feststoff,[2] der wenig löslich in Wasser ist. Er besitzt eine monokline Kristallstruktur mit der Raumgruppe C2/m (Raumgruppen-Nr. 12), den Gitterparametern a = 1417 pm, b = 453,5 pm, c = 1087 pm, 92° und sechs Formeleinheiten pro Elementarzelle.[3] Mit Halogeniden bildet es Halogenkomplexe.[6]
Einzelnachweise
- ↑ Datenblatt Tin(II) iodide, ultra dry, 99.999% (metals basis) bei AlfaAesar, abgerufen am 23. Juli 2013 (PDF) (JavaScript erforderlich).
- ↑ a b c d e f g h i Datenblatt Tin(II) iodide, powder, 99.999% trace metals basis bei Sigma-Aldrich, abgerufen am 23. Juli 2013 (PDF).
- ↑ a b c Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. Springer DE, 1997, ISBN 3-540-60035-3, S. 740 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Andrea Krüger: Strukturchemische Untersuchungen von neuen binären und ternären ... Herbert Utz Verlag, 1999, ISBN 3-89675-472-6, S. 25 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Anil Kumar De: A Text Book of Inorganic Chemistry. New Age International, 2007, ISBN 81-224-1384-6, S. 377 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 965.
Auf dieser Seite verwendete Medien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Autor/Urheber: Andif1, Lizenz: CC BY-SA 4.0
Crystal structure of tin(II) iodide. Created using Diamond 4. Data from R. A. HOWIE, W. MOSER* AND I. C. TREVENA The Crystal Structure of Tin(II) Iodide Acta Cryst. (1972). B28, 2965



