Zinkacetat
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Zinkacetat | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C4H6O4Zn (wasserfrei) | |||||||||||||||||||||
| Kurzbeschreibung | weißer Feststoff mit schwachem Geruch nach Essigsäure[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | A16AX05 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse |
| |||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Zinkacetat ist das Zinksalz der Essigsäure mit der Konstitutionsformel Zn(CH3COO)2, welches in Kaugummi als Geschmacksverstärker eingesetzt und dort mit der E-Nummer E 650 gekennzeichnet wird. Bei Zinkacetat handelt es sich um eine Zinkverbindung, die gut vom Darm in die Blutbahn resorbiert wird. Somit dient diese unter anderem als Zinklieferant für den Organismus.
Gewinnung und Darstellung
Zink(II)-acetat kann durch Reaktion von Zinkoxid oder Zinkcarbonat mit Essigsäure hergestellt werden.
Die direkte Synthese des wasserfreien Salzes erfolgt im Labor über die Umsetzung von Zinknitrat mit einem Überschuss an Essigsäureanhydrid zur Entfernung des entstehenden Wassers nach:[5]
Eigenschaften
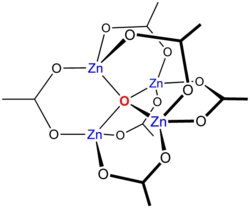
Beim Erhitzen von Zn(CH3COO)2 im Vakuum wird Acetanhydrid abgespalten und es entsteht ein „basisches Zinkacetat“ der Formel Zn4O(CH3COO)6. Es wird die unten abgebildete Clusterverbindung mit einer tetraedrischen Struktur gebildet, die dem analogen Berylliumsalz ähnelt.[6]
Verwendung
Zinkacetat ist zur Verwendung in sonstigen Süßwaren, einschließlich der Atemerfrischung dienenden Kleinstsüßwaren zugelassen. Die Menge an Zinkacetat ist auf 1000 mg/kg beschränkt.[7]
Zinkacetat soll, ähnlich wie Zinkgluconat, in Hustenbonbons verabreicht durch eine lokale Wirkung im Hals die Dauer von Erkältungen verkürzen.[8]
Eine Suspension von 5 g Zinkacetat in 100 ml 90 %igem Ethanol (Schlesinger-Reagenz) dient u. a. in der Dünnschichtchromatographie zum Nachweis von Urobilinen und Stercobilin. Die bei einer positiven Reaktion auftretende Fluoreszenz kann im UV-Licht betrachtet werden.[9]
Auch wird Zinkacetat in der Medizin im Kontext des Kupferkreislaufs eingesetzt. Zum Beispiel kann Zinkacetat bei der Behandlung von Morbus Wilson helfen.[10]
Weblinks
Einzelnachweise
- ↑ Eintrag zu E 650: Zinc acetate in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- ↑ Eintrag zu ZINC ACETATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. März 2020.
- ↑ a b c d e f g Eintrag zu Zinkacetat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2025. (JavaScript erforderlich)
- ↑ Gaylord Chemical Company, L.L.C.; Bulletin 102: Dimethyl Sulfoxide (DMSO) Solubility Data. (PDF) Juni 2014, S. 15.
- ↑ Georg Brauer: Zinkacetat. In: Handbuch der Präparativen Anorganischen Chemie. Ferdinand Enke Verlag, Stuttgart 1954, S. 806.
- ↑ Hirozo Koyama, Yoshihiko Saito: The Crystal Structure of Zinc Oxyacetate, Zn4O(CH3COO)6. In: Bulletin of the Chemical Society of Japan. Band 27, Nr. 2, Januar 1954, S. 112–114, doi:10.1246/bcsj.27.112.
- ↑ Verordnung (EG) Nr. 1333/2008 des Europäischen Parlaments und des Rates vom 16. Dezember 2008 über Lebensmittelzusatzstoffe in der konsolidierten Fassung vom 14. April 2014, abgerufen am 29. Juli 2016.
- ↑ G. Eby: Zinc Lozenges: Cold Cure or Candy? Solution Chemistry Determinations, Bioscience Reports, 2004, Volume 24, No.1, February 2004. Deutscher Bericht über die Veröffentlichung.
- ↑ E. Merck AG (Hrsg.): Anfärbereagenzien für Dünnschicht- und Papierchromatographie. Darmstadt 1965, S. 57.
- ↑ GJ. Brewer: Zinc acetate for the treatment of Wilson’s disease. In: Expert Opin Pharmacother., September 2001, 2(9), S. 1473–1477. doi:10.1517/14656566.2.9.1473 PMID 11585025
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
chem structure of zinc acetate
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Struktur des Zn2+-Ions
Die Zahl 2








