Ziehl-Neelsen-Färbung

Die Ziehl-Neelsen-Färbung (nach Franz Ziehl und Friedrich Neelsen) ist eine gebräuchliche Färbung für mikroskopische Präparate in der Mikrobiologie, um sogenannte „säurefeste“ Bakterien (z. B. Mykobakterien und Nocardien) durch Färbung von anderen nicht „säurefesten“ Bakterien zu unterscheiden.[1][2] Diese Kontrastfärbung ist eine wichtige differentialdiagnostische Hilfe zur Identifizierung bestimmter Krankheitserreger, vor allem von Erregern der Tuberkulose und der Lepra. Eine Zuordnung zu einem Genus oder einer Spezies der Bakterien ist mit diesem Merkmal der Säurefestigkeit allein allerdings nicht möglich.
Das Färbe-Prinzip beruht darauf, dass bei speziell diesen Bakterien in der Zellwand besondere Lipide (Wachse, Mykolsäuren) enthalten sind, die bei üblichen anderen Färbeverfahren verhindern, dass die Bakterien gefärbt werden, indem sie das Eindringen des hydrophilen Farbstoffs verhindern. Bei der Ziehl-Neelsen-Färbung wird mit Karbolfuchsin (Phenolfuchsin) in der Hitze gefärbt, so dass einerseits der Farbstoff trotz der Lipidhülle eindringt, andererseits aber der Farbstoff mit üblichen Entfärbemethoden bei normaler Temperatur nur schwer wieder aus den Bakterien zu extrahieren ist. Danach werden die nicht „säurefesten“ Objekte mit Salzsäure oder einem Gemisch aus Alkohol und Salzsäure bei normaler Temperatur wieder entfärbt. Nur die „säurefesten“ Bakterien behalten bei dieser Behandlung den Farbstoff und bleiben deshalb rot gefärbt, alle anderen Bakterien verlieren den Farbstoff wieder.
Eine auf dem gleichen Prinzip beruhende Färbung ist die sog. Auramin-Rhodamin-Färbung. Dabei wird ein fluoreszierender Farbstoff (Auramin O) statt Fuchsin eingesetzt. Dieser bleibt bei der Entfärbung wie das Fuchsin auch in den Bakterien und lässt sich ebenso auf diese Weise nicht mehr herauslösen. Unter dem Fluoreszenz-Mikroskop leuchten dann die „säurefesten“ Bakterien orange und heben sich dadurch vom Hintergrund deutlich ab.
Die Untersuchung von histologischen Präparaten und – bei Lungentuberkulose – von Sputum-Präparaten mit diesen Färbungen ist relativ zeitaufwendig, da man mit hoher Vergrößerung mikroskopieren muss und häufig nur sehr wenige Mykobakterien zu finden sind, die allerdings zur Diagnose ausreichen. Die Methode der Färbung und des Mikroskopieren stellt bei der Tuberkulose aber immer noch einen schnellen Weg der Erregerfindung dar. Der Goldstandard ist aber immer noch die Kultur, die bei Mycobacterium tuberculosis wegen seiner langsamen Vermehrung einige Wochen in Anspruch nimmt.
Methode
Die hitzefixierten Bakterien-Ausstriche bzw. histologischen Präparate werden mit wässrig-alkoholischer Karbolfuchsinlösung (Phenolfuchsin) überschichtet und über einer leuchtenden Bunsenbrenner-Flamme dreimal bis zum Dampfen (nicht Kochen!) erhitzt. Dabei dringt der Farbstoff in alle Bakterien ein, auch durch die Lipid-haltigen Zellwände in die Mykobakterien oder anderen „säurefesten“ Bakterien. Anschließend wird der Farbstoff abgegossen und mit Leitungswasser kurz abgespült. Dann wird mit Alkohol, der 3 % Salzsäure enthält, etwa eine Minute entfärbt, wobei jedoch die „säurefesten“ Bakterien den Farbstoff behalten und nur die nicht „säurefesten“ Objekte entfärbt werden. Nach kurzem Abspülen der Lösung unter Leitungswasser erfolgt in der Regel eine Gegenfärbung der nicht „säurefesten“ Objekte mit 0,3- bis 1-prozentiger Methylenblau-Lösung (etwa drei Minuten). In einem modifizierten Verfahren wird Janusgrün B als Gegenfärbung verwendet. Nach der Gegenfärbung wird mit Wasser gespült.
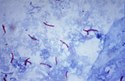
Säurefeste Bakterien sind danach rot gefärbt, während alles andere nur den Farbstoff der Gegenfärbung aufnimmt (hier blau).
Historisches
Als Entdecker des Phänomens der säurefesten Stäbchen 1882 gilt Paul Ehrlich, er färbte mit Kristallviolett. Franz Ziehl (Zusatz von Phenol, 1882) und Friedrich Neelsen (Verwendung von Fuchsin, 1883) haben dieses Verfahren durch den Einsatz einer anderen Farbstoff-Lösung, Rindfleisch 1883 durch das Erhitzen beim Färben verbessert, woher die Bezeichnung stammt.
Die Methode zur Prüfung auf Säurefestigkeit mittels Auramin-Färbung stammt von P. Hagemann (1938).
Einzelnachweise
- ↑ P. Varughese, D. M. Helbecque, K. B. McRae, L. Eidus: Comparison of strip and Ziehl-Neelsen methods for staining acid-fast bacteria. In: Bulletin of the World Health Organization. Band 51, Nummer 1, 1974, S. 83–91, ISSN 0042-9686. PMID 4141944. PMC 2366253 (freier Volltext).
- ↑ L. C. Scherer, R. D. Sperhacke, M. L. Rossetti, A. Ruffino-Netto, A. L. Kritski: Usefulness of the polymerase chain reaction dot-blot assay, used with Ziehl-Neelsen staining, for the rapid and convenient diagnosis of pulmonary tuberculosis in human immunodeficiency virus-seropositive and -seronegative individuals. In: Infectious disease reports. Band 3, Nummer 1, März 2011, S. e3, ISSN 2036-7430. doi:10.4081/idr.2011.e3. PMID 24470902. PMC 3892596 (freier Volltext).
Auf dieser Seite verwendete Medien
This photomicrograph reveals Mycobacterium tuberculosis bacteria using acid-fast Ziehl-Neelsen stain; Magnified 1000 X.
The acid-fast stains depend on the ability of mycobacteria to retain dye when treated with mineral acid or an acid-alcohol solution such as the Ziehl-Neelsen, or the Kinyoun stains that are carbolfuchsin methods specific for M. tuberculosis.