Zerebrales Aneurysma
| Klassifikation nach ICD-10 | |
|---|---|
| I67.1 | Zerebrales Aneurysma |
| ICD-10 online (WHO-Version 2019) | |
Ein zerebrales Aneurysma oder intrakranielles Aneurysma ist eine pathologisch permanente Erweiterung des Querschnitts oder eine ballonförmige Aussackung (Aneurysma) einer Hirnarterie. Es kann zu einem Riss (Ruptur) kommen, was eine unkontrollierte Hirnblutung zur Folge hat. Eine Ruptur tritt im Durchschnitt etwa bei 1 % der Aneurysmen pro Jahr auf und kann tödlich enden.
Einteilung
Man unterteilt Aneurysmen der Gehirnarterien anhand ihrer Lokalisierung, Größe und Morphologie.

Zerebrale Aneurysmen treten innerhalb des Schädels auf, dort werden sie anhand der Lokalisierung der Arterie, beispielsweise der Arteria carotis interna, klassifiziert. Die meisten Aneurysmen treten am Circulus arteriosus cerebri auf. Sie treten zu 95 % im vorderen arteriellen Blutkreislauf auf, nur zu 5 % im hinteren Kreislauf.[1]
Zerebrale Aneurysmen werden anhand ihrer Größe klassifiziert. Dazu wird ihr Durchmesser bestimmt. Aneurysmen mit einem Durchmesser kleiner als 2 mm werden als Mikroaneurysmen bezeichnet. Aneurysmen mit einem Durchmesser größer als 25 mm nennt man Riesenaneurysmen.
Zerebrale Aneurysmen werden anhand ihrer Morphologie in folgenden Typen aufgeteilt:
- Sakkuläre Aneurysmen sind durch eine ballonförmige Aussackung an einer Arterie charakterisiert.
- Fusiforme Aneurysmen sind lokal aufgeweitete Gefäße mit einem maximalen Gefäßdurchmesser in der Mitte, der zu beiden Seiten hin abnimmt.
- Dissezierende Aneurysmen sind Gefäßerweiterungen aufgrund einer Aufsplitterung der Wandschichten des Blutgefäßes. Blut gelangt so zwischen innere und äußere Gefäßwand.
Sakkuläre Aneurysmen sind mit etwa 91 % die häufigste Form zerebraler Aneurysmen, gefolgt von fusiformen Aneurysmen, die etwa 6 % ausmachen.[2]
Verbreitung
Die normalisierte Krankheitshäufigkeit (Prävalenz) beträgt zwischen 3 % und 7 %.[1][3] Zerebrale Aneurysmen treten verstärkt bei Menschen ab dem 40. Lebensjahr auf.[1] Frauen sind im Verhältnis 5:3 häufiger betroffen als Männer.[1] Nachfahren von Verwandten ersten Grades, die einen Aneurysmabefund aufweisen, haben eine drei bis viermal höhere Prävalenz für ein Aneurysma im Vergleich zur Normalbevölkerung.[4]
Ursache
Zerebrale Aneurysmen sind nicht angeboren, sondern entwickeln sich im Lauf des Lebens. Die Entstehungsursache von zerebralen Aneurysmen ist ungeklärt. Diskutiert werden beispielsweise eine angeborene Schwäche der Zellen der Gefäßinnenwand, der sogenannten Endothel-Zellen. Im Laufe des Lebens entstünden dann unter bestimmten Umständen, wie z. B. länger bestehendem Bluthochdruck, ein Aneurysma.[4] Beeinflussbare (exogene) Faktoren, die ein Entstehen begünstigen, sind Rauchen oder Alkoholmissbrauch.[4] Die sehr seltene Zystenniere begünstigt ebenfalls eine Entstehung.[1] Eine 2010 veröffentlichte Studie dokumentiert zudem ein deutlich erhöhtes Risiko für das Vorliegen von Hirnaneurysmen bei Patienten mit einer Aorta bicuspida, einer relativ häufigen angeborenen Fehlbildung der Aortenklappe.[5] Es ist bekannt, dass durch Headbangen eine Häufung der Fälle mit einer Arterienerweiterung der Arteria vertebralis vorkommt.[6]
Pathophysiologie
Eine Theorie der Aneurysmenbildung ist das Auftreten einer Schwachstelle in der Gefäßwand. Diese wird durch stetiges Auftreffen des Blutflusses auf einen kleinen Bereich verursacht. Mit zunehmender Zeit vergrößert sich die Schwachstelle und ein Aneurysma bildet sich.[7] Durch die zunehmende Fläche wird die Spannung auf die Gefäßwand erhöht. Diese Spannung verursacht eine komplexe Entzündungsreaktion und führt zur Aneurysmenbildung.[8]
Es gibt Ansätze, die versuchen, hämodynamische Eigenschaften mit der Ruptur von Aneurysmen zu verknüpfen. Beispielsweise wurde eine Verbindung von Wandschubspannung (engl. wall-shear stress) und Rupturrate untersucht. Es wurden bisher widersprüchliche Ergebnisse präsentiert.[9]
Klinische Erscheinungen
Unrupturierte zerebrale Aneurysmen verursachen selten Symptome. Symptome treten meist dann auf, wenn größere Aneurysmen Neuronen komprimieren. Es können z. B. Sehstörungen, Schmerzen und Schwindel auftreten. Größere Aneurysmen sind häufiger symptomatisch.[4]
Ein rupturiertes Aneurysma führt zu einem unkontrollierten Blutausfluss in der Hirnregion (Subarachnoidalblutung). Diese kann zu Vernichtungskopfschmerz, Ohnmacht und Nackensteifigkeit führen.[4]
Rupturrisiko
Die Hauptgefahr eines zerebralen Aneurysmas ist die Entstehung eines Risses (Ruptur) mit folglicher Subarachnoidaler Einblutung. Es ist nicht bekannt, ob und wann eine solche Ruptur auftritt. Man kann aber eine Abschätzung angeben, wie hoch das Risiko einer Ruptur ist. Klinische Studien weisen eine Abhängigkeit von der Größe[10] und der Lage des Aneurysmas nach.[11] Mikroaneurysmen mit einem Durchmesser von weniger als 3 mm haben ein nicht messbares Rupturrisiko. Kleine Aneurysmen mit einem Durchmesser von weniger als 7 mm haben ein Rupturrisiko von weniger als 1 % pro Jahr und wachsen zudem langsam.[10] Eine Schätzung des Rupturrisikos von 5 % pro 5 Jahre ist klinisch angemessen.[12]
Untersuchungsmethoden
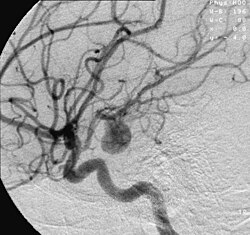
Zerebrale Aneurysmen werden durch Angiografien und transkranielle Dopplersonografie diagnostiziert. Bei den Angiografien handelt es sich um eine spezialisierte radiologische Darstellung von Gefäßen mittels diagnostisch bildgebender Verfahren wie Röntgen oder der Magnetresonanztomografie.


Folgende Untersuchungen werden zur Diagnostik verwendet:
- Digitale Subtraktionsangiographie (2D und 3D)
- CT-Angiografie
- MR-Angiografie
- Transkranielle Dopplersonografie.
Die Untersuchungsarten sind dabei unterschiedlich gut geeignet, um Aneurysmen zu detektieren. Man misst die Sensitivität, also wie viele bekannte Aneurysmen mit einer Untersuchungsart gefunden wurden. Die beste Sensitivität besitzt die Digitale Subtraktionsangiographie mit nahezu 100 %, sie wird daher als Goldstandard verwendet. Bei der CT-Angiografie beträgt die Sensitivität 90 %, bei der MR-Angiografie 87 %. Die niedrigste Sensitivität besitzt die transkranielle Dopplersonografie mit 82 %.[13]
Weitere Faktoren, die einen Aneurysmanachweis beeinflussen, sind Größe des Aneurysmas, Bildqualität und Erfahrung des Radiologen. Mikroaneurysmen mit einem Durchmesser von weniger als 2 mm sind mit bildgebenden Methoden nur schwer nachzuweisen.[4]
Ist ein Aneurysma bereits rupturiert und hat eine Hirnblutung ausgelöst, kann dies mittels einer Computertomografie oder Lumbalpunktion festgestellt werden.[4]
Durch den zunehmenden Einsatz von bildgebenden Verfahren sind auch Zufallsbefunde von (asymptomatischen) Aneurysmen häufiger geworden.[14]
Behandlung
Rupturierte Aneurysmen müssen sofort behandelt werden, wenn die Hirnblutung gestoppt werden soll. Bei unrupturierten Aneurysmen ist dies nicht zwingend nötig. Zwei Therapien zur Behandlung von rupturierten Aneurysmen existieren: die endovaskuläre und die neurochirurgische Therapie. Zur Behandlung von unrupturierten Aneurysmen existiert zudem die konservative Therapie.

Bei der endovaskulären Therapie werden mittels eines hohlen Mikrokatheters über die Leistenarterie sogenannte Coils (Spiralen aus einer Platinlegierung) in den Aneurysmasack gebracht.[15] Diese Coils füllen das Aneurysma zwar nur zu etwa 10 % bis 30 % aus, verursachen aber eine Thrombenbildung und verhindern so die weitere Blutzirkulation im Aneurysma und somit eine Ruptur.[16] Ein Vorteil des Eingriffes ist, dass keine offene Operation am Gehirn durchgeführt werden muss.

Bei der neurochirurgischen Therapie wird das Aneurysma nach Durchführung einer Kraniotomie (Schädeleröffnung) operativ behandelt. Der Aneurysmasack wird seit 1934 (Walter Edward Dandy)[17] mittels eines Clips abgeklemmt. Somit ist das Aneurysma vom Blutkreislauf ausgeschlossen. Durch eine Angiografie kann das erfolgreiche Clipping bestätigt werden.[18] Alternativ können auch Stents eingesetzt werden, um die Arterienwand zu verstärken oder die Flusseigenschaften zu verändern und so eine Thrombosierung zu fördern.[19]
Bei der konservativen Therapie wird kein Eingriff vorgenommen, sondern das Aneurysma wird durch regelmäßige Kontrolle mittels Angiografien beobachtet. Besonders bei kleinen nicht symptomatischen Aneurysmen ist dies aufgrund des geringen Rupturrisikos eine Option.[20]
Bei beiden Behandlungsmethoden besteht das Risiko, dass eine erneute Hirnblutung auftritt. Es besteht kein Konsens[21], ob die endovaskuläre oder neurochirurgische Therapie eine bessere Prognose hat, da die Mortalitätsrate ähnlich ist.[22][23]
Statistisch gesehen ist die Mortalitätsrate bei einer konservativen Therapie (vgl. Rupturrisiko) geringer als bei einem Eingriff. Dies ist jedoch klinisch noch nicht akzeptiert, da die überwiegende Anzahl von bekannten Aneurysmen behandelt wird. Dabei spielen auch Faktoren wie gute Patientenaufklärung und die Wahrnehmung des Aneurysmas als tickende Zeitbombe eine Rolle.[12]
Generell ist die Prognose bei einem rupturierten Aneurysma abhängig von Größe, Lokalisation und Gesundheitszustand. Die Mortalität beträgt etwa 50 %,[24] wobei 46 % der Überlebenden bleibende (Hirn-)Schäden davontragen.[25]
Literatur
- Michael Forsting, C. Cognard, M. Knaut, Isabel Wanke, A. Dörfler, M. Forsting, W. Küker, L. Pierot, L. Spelle, I. Szikora, I. Wanke: Intracranial Vascular Malformations and Aneurysms: From Diagnostic Work-Up to Endovascular Therapy. Springer, 2008, ISBN 978-3-540-32920-6, 5 Intracranial Aneurysms, S. 167–283 (google.com).
- Thomas Kretschmer (Herausgeber): Zerebrale Aneurysmen und Gefäßmalformationen: Behandlungsgrundlagen und neurochirurgische Therapie in Fallbeispielen. Springer, 2017, ISBN 978-3-662-50477-2, doi:10.1007/978-3-662-50478-9.
Weblinks
- S1-Leitlinie Unruptierte intrakranielle Aneurysmen der Deutschen Gesellschaft für Neurologie. In: AWMF online (Stand 2012)
- Risiko-Rechner unrupturierter intrakraniellen Aneurysmen (auf ISUIA und UCAS Gesuche basiert)
- Familiäre Hirnaneurysmen, Webseite des Inselspitals der Universitätsklinik Bern
- Aneurysmenbehandlung, Website des Uniklinikums Dresden
- Aneurysma: Tickende Zeitbombe, Website des Forum Gesundheit
Einzelnachweise
- ↑ a b c d e M. H. Vlak, A. Algra, R. Brandenburg, G. J. Rinkel: Prevalence of unruptured intracranial aneurysms, with emphasis on sex, age, comorbidity, country, and time period: a systematic review and meta-analysis. In: The Lancet Neurology. 10. Jahrgang, Nr. 7, Juli 2011, S. 626–636, doi:10.1016/S1474-4422(11)70109-0, PMID 21641282.
- ↑ T. Inagawa: Surgical treatment of multiple intracranial aneurysms. In: Acta neurochirurgica. 108. Jahrgang, Nr. 1–2, Januar 1991, S. 22–29, doi:10.1007/BF01407662.
- ↑ Li M, Chen S, Li Y, Chen Y, Cheng Y, Hu D, et al.: Prevalence of Unruptured Cerebral Aneurysms in Chinese Adults Aged 35 to 75 Years: A Cross-sectional Study. In: Ann Intern Med. 159. Jahrgang, Nr. 8, Oktober 2013, S. 514-21, doi:10.7326/0003-4819-159-8-201310150-00004, PMID 24126645.
- ↑ a b c d e f g Michael Forsting, C. Cognard, M. Knaut, Isabel Wanke, A. Dörfler, M. Forsting, W. Küker, L. Pierot, L. Spelle, I. Szikora, I. Wanke: Intracranial Vascular Malformations and Aneurysms: From Diagnostic Work-Up to Endovascular Therapy. Springer, 2008, ISBN 978-3-540-32920-6, 5 Intracranial Aneurysms, S. 167–283 (google.com).
- ↑ Wouter I. Schievink, S. Sharo, M. Raissi, Marcel Maya, Arlys Velebir: Screening for intracranial aneurysms in patients with bicuspid aortic valve. In: Neurology. 74. Jahrgang, Nr. 18, 4. Mai 2010, S. 1430–1433, doi:10.1212/WNL.0b013e3181dc1acf.
- ↑ M. R. Egnor, L. K. Page, C. David: Vertebral artery aneurysm – a unique hazard of head banging by heavy metal rockers. Case report. In: Pediatr Neurosurg. 17. Jahrgang, Nr. 3, 1991, S. 135–138, doi:10.1159/000120583, PMID 1819327.
- ↑ Catherine Haberland: Clinical neuropathology : text and color atlas. Demos, New York 2007, ISBN 978-1-888799-97-2, S. 70.
- ↑ Nohra Chalouhi, Brian L Loh, David Hasan: Review of Cerebral Aneurysm Formation, Growth, and Rupture. In: American Heart Association Journal. 44. Jahrgang, 25. November 2013, S. 3613–3622, doi:10.1161/STROKEAHA.113.002390.
- ↑ H Meng, V.M. Tutino, J Xiang, A Siddiqui: High WSS or Low WSS? Complex Interactions of Hemodynamics with Intracranial Aneurysm Initiation, Growth, and Rupture: Toward a Unifying Hypothesis. In: American Journal of Neuroradiology. 35. Jahrgang, Nr. 7, Juli 2014, S. 1254–1262, doi:10.3174/ajnr.A3558.
- ↑ a b A Malhotra, Wu X, Forman HP, Grossetta Nardini HK, Matouk CC, Gandhi D, Moore C, Sanelli P: Growth and Rupture Risk of Small Unruptured Intracranial Aneurysms: A Systematic Review. In: Ann. Intern. Med. 167. Jahrgang, Nr. 1, Juli 2017, S. 26–33, doi:10.7326/M17-0246, PMID 28586893.
- ↑ J. P. Greving, Wermer MJ, Brown RD Jr, Morita A, Juvela S, Yonekura M, Ishibashi T, Torner JC, Nakayama T, Rinkel GJ, Algra A: Development of the PHASES score for prediction of risk of rupture of intracranial aneurysms: a pooled analysis of six prospective cohort studies. In: Lancet Neurology. 13. Jahrgang, Nr. 1, Januar 2014, S. 59–66, doi:10.1016/S1474-4422(13)70263-1, PMID 24290159.
- ↑ a b J. Fiehler: Nicht rupturierte intrakranielle Aneurysmen: wann suchen, wann behandeln? In: RöFo - Fortschritte auf dem Gebiet der Röntgenstrahlen und der bildgebenden Verfahren. 184. Jahrgang, Nr. 2, 2012, S. 97–104, doi:10.1055/s-0031-1281984.
- ↑ PM White, JM Wardlaw, V Easton: Can noninvasive imaging accurately depict intracranial aneurysms? A systematic review. In: Radiology. 217. Jahrgang, Nr. 2, 2000, S. 361–370, doi:10.1148/radiology.217.2.r00nv06361.
- ↑ T Neumann-Haefelin: Das inzidentelle Aneurysma:Wann behandeln – wann abwarten? In: Journal für Neurologie, Neurochirurgie und Psychiatrie. 12. Jahrgang, Nr. 2, 2011, S. 148–151.
- ↑ G. Guglielmi, F. Viñuela, G. Duckwiler, J. Dion, P. Lylyk, A. Berenstein, C. Strother, V. Graves, V. Halbach, D. Nichols: Endovascular treatment of posterior circulation aneurysms by electrothrombosis using electrically detachable coils. In: Journal of neurosurgery. Band 77, Nr. 4, Oktober 1992, S. 515–524, doi:10.3171/jns.1992.77.4.0515, PMID 1527608.
- ↑ H. G. Morales, M. Kim, E. E. Vivas, M. C. Villa-Uriol, I. Larrabide, T. Sola, L. Guimaraens, A. F. Frangi: How do coil configuration and packing density influence intra-aneurysmal hemodynamics? In: AJNR. American journal of neuroradiology. Band 32, Nr. 10, November 2011, S. 1935–1941, doi:10.3174/ajnr.A2635, PMID 21885712.
- ↑ Wolfgang Seeger, Carl Ludwig Geletneky: Chirurgie des Nervensystems. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 229–262, hier: S. 242.
- ↑ R. A. Solomon, M. E. Fink, J. Pile-Spellman: Surgical management of unruptured intracranial aneurysms. In: Journal of neurosurgery. Band 80, Nr. 3, März 1994, S. 440–446, doi:10.3171/jns.1994.80.3.0440, PMID 8113856.
- ↑ J. V. Byrne, R. Beltechi, J. A. Yarnold, J. Birks, M. Kamran: Early experience in the treatment of intra-cranial aneurysms by endovascular flow diversion: a multicentre prospective study. In: PloS one. Band 5, Nr. 9, 2010, S. 440–446, doi:10.1371/journal.pone.0012492, PMID 20824070.
- ↑ M. Sonobe, T. Yamazaki, M. Yonekura, H. Kikuchi: Small unruptured intracranial aneurysm verification study: SUAVe study, Japan. In: Stroke. Band 41, Nr. 9, September 2010, S. 1969–1977, doi:10.1161/STROKEAHA.110.585059, PMID 20671254.
- ↑ P. V. Raja, J. Huang, A. V. Germanwala, P. Gailloud, K. P. Murphy, R. J. Tamargo: Microsurgical clipping and endovascular coiling of intracranial aneurysms: a critical review of the literature. In: Neurosurgery. Band 62, Nr. 6, Juni 2008, S. 1187–202; discussion 1202–3, doi:10.1227/01.neu.0000333291.67362.0b, PMID 18824986.
- ↑ A. Molyneux, R. Kerr, L. Yu, M. Clarke, M. Sneade, J. Yarnold, P. Sandercock, and Others. International subarachnoid aneurysm trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomised comparison of effects on survival, dependency, seizures, rebleeding, subgroups. The Lancet, 366(9488):809–817, 2005.
- ↑ Hirn-Aneurysmen: Bei Blutung Clipping oder Coiling? Abgerufen am 26. Juli 2019.
- ↑ J. van Gijn, R. S. Kerr, and G. J. E. Rinkel. Subarachnoid haemorrhage. Lancet, 369(9558):306–18, Januar 2007.
- ↑ J. I. Suarez, R. W. Tarr, and W. R. Selman. Aneurysmal subarachnoid hemorrhage. The New England journal of medicine, 354(4):387–96, Januar 2006.
Auf dieser Seite verwendete Medien
Autor/Urheber: Original uploaded by Uwe Thormann (Transfered by hellerhoff), Lizenz: CC BY-SA 3.0
Hirngefäßaneurysma, Zustand nach clipping, offener OP-Befund Bild wurde freundlicherweise von Herrn Prof. G. Penkert, Hannover zur Verfügung gestellt und für die GNU-FDL freigegeben.
Autor/Urheber: Lucien Monfils, Lizenz: CC BY-SA 3.0
Angiograph of an aneurysm in a cerebral artery.
Autor/Urheber:
Shazia Mirza and Sankalp Gokhale
See also source article for additional image creators., Lizenz: CC BY 4.0
Volume rendered CT angiography of posterior communicating artery aneurysm.png. For context, see Wikipedia:Imaging in stroke.
Autor/Urheber: Rogerio Cisi, Lizenz: CC BY-SA 4.0
Embolizacao deAneurisma Cerebral
Diagram of cerebral aneurysm