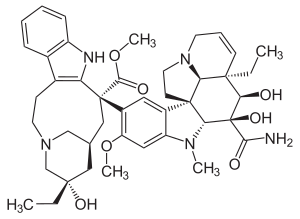
Vindesin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Vindesin | |||||||||||||||||||||
| Andere Namen | 3-Carbamoyl-4-O-deacetyl-3-de(methoxycarbonyl)-vincaleukoblastin | |||||||||||||||||||||
| Summenformel | C43H55N5O7 (Base) | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | L01CA03 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | Mitose-Hemmer | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 753,936 g·mol−1 (Base) | |||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | 6,04 (Base)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Vindesin ist ein Arzneistoff, der sich vom Vinblastin, einem Alkaloid aus der Pflanze Rosafarbene Catharanthe (Catharanthus roseus, frühere Bezeichnung Vinca rosea), ableitet. Es ist eine weißliche amorphe Substanz und wird als Chemotherapeutikum zur Behandlung von Krebserkrankungen eingesetzt. Vindesin ist ein Zytostatikum aus der Gruppe der Mitose-Hemmer.
Wirkungsmechanismus
Vindesin hemmt die Mikrotubuli (Spindelapparat), welche bei der Replikation von Chromosomen (und DNA) notwendig sind. Die Mikrotubuli ziehen vereinfacht gesprochen die replizierten (verdoppelten) Chromosomen (und somit die DNA) auseinander. Dies hat den Zweck, dass bei einer anstehenden Zellteilung jede Tochterzelle einen vollständigen Chromosomensatz erhält.
Metabolisierung
Vindesin folgt in seiner Verstoffwechselung und Ausscheidung einem 3-Kompartiment-Modell (oder 3-Phasen-Modell). Die Halbwertzeit in der ersten (alpha) Phase nach Gabe ist 3 Minuten, in der zweiten (beta) Phase 0,8–1,7 Stunden und in der dritten und letzten (gamma) Phase 20–24 Stunden. Das relative Verteilungsvolumen beträgt 8,11 l/kg Körpergewicht, das absolute 58–600 l. Vindesin überwindet nicht eine intakte Blut-Hirn-Schranke und ist daher nicht im Liquor nachweisbar.
Wechselwirkungen
- Mitomycin C: Wird Vindesin Patienten mit zeitnaher oder gleichzeitiger Gabe von Mitomycin C verabreicht, kann es zu einem akuten Bronchospasmus mit akuter Dyspnoe kommen, dessen Ursache nicht bekannt ist.
- Phenytoin: Vindesin senkt den Serumspiegel von Phenytoin ab, wodurch dessen Wirkung herabgesetzt wird und so neue oder vermehrte (epileptischen) Krampfanfälle auftreten können. Diese Wechselwirkung wird wahrscheinlich durch eine verminderte Resorption (Aufnahme) von Phenytoin aus dem Magen-Darm-Trakt verursacht. Eine alternative Erklärung ist die gesteigerte Verstoffwechselung (Metabolismus) von Phenytoin. Die exakte Ursache der Wechselwirkung ist nicht bekannt. Als Gegenmaßnahme ist eine sorgfältige Überwachung des Phenytoin-Serumspiegels und eine Dosisanpassung (Erhöhung) von Phenytoins erforderlich.
Anwendungsgebiete
Vindesin wird als Zytostatikum zur Behandlung von Krebserkrankungen eingesetzt. Es findet keine Verwendung als Immunsuppressivum.
Erwachsene
- Akute lymphoblastische Leukämie (ALL).
Kinder und Jugendliche
Bei Kindern und Jugendlichen wird Vindesin eingesetzt bei:
- Neuroblastom (NB): Der Einsatz von Vindesin erfolgt im Rahmen einer Kombinationschemotherapie zur Behandlung der Erstmanifestation eines Neuroblastoms.
- Akute lymphoblastische Leukämie: Der Einsatz erfolgt im Rahmen einer Kombinationschemotherapie zur Behandlung des Rezidivs einer akuten lymphoblastischen Leukämie.
Anwendung in der Tiermedizin
Vereinzelt wurde der Einsatz von Vindesin in Kombination mit Cisplatin bei Hunden mit primären Lungentumoren beschrieben; eine Antitumoraktivität konnte verzeichnet werden.[4]
Verabreichung
Vindesin wird intravenös als Infusion verabreicht, kann aber auch als Bolus-Injektion erfolgen.
Aufgrund der Giftwirkung von Vindesin im Falle eines Paravasates empfiehlt sich als Applikationsort eine Vene, die in ihrer Umgebung keine Gelenke aufweist, welche im Rahmen eines Vindesin-Paravasates geschädigt werden können.
Die intrathekale Vindesin-Gabe ist in den meisten Fällen tödlich.
Nebenwirkungen
Übelkeit, Erbrechen, Obstipation (Verstopfung), paralytischer Ileus (lähmungsbedingter Darmverschluss), Neuropathie (Nervenschädigung).
Bauchschmerzen durch Störungen der Darmbeweglichkeit werden durch die giftige Wirkung von Vindesin auf das autonome Nervensystem, das für die Steuerung der Darmbewegung verantwortlich ist, verursacht. Diese Bauchschmerzen können heftig und zumeist krampfartig auftreten. Als Gegenmaßnahmen empfehlen sich die Darmtätigkeit anregende Maßnahmen (insbesondere bei gleichzeitiger Verstopfung zur Verhinderung eines Ileus) sowie die Gabe von Butylscopolamin.
Leukopenie mit Neutropenie und Thrombopenie werden durch die hemmende Wirkung von Vindesin auf die sich schnell teilenden Zellen des Knochenmarks im Rahmen der Blutbildung verursacht. Vindesin blockiert aufgrund seines Wirkungsmechanismus die Zellteilung von Leukozyten und Thrombozyten (und deren Vorläufer-Zellen). Dies verursacht einen gegenüber dem Zeitpunkt der Gabe verzögerten Abfall der Zellzahlen von Thrombozyten (Thrombopenie) und Leukozyten (Leukopenie) im peripheren Blut. Der Nadir (Tiefpunkt) tritt 3 bis 6 Tage nach Gabe auf. Die Erholung findet zwischen 7 und 10 Tagen nach Gabe statt.
Aufgrund der giftigen und reizenden Wirkung von Vindesin kann es zu Reizungen und Entzündungen der Vene (Phlebitis) kommen, über die Vindesin als Infusion oder Injektion verabreicht wird. Die Nebenwirkung ist bei der Injektion als Bolus seltener als bei der Gabe in Form einer Infusion. Zusätzlich tritt diese Nebenwirkung sehr selten auf, wenn ein zentraler Venenkatheter verwendet wird; sie ist häufiger, wenn die Vene klein ist und peripher am Körper vorzufinden ist (beispielsweise Handrücken).
Gegenanzeigen
Vindesin darf nicht angewendet werden beim Vorliegen von erheblicher Granulozytopenie oder Thrombozytopenie, schweren bakteriellen Infektionen, neuraler Muskelatrophie mit segmentaler Entmarkung (demyelinisierende Form des Morbus Charcot-Marie-Tooth) sowie Überempfindlichkeit gegenüber Vindesin.[5]
Anwendungsbeschränkungen
Vindesin kann erbgutschädigend und fruchtschädigend wirken. Vindesin sollte daher möglichst nicht in der Schwangerschaft angewendet werden. Frauen dürfen während einer Behandlung und bis sechs Monate danach nicht schwanger werden, Männer sollten während einer Behandlung mit Vindesin und bis sechs Monate danach kein Kind zeugen. Während einer Behandlung dürfen Frauen nicht stillen. Wegen der immunsuppressiven Wirkung von Vindesin ist mit einem verminderten Ansprechen auf Impfstoffe (Vakzine) zu rechnen. Bei Lebendimpfstoff besteht die Gefahr einer Impfschädigung.[5]
Handelsnamen
Vindesinhaltige Arzneimittel sind in Deutschland, Österreich und der Schweiz unter dem Namen Eldisine (STADA Arzneimittel) im Handel erhältlich.
Weblinks
- British Columbia Cancer Agency: Vindesin (PDF; 136 kB) Umfassende, klinisch orientierte Monographie zur Vindesin. März 2008, frei zugänglich.
Einzelnachweise
- ↑ Eintrag zu Vindesin in der DrugBank der University of Alberta
- ↑ Eintrag zu Vindesine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b Datenblatt Vindesine sulfate salt hydrate, ≥95% (HPLC) bei Sigma-Aldrich, abgerufen am 31. Oktober 2016 (PDF).
- ↑ Robert Warren Kirk: Kirk's Current Veterinary Therapy. W.B. Saunders, 1995, Kap. 77, S. 354.
- ↑ a b Fachinformation Eldisine, Stand Mai 2015.
Auf dieser Seite verwendete Medien
Struktur von Vindesin
