Verbrennung (Chemie)

Eine Verbrennung ist eine exotherme Redoxreaktion, bei der ein brennbarer Brennstoff oxidiert wird. Meist wird hierbei das Oxidationsmittel Sauerstoff bei der Verbrennung reduziert, dieser Vorgang erniedrigt durch Aufnahme von Elektronen und Bildung von Oxiden seinen Oxidationszustand. Ein Bestandteil des Brennstoffs bildet bei der Verbrennung das Reduktionsmittel und erhöht durch Bildung von Oxiden seinen Oxidationszustand. Beispiel:
- Die vollständige Verbrennung von Methan erfolgt nach folgender Reaktionsformel:
Bei den Reaktionsschritten wird Energie freigesetzt, die zum Teil als Strahlung (Flammenbildung) und Wärme abgeführt wird.
Im Gegensatz zur Explosion wird die kontrollierte exotherme Oxidation eines Brennstoffes als Verbrennung bezeichnet. Eine Explosion ist gekennzeichnet durch eine schnelle Reaktion größerer Brennstoffmengen. In geschlossenen Räumen können durch den kurzzeitig auftretenden Temperaturanstieg erhebliche Explosionsdrücke auftreten, die zerstörerische Auswirkungen haben können; siehe auch Deflagration und Detonation.
Bei Substanzen, die der menschliche Körper als Energiequelle d. h. als Brennstoff benutzt, wie z. B. Glucose oder Fette, finden in den Körperzellen schrittweise und langsam verlaufende Oxidationsreaktionen mit Sauerstoff als Oxidationsmittel statt, die einer Verbrennung ähnlich sind. Diese Reaktionen verlaufen bei passend niedriger Körpertemperatur und könnten als Kalte Verbrennungen bezeichnet werden. Wegen ihrer großen physiologischen Bedeutung haben diese Reaktionen aber die spezielle Bezeichnung katabolische Stoffwechselreaktionen. Aus chemischer Sicht handelt es sich bei diesen Reaktionen ebenfalls um Redoxreaktionen.[1][2]
Begriffe, Einteilung
Chemie der Verbrennung
Die Flamme emittiert elektromagnetische Strahlung aus dem ultravioletten, sichtbaren und infraroten Strahlungsbereich. Es ist zu unterscheiden zwischen der Festkörperstrahlung und der Strahlung gasförmiger Moleküle. Als Festkörper ist der Festbrennstoff oder gebildeter Ruß (z. B. Feinstaub bei der Heizölverbrennung) zu betrachten. Der Festkörper emittiert Strahlung über dem gesamten Spektralbereich. Dieses Spektrum entspricht näherungsweise dem eines schwarzen Strahlers. Den gasförmigen Molekülen und Atomen werden durch die exotherme Reaktion der Verbrennung Energie zugeführt, und es werden durch Stoßprozesse höhere Energieniveaus der Teilchen eingenommen. Wenn das Elektron wieder einen energetisch tiefer liegenden Zustand einnimmt, wird die Energiedifferenz als Strahlung emittiert und ein Photon ausgesandt. Diese Leuchterscheinung bildet die Flamme. Bei Molekülen werden Vibrations- und Molekülbanden besetzt; bei Atomen wird ein Linienspektrum emittiert. Diese Gasstrahlung ist selektiv und abhängig von den Bestandteilen des Brenngases. Das besteht aus einer Vielzahl von Radikalen, die teilweise auch nur als Zwischenprodukt bis zur vollständigen Verbrennung existieren. Im Gegensatz zur Festkörperstrahlung ist die emittierte Gasstrahlung nicht gleichmäßig über das Spektrum verteilt. Das Spektrum einer Flamme ist abhängig von der Teilchenzusammensetzung in der Flamme. So ist die Strahlung einer Wasserstoffflamme insbesondere im sichtbaren Bereich sehr schwach, da die Radikalen (H2, OH−, H, H+) im sichtbaren Wellenlängenbereich kaum elektronische Übergänge besitzen.
Langsame „kalte Oxidation“ lässt sich beim Verrosten von Metallen oder in Lebewesen bei der Oxidation von Nährstoffen, also deren „Verbrennung“ feststellen.
Technische Verbrennungsprozesse
Technische Verbrennungsprozesse werden für Heizzwecke, Stromerzeugung, Stofftrennung (Schmelzen) und Metallurgie eingesetzt. Zur Optimierung einer Verbrennung wird angestrebt, den Wirkungsgrad der Verbrennung zu erhöhen und die Bildung von Schadstoffen zu reduzieren. Die Emission von Kohlenstoffdioxid aus Verbrennungsprozessen in die Atmosphäre ist die Hauptursache der globalen Erwärmung. Im Rahmen der [Dekarbonisierung] wird angestrebt, den Kohlenstoffanteils im Brennstoff zu verringern. Dies kann durch Verwendung von Brennstoffen erfolgen, die weniger Kohlenstoff (Erdgas statt Kohle) oder keinen Kohlenstoff enthalten (Wasserstoff).
Der Verbrennungsprozess wird die Brennstoff- und Luftzuführung so geregelt, dass eine kontrollierte chemische Reaktion in einem definierten Brennraum stattfindet. Zur Anlagensicherheit muss gewährleistet sein, dass sich der gasförmige oder flüssige Brennstoff nach dem Einströmen in den Brennraum sicher entzündet und vollständig ausbrennt. Andernfalls ist die Bildung eines größeren explosionsfähigen Gasvolumens möglich, das bei einer Durchzündung einen schnellen Druckanstieg auslösen kann und eine Explosion zur Folge hat.
Der maximale Explosionsdruck von Kohlen- und Wasserstoffhaltigen Brennstoffen in geschlossenen Räumen mit ursprünglichem Umgebungsdruck (Volumendeflagration) beträgt 10 bar; die Flammengeschwindigkeit liegt im Bereich von 0,5 m/s (Kohlenwasserstoffe) bis 2,5 m/s (Wasserstoff).[3] Explosionen mit geringem Druckanstieg (atmosphärische Deflagration) werden als Verpuffung bezeichnet.
In der Technik wird für die Wärmeerzeugung eine geregelte Verbrennung genutzt, die gleitend an den Wärmebedarf angepasst wird. Als Führungsgröße wird z. B. die Temperatur eines Wärmeträgers oder der Dampfdruck einer siedenden Flüssigkeit genutzt und der Massenstrom des Brennstoffes und der Verbrennungsluft wird dem Wärmebedarf angepasst.
Bei industriellen technischen Prozessen, bei denen exotherme Reaktionen zur Stoffumwandlung eingesetzt werden (Thermoprozessanlagen) fällt Abwärme an. Es wird angestrebt, die Wärme möglichst wirtschaftlich zu nutzen. Diese Abwärme wird z. B. zur internen betrieblichen Nutzung, zur Stromerzeugung (über einer Abhitzedampferzeuger und Turbine) oder zur Fernwärmeeinkopplung genutzt. Nicht nutzbare Wärme muss z. B. über Kühltürme an die Umgebung abgegeben werden.
Offene Freistrahlflamme
Bei der offenen Freistrahlflamme wird Brennstoff aus einer Düse in die Atmosphäre geleitet und gezündet. Von der Zündstelle wandert die Flammenfront in Richtung der Austrittsdüse und hier stabilisiert sich die Flamme. In einem Bunsenbrenner kann bei Luftzuführung in das Brennerrohr eine heiße Vormischflamme eingestellt werden. Durch Schließen der Luftzuführung wird die Flamme diffuser und die Flammentemperatur ist geringer (Diffusionsflamme). Es erfolgt eine Mischung des Brennstoffes mit der Luft durch laminare und turbulente Diffusionsvorgänge. Dieser Flammentyp wird als Diffusionsflamme bezeichnet. In der Regel sind die chemischen Kettenreaktionen sehr viel schneller als die Diffusionsprozesse. Somit bestimmt die Diffusion die Dynamik der Verbrennung.[4]
Brennraum
Hinsichtlich der Verbrennungsführung kann zwischen einer offenen Verbrennung und der Verbrennung in einem Brennraum unterschieden werden.
- Offene Verbrennungen werden z. B. für Beleuchtungszwecke (Kerze) verwendet oder zum Erhitzen oder Warmhalten von Stoffen (Rinnenbrenner über Metallschmelze, Füssiggashandbrenner zum Erwärmen von Schweißbahnen) oder als Strahlungsflächenheizung (Katalytische Verbrennung) oder offenen Kamin. Die Verbrennungsluft kann über die Thermik der Verbrennung oder gezielt über Verbrennungsluftgebläse zugeführt werden.
- Bei Gasschweißverfahren wird zumeist dem Brenngas reiner Sauerstoff zugeführt, um eine hohe Verbrennungstemperatur zu erzielen.
- Ein Brennraum wird verwendet, wenn die Wärme indirekt über einen Wärmeträger (Dampf, Heißwasser, Thermoöl, Luft) genutzt wird oder die Abgase nicht in den umgebenden Raum gelangen sollen (Heizofen). Brennstoff und Luft werden gezielt zugeführt. Die Wärmeleistung kann über die Regelung der Verbrennungsluft und bei Gas, Öl- und Staubfeuerungen zusätzlich über den Brennstoffmassenstrom geregelt werden. Die Abgase werden gerichtet über einen Kamin abgeleitet.
Schadfeuer (Brand)
Abgesehen von Explosivstoffen oder pyrophoren Stoffen sind die verwendeten natürlichen und künstlichen Stoffe und Materialien bei Umgebungstemperaturen nicht brennbar, da die thermische Energie nicht ausreicht, stabile Reaktionsketten für eine Oxidation aufrechtzuerhalten. Durch Abweichung der bestimmungsgemäßen Verwendung oder technische Fehler können Zündquellen entstehen, die brennbare Stoffe entzünden können. Dies sind z. B. elektrische Mängel (Kurzschluss, thermische Überlastung, elektrische Entladungen/ Lichtbögen), Reibungsvorgänge, hohe Strahlungsstärken, chemische Reaktionen, Blitzeinschläge.
Brandlehre, Brandklassen
Brennstoffcharakterisierung
Brennstoffe bestehen im Wesentlichen aus den Elementen Kohlenstoff (C), Wasserstoff (H) und Schwefel (S). In den Brennstoffen sind oft noch nicht brennbare Bestandteile enthalten wie Stickstoff (N), Sauerstoff (O), Wasser (H2O) oder anorganische Stoffe, die teilweise als Asche nach dem Verbrennungsprozess anfallen. Der hygroskopisch oder chemisch gebundene Wasseranteil muss bei der Verbrennung verdampft werden und erhöht den Abgasmassenstrom. Soweit der Wasseranteil im Abgas nicht kondensiert wird, wird durch das Wasser der Wirkungsgrad der Verbrennung gemindert.
Brennstoffe können in den Aggregatzuständen fest, flüssig oder gasförmig vorliegen. Zur Charakterisierung von Fest- und Flüssigbrennstoffen wird zumeist eine Elementaranalyse der atomaren Bestandteile verwendet. Bei gasförmigen Brennstoffen verwendet man zumeist den Molanteil der Gaskomponenten, um den Verbrennungsprozess rechnerisch zu erfassen.
Feste Brennstoffe
Zu den festen Brennstoffen gehören Kohle, Holz, Torf, Stroh und Müll. Je nach der Stückigkeit können feste Brennstoffe auf Rosten, in Wirbelschichten oder staubförmig verbrannt werden. Je kleiner die Korngröße umso schneller verläuft die Verbrennungsreaktion. Die Rostfeuerung verläuft in verschiedenen Schritten: Verdampfen des Wasseranteils, Freisetzen flüchtiger brennbarer Komponenten und dem Ausbrand. Trockene feste Brennstoffe entzünden sich bei Temperaturen oberhalb von 200 °C.
Flüssige Brennstoffe
Die Kohlenwasserstoffe mit längeren Molekülketten und Alkohole liegen bei Normalbedingungen als Flüssigkeit vor und werden als Brennstoffe verwendet. Höher viskose Kohlenwasserstoffe müssen erwärmt werden, um die Stoffe pumpfähig zu nutzen (schweres Heizöl). Flüssige Brennstoffe werden vor der Verbrennung zerstäubt, um mit einer kleinen Tröpfchengröße eine hohe Oberfläche und somit eine schnelle Oxidation zu erreichen. Die Zerstäubung kann als Druckzerstäubung oder Zerstäubung mit einem Hilfsmedium (Wasserdampf, Druckluft) erfolgen. Die Verbrennungsluft wird mit einem Luftgebläse der Verbrennungszone zugeführt.
Gasförmige Brennstoffe
Als gasförmige Brennstoffe werden Kohlenwasserstoffe mit kürzeren Molekülketten, Wasserstoff oder Kohlenmonoxid verwendet. Die Luftzuführung kann ungeregelt oder durch Einsatz eines Verbrennungsluftgebläses erfolgen.
Voraussetzungen für eine Verbrennung

Für eine Verbrennung ist in ausreichender Menge brennbares Material nötig, das mit dem Oxidationsmittel reagiert, meist ist dies der Sauerstoff (siehe Sauerstoffindex). Darüber hinaus ist das richtige Mengenverhältnis des brennbaren Stoffes mit der Umgebungsluft oder dem reaktiven Gas und eine geeignete Zündquelle nötig. Ein Katalysator kann die Aktivierungsenergie, die für den Start der chemischen Reaktion erforderlich ist, herabsetzen. Dadurch kann die Verbrennung beschleunigt oder die zur Zündung notwendige Energie herabgesetzt werden.
Verbrennungsvorgang
Zünden
Zur Einleitung eines Verbrennungsvorgangs muss der Brennstoff in der sauerstoffhaltigen Atmosphäre entzündet werden Die Aktivierungsenergie ist notwendig, um die Kettenreaktionen einzuleiten. Bei Feststofffeuerungen wird leicht entzündliches Material mit großer Oberfläche verwendet, um den Festbrennstoff auf die Zündtemperatur zu erwärmen. Technische Feuerungen für gasförmige und flüssige Brennstoffe in Brennkammern werden mit reduziertem Brennstoffmengenstrom gezündet, um einen größeren Druckimpuls zu vermeiden. Die Zeit zwischen dem Öffnen der Brennstoffventile und der Ausbildung der Flamme ist in der Brennersteuerung begrenzt. Bei längerzeitigen unkontrolliertem Ausströmen kann sich das Brennstoff-Luft-Gemisch explosionsartig entzünden und die Brennkammer zerstören. Für die Überwachung der Flammenausbildung werden Flammenwächter eingesetzt, die den Ionisationsstrom in der Flamme oder die Strahlung der Flamme mit einer Fotozelle überwachen.
Verbrennungsvorgang und Schadstoffbildung
Nach dem Zünden halten die Kettenreaktionen den Verbrennungsprozess aufrecht, solange ein ausreichender Sauerstoffgehalt in der Verbrennungsatmosphäre vorhanden ist. Bei einer Feuerung zur Wärmeerzeugung wird ein Luftüberschuss eingestellt, um einerseits die Verbrennungsenthalpie des Brennstoffes für die Wärmeübertragung auszunutzen und den Abgasvolumenstrom zu begrenzen. Ein höherer Abgasvolumenstrom erhöht den Wärmeverlust, da die Abgastemperatur über der Umgebungstemperatur liegt. Die Einstellung des Luftüberschusses bzw. Luftzahl ist ein Kompromiss zwischen möglichst hohem Wirkungsgrad und vollständigem Ausbrand. Bei der vollständigen Verbrennung von Kohlenwasserstoffen entstehen Wasser und Kohlendioxid als Abgas. Daneben entstehen die Schadstoffe Ruß, Kohlenmonoxid CO und Stickoxide NOx. Zur Beschränkung der Emissionen von Kohlenstoff und Kohlenmonoxid wird der Brennstoff extensiv mit der Verbrennungsluft vermischt. Thermische Stickoxide werden durch die Reaktion von molekularem Stickstoff mit atomarem Sauerstoff gebildet. Da Sauerstoff erst bei Temperaturen oberhalb von 1300 °C bis 1600 °C in größerem Umfang dissoziiert, kann durch eine Aufspaltung der Luftaufgabe (Primär-, Sekundärluft) der Ausbrand über eine längere Zone gestreckt werden und die Flammentemperatur gesenkt werden. Als weitere technische Maßnahme wird die Abgasrezirkulation angewandt, in dem das Abgas wieder in die Flamme zurückgeleitet wird und somit die Flammentemperatur reduziert wird. Heizöle und in größerem Umfang Kohlesorten enthalten chemisch gebundenen Stickstoff. Dieser Stickstoff zerfällt in der Pyrolysephase zu Aminen und Cyaniden und reagiert anschließend mit Sauerstoffträgern zu NOx.[5]
Insbesondere können sich bei Feststofffeuerungen flüchtige organische Verbindungen wie polyzyklische aromatische Kohlenwasserstoffe (PAK), Dioxine und Furane bilden.[6] Um die Bildung dieser PAK zu minimieren, muss in der Verbrennungszone eine Mindesttemperatur (ca. 850 °C) und eine Mindestverweilzeit (ca. 2 s) eingehalten werden.
Chemie der Verbrennung
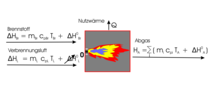
Die Enthalpiebilanz der Verbrennung wird aus folgenden Größen berechnet:
- Masse m ,
- Wärmekapazität cp; die Wärmekapazitäten der Abgaskomponenten müssen ggf. iterativ bestimmt werden,
- Standardbildungsenthalpien H 0f; die Standardbildungsenthalpien von H2, O2 und N2 ist definitionsgemäß „0“;
- nutzbare Wärme Q, die aus der Verbrennung durch einen Wärmeträger ausgekoppelt wird.
Die stoffspezifischen Größen werden bei gasförmigen Brennstoffen zumeist auf die Molzahl bezogen. Bei flüssigen und festen Brennstoffen werden die spezifischen auf die Masse bezogenen Größen verwendet.
Die adiabate Flammentemperatur ist eine Größe, die sich auf das heiße Reaktionsgas ohne Wärmeauskopplung und Vernachlässigung der Kühlung durch die Strahlung der Flamme bezieht. Durch Sauerstoffanreicherung der Verbrennungsluft kann die adiabate Flammentemperatur deutlich gesteigert werden, da das Abgas weniger inerten Stickstoff enthält.
Luftzahl
Für die Verbrennung an Luft wird die sogenannte Luftzahl benötigt. Diese ist ein Verhältniswert aus den Anteilen der Umgebungsluft, also Sauerstoff zu Stickstoff und Argon:
Sauerstoffbedarf
Bezogen auf 1 mol Brennstoff erhält man den zur vollständigen Verbrennung erforderlichen Anteil Sauerstoff über:
Löst man obige Gleichung nach auf, so erhält man:
beziehungsweise
- , wobei die Kleinbuchstaben die Anzahl der im Brandstoff enthaltenen Elemente angeben.
Stöchiometrische Konzentrationen
Die für die vollständige Verbrennung rechnerisch nötige Konzentration von Brennstoff erhält man über
beziehungsweise
Beispiel
Als Beispiel sei hier die vollständige Verbrennung von 1-Propanol (, Molmasse 60,1 g·mol−1) genannt:
Somit sind zur vollständigen Verbrennung von 1 mol Propanol 4,5 mol Sauerstoff nötig. Weiterhin lässt sich die stöchiometrische Konzentration, die für die Verbrennung nötig ist, berechnen:
beziehungsweise
Verbrennungsrechnung und Abgaszusammensetzung
Verbrennungsrechnungen mit den entsprechenden Abgaszusammensetzungen sind mit einem Rechenalgorithmus nach Werner Boie für den Anwendungsbereich Wärmetechnik besonders effizient möglich.[7]
Physik der Verbrennung
Beim brennbaren Material kann es nur zur Oxidation kommen, wenn ein einzelnes Atom oder Molekül des Brennstoffs mit Sauerstoff in direkten Kontakt kommt. Daher sind für die Verbrennungsgeschwindigkeit (Abbrandgeschwindigkeit) die Verfügbarkeit von Sauerstoff und sein inniger Kontakt mit dem Brennmaterial maßgeblich. Einige Löschverfahren beruhen darauf, die Sauerstoffzufuhr zu unterbrechen (Löschdecke, Schaum, CO2-Löschanlage).
Die Versorgung mit Sauerstoff kann man durch stete Zufuhr von Frischluft erreichen. In einem sich verengenden Kamin steigen die erwärmten Abgase schnell auf und erzeugen einen steten Unterdruck um das Feuer. Dieser saugt permanent frische Luft heran. Eine extreme Ausprägung sind Feuersturm und Waldbrände, die durch Winde, wie den Mistral, angefacht werden.
Um innigen Kontakt herzustellen, kann die Oberfläche des Brennstoffs vergrößert werden, das Vergasen des Brennstoffs in ein Gas ist eine geeignete Möglichkeit. Bei der Kerze schmilzt das Wachs am Boden des Dochts, steigt als Flüssigkeit auf und verdampft an der heißen Spitze. Das verdampfte Wachs verbrennt. Ein anschauliches Beispiel ist die Mehlstaubexplosion. Wird etwas Mehl in eine Kerzenflamme geblasen, wird das ansonsten unbrennbare Mehl durch die Zerstäubung brennbar und reagiert heftig. Beim Ottomotor erfolgt im Vergaser eine Verdampfung und im Dieselmotor wird der Brennstoff zerstäubt. Flüssiger Dieselkraftstoff lässt sich bei Raumtemperatur kaum entflammen. Durch die schnelle Verdichtung mit der daraus resultierenden Erhitzung der Luft im Verbrennungsraum auf etwa 800 °C zündet der eingespritzte Diesel selbst und verbrennt.
Über Flüssigkeiten entsteht in Abhängigkeit von der Stoffeigenschaft spezifischer Dampfdruck und den Umgebungsfaktoren Druck und Temperatur eine Dampfwolke. Handelt es sich um eine brennbare Flüssigkeit, so ist diese Dampfschicht in einem bestimmten Bereich (zwischen unterer und oberer Explosionsgrenze) entzündlich. Die kurzkettigen Kohlenwasserstoffe, das Benzin, haben einen hohen spezifischen Dampfdruck, sind leicht flüchtig, bilden also schon bei niedrigen Temperaturen eine brennbare Dampfschicht über der Oberfläche aus. Der längerkettige Diesel zündet schwerer, da der Dampfdruck geringer ist.
In einigen chemischen Verbindungen sind das „Oxidationsmittel“ (Sauerstoff) und das zu oxidierende „Material“ in demselben Molekül enthalten, so in vielen Sprengstoffen. Nitroglyzerin mit der Summenformel C3H5N3O9 enthält pro Molekül neun Sauerstoffatome (in drei Nitrat- und Salpetersäureester-Gruppen) und damit mehr als genug, um die im Molekül enthaltenen Kohlen- und Wasserstoffatome vollständig zu Kohlendioxid und Wasser zu oxidieren. Die Verbindung ist instabil und zerfällt explosionsartig schon bei leichten Erschütterungen. Die gasförmigen Oxidationsprodukte nehmen ein Vielfaches des ursprünglichen Volumens ein und erzeugen einen sehr hohen Druck, der die Sprengwirkung verursacht. Auch in den Treibmitteln von Raketentriebwerken ist Sauerstoff in verschiedenen Trägersubstanzen als Oxidationsmittel vorhanden, da dies im Vakuum des Weltalls erforderlich ist.
Materialkunde
Die Verbrennung von Holz beginnt meist mit einer Erhitzung von außen. Bei feuchtem oder nassem Holz unterbricht die Temperaturerhöhung bei etwa 100 °C die weitere Erhitzung des Holzes vor Erreichen der Zündtemperatur. Ist das Wasser weitestgehend verdampft, steigt die Temperatur und die Verbrennung der entweichenden Gase beginnt. Holz kann – abhängig von der Holzart – ungefähr das eigene Gewicht an Wasser speichern, und für den Verdampfungsvorgang ist zusätzliche Wärme nötig; so ist feuchtes oder nasses Holz kaum zu entzünden. Trockenes Holz zündet leichter und beginnt ab etwa 150 °C zu verkohlen. Dies ist eine Pyrolyse des Holzes durch hitzebedingte chemische Zersetzung. Es entstehen gasförmige Stoffe, die sich nach der Vermischung mit Luft entzünden. Die verbleibende Holzkohle besteht aus dem entgasten Holz und besteht im wesentlich aus Kohlenstoff, der zuletzt abbrennt.
Siehe auch
Literatur
- J. Warnatz, U. Maas, R. W. Dibble: Verbrennung. Springer, Berlin 2001, ISBN 3-540-42128-9.
- Rodewald: Brandlehre. 6. Auflage, W. Kohlhammer, Stuttgart 2007, ISBN 978-3-17-019129-7.
- M. Lackner, F. Winter, A. K. Agarwal: Handbook of Combustion. Wiley-VCH, Weinheim 2010, ISBN 978-3-527-32449-1.
- Drysdale: An Introduction to Fire Dynamics. Second Edition, John Wiley & Sons, Ltd, The Atrium, Southern Gate, Chichester West Sussex 1998, ISBN 978-0-471-97291-4.
Weblinks
Einzelnachweise
- ↑ Theodore L. Brown, H. Eugene LeMay, Bruce E. Bursten: Chemie. Die zentrale Wissenschaft. Pearson Studium, 2007, ISBN 978-3-8273-7191-1, S. 103 f.
- ↑ Von Elementarreaktionen zum technischen Verbrennungssystem. In: www.itt.kit.edu. Karlsruher Institut für Technologie, abgerufen am 17. Dezember 2024.
- ↑ Institut für Strömungstechnik und Thermodynamik (ISUT) der Universität Magdeburg: Verbrennung gasförmiger Brennstoffe. Vorlesungsskript ( vom 18. Dezember 2018 im Internet Archive)
- ↑ RWTH Aaceh, Institut für Technische Verbrennung, Univ.-Prof. Dr.-Ing. Dr. h.c. Dr.-Ing. E.h. N. Peters, Technische Verbrennung I
- ↑ Fritz Mayr, Kesselbetriebstechnik, Verlag Dr. Ingo Resch, 10. Auflage 2003, ISBN 3-930039-13-3
- ↑ Umweltbundesamt, Integrierte Vermeidung und Verminderung der Umweltverschmutzung (IVU), Merkblatt über beste verfügbare Techniken für Großfeuerungsanlagen, Juli 2006
- ↑ Bernd Glück: Zustands- und Stoffwerte, Verbrennungsrechnung. 2., überarbeitete und erweiterte Auflage, Verlag für Bauwesen, Berlin 1991, ISBN 3-345-00487-9, online auf BerndGlueck.de, abgerufen am 22. Dezember 2016.
Auf dieser Seite verwendete Medien
Autor/Urheber: Petrovskyz, Lizenz: CC BY-SA 4.0
An experiment that demonstrates the large amount of energy released upon combustion of ethanol. A mixture of alcohol (in this case, ethanol) vapour and air in a large plastic bottle with a small neck is ignited, resulting in a large blue flame and a 'whoosh' sound. This is an example of exothermic reaction and demonstrates the large amount of energy released in the combustion of alcohols. The reaction of burning of ethanol is represented by the following chemical equation:
- C2H5OH(g) + 3O2(g) = 2CO2(g) + 3H2O(g).
Planned and performed by Marina Stojanovska, Miha Bukleski and Vladimir Petruševski, Department of Chemistry, FNSM, Ss. Cyril and Methodius University, Skopje, Macedonia.
There are no spoken or printed words in this video, so it can be used in any language.Autor/Urheber: Rasi57, Lizenz: CC BY-SA 4.0
Enthalpiebilanz des Verbrennungsvorgangs




