Vanadium(V)-oxid
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| _ V5+ _ O2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Vanadium(V)-oxid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | V2O5 | ||||||||||||||||||
| Kurzbeschreibung | gelber bis rotbrauner, geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 181,88 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest[1] | ||||||||||||||||||
| Dichte | 3,36 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | 1750 °C (Zersetzung)[1] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | Schweiz: 0,05 mg·m−3 (gemessen als alveolengängiger Staub)[4] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Vanadium(V)-oxid (Vanadiumpentoxid) ist die stabilste Vanadiumverbindung mit dem Element Sauerstoff. In der Natur kommt Vanadium(V)-oxid als sehr seltenes Mineral Shcherbinait vor.
Darstellung
Vanadium(V)-oxid kann direkt aus den Elementen erzeugt werden.
- ;
Es kann auch durch Glühen von Ammoniummetavanadat (NH4VO3) bei 500–550 °C an Luft hergestellt werden.[2]
Da bei der thermischen Zersetzung von Ammoniummetavanadat an Luft stets leicht verunreinigtes Oxid entsteht, wird bei der Notwendigkeit der hochreinen Verbindung ein größerer Umweg in Kauf genommen, um ein exakt stöchiometrisches Produkt zu erhalten. Hierzu wird zunächst technisches Ammoniummetavanadat im Sauerstoffstrom zum Oxid verglüht, dieses dann mittels Thionylchlorid zum Vanadium(V)-oxidtrichlorid umgesetzt, hydrolysiert, mit Ammoniak zu einem hochreinen Ammoniummetavanadat umgesetzt und selbiges letztendlich erneut im Sauerstoffstrom zum Oxid verglüht[5]:
Eigenschaften
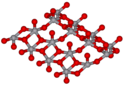
Vanadium(V)-oxid ist ein gelber bis rotbrauner, geruchloser Feststoff, in dessen Kristallstruktur Vanadium-Ionen sich in den Oktaederlücken einer dichtesten Kugelpackung von Sauerstoff-Ionen befinden. Jedes Vanadium-Ion ist von fünf Sauerstoff-Ionen umgeben, wodurch eine verzerrte trigonale Dipyramide gebildet wird. Die Kristallstruktur ist orthorhombisch, Raumgruppe Pmn21 (Raumgruppen-Nr. 31), mit den Gitterparametern a = 11,54 Å, b = 4,383 Å und c = 3,571 Å.[6]
Verwendung
Vanadium(V)-oxid wird als Katalysator bei der Schwefelsäure-Gewinnung nach dem Kontaktverfahren genutzt. Zudem findet es Gebrauch bei der Herstellung von Stahllegierungen wie Ferrovanadium. Es wird unter anderem als Katalysator bei der Rauchgasreinigung in Müllverbrennungsanlagen und zur Erniedrigung des Schmelzpunkts bei der Emailleherstellung verwendet.
Vanadium(V)-oxid wird auch verwendet, um Weißglas undurchlässiger für UV-Licht zu machen. Dazu wird es der Glasschmelze zugesetzt, das fertige Glas ist weder von außen noch von innen beschichtet. Flaschen aus diesem Glas werden vor allem für Bier verwendet, um den Lichtgeschmack zu vermeiden.
Nanostrukturiertes Vanadium(V)-oxid bildet in Kombination mit Wasser einen Verbundwerkstoff, der als "keramisches Papier" bezeichnet wird. Dieses "keramische Papier" hat ausgezeichnete mechanische Eigenschaften und ist elektrisch leitfähig. Mögliche Anwendungsbereiche sind deshalb Batterien, Gassensoren und künstliche Muskeln.[7]
Literatur
- H. Oppermann, W. Brückner, W. Reichelt, E. Wolf, J. I. Terukow, F. A. Tschudnowski: Vanadiumoxide. Akademie-Verlag, Berlin 1983.
Weblinks
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu Vanadium(V)-oxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. September 2023. (JavaScript erforderlich)
- ↑ a b Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1422.
- ↑ Eintrag zu Divanadiumpentaoxid; Vanadiumpentoxid; Vanadiumpentaoxid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 26. Juli 2023. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 1314-62-1 bzw. Vanadium(V)-oxid), abgerufen am 2. November 2015.
- ↑ Bertold Reuter and Jorg Jaskowsky: Vanadium(V) oxide, very pure. In: S. Young Tyree, Jr. (Hrsg.): Inorganic Syntheses. Band 9. McGraw-Hill Book Company, Inc., 1967, S. 80–83 (englisch).
- ↑ V. Shklover, T. Haibach, F. Ried, R. Nesper, P. Novak: Crystal structure of the product of Mg2+ insertion into V2O5 single crystals. In: Journal of Solid State Chemistry, 123, 1996, S. 317–323, doi:10.1006/jssc.1996.0186.
- ↑ Max-Planck-Gesellschaft, München: Keramik zum Falten, abgerufen am 11. April 2013.
Auf dieser Seite verwendete Medien
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances