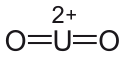Uranylacetat
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
  | ||||||||||
| Allgemeines | ||||||||||
| Name | Uranylacetat | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C4H6O6U | |||||||||
| Kurzbeschreibung | gelbe rhombische Prismen (Dihydrat)[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | ||||||||||
| Aggregatzustand | fest | |||||||||
| Dichte | 2,89 g·cm−3[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt | 275 °C (thermische Zersetzung)[1] | |||||||||
| Löslichkeit | mäßig in Wasser (76,94 g·l−1)[2] | |||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||
 Radioaktiv | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Uranylacetat (UO2(CH3COO)2 · 2 H2O) ist ein gelber, kristalliner Feststoff, bestehend aus rhombischen Kristallen mit leicht essigsaurem Geruch. Bei Temperaturen über 110 °C tritt der Verlust des Kristallwassers ein; wird der Stoff über 275 °C erhitzt, zersetzt er sich thermisch zu Urantrioxid (UO3).
Darstellung
Uranylacetat erhält man aus Urantrioxid durch Umsetzung mit 30%iger Essigsäure:[5]
Verwendung
Uranylacetat findet Verwendung zur Negativkontrastierung in Elektronenmikroskopen. Tatsächlich ist es für die meisten Abläufe in der Elektronenmikroskopie der Biologie notwendig. Uranylacetatlösungen zeigen Lichtempfindlichkeit und zersetzen sich vor allem unter UV-Strahlung. Ein- und zweiprozentige Uranylacetatlösungen dienen als Indikator und zur Titration in stärkeren Konzentrationen in der analytischen Chemie. In Gegenwart von Magnesiumacetat bildet Uranylacetat Kristalle von Natriummagnesiumuranylacetat, das im Gegensatz zu anderen Natriumsalzen relativ wenig löslich ist und anhand seiner Kristallform mikroskopisch identifiziert werden kann.[6]
Sicherheitshinweise
Kommerzielle Uranylacetatpräparate werden üblicherweise aus abgereichertem Uran hergestellt und besitzen (hydratwasserfrei) eine Radioaktivität von 13,69 bis 18,87 kBq/g (0,37 bis 0,51 µCi/g.)[2] Diese geringe Strahlungsintensität ist zu schwach, um gefährlich zu sein, solange das Material nicht inkorporiert wird.
Uranverbindungen sind unabhängig von ihrer Radioaktivität stark giftig.[7] Auf den menschlichen Körper wirkt es nach der Einnahme (oral, als Staub über die Atemwege oder bei Wundkontakt) sehr giftig. Es sind Risiken für den gesamten Organismus durch eine Langzeitexposition nicht auszuschließen. So können sich Erbgutschäden und Krebs entwickeln.
Literatur
- Ingmar Grenthe, Janusz Drożdżyński, Takeo Fujino, Edgar C. Buck, Thomas E. Albrecht-Schmitt, Stephen F. Wolf: Uranium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 253–698; doi:10.1007/1-4020-3598-5_5.
Weblinks
Einzelnachweise
- ↑ a b c d e f g Eintrag zu Uranylacetat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- ↑ a b Datenblatt Uranyl Acetate (Seite nicht mehr abrufbar, festgestellt im Mai 2019. Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 172 kB) bei Ladd Research, abgerufen am 16. März 2014.
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag uranium compounds with the exception of those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung.
- ↑ Hagers Handbuch der pharmaceutischen Praxis, Band 2, Berlin 1910, S. 1069.
- ↑ chemikalienlexikon.de: Uranylacetat.
- ↑ Abou-Donia MB, Dechkovskaia AM, Goldstein LB, Shah DU, Bullman SL, Khan WA: Uranyl acetate-induced sensorimotor deficit and increased nitric oxide generation in the central nervous system in rats. Pharmacol Biochem Behav. 2002 Jul;72(4):881-90. PMID 12062578
Auf dieser Seite verwendete Medien
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
(c) Minerallad in der Wikipedia auf Englisch, CC BY 3.0
Uranyl Acetate crystals grown by the photographer. Under natural light. Photograph sized down in Photoshop
Struktur des Acetat-Ions
Struktur des Uranyl-Ions