Uran(IV)-oxid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| _ U4+ _ O2− | ||||||||||||||||
| Kristallsystem | ||||||||||||||||
| Raumgruppe | Fm3m (Nr. 225) | |||||||||||||||
| Gitterparameter | a = 547 pm | |||||||||||||||
| Koordinationszahlen | U[8], O[4] | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Uran(IV)-oxid | |||||||||||||||
| Andere Namen | Urandioxid | |||||||||||||||
| Verhältnisformel | UO2 | |||||||||||||||
| Kurzbeschreibung | braunes bis schwarzes, kristallines Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 270,03 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | 10,97 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | nahezu unlöslich in Wasser[1] | |||||||||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||||||||
 Radioaktiv | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Uran(IV)-oxid (oft auch Urandioxid, UO2) ist ein Oxid des Urans. In der Natur kommt es z. B. als Uraninit vor, wobei der ursprünglich aus Uran(IV)-oxid bestehende Uraninit teilweise zu Uran(VI)-oxid weiteroxidiert wird.
Darstellung
Durch Reduktion von Uran(VI)-oxid mit Wasserstoff wird Uran(IV)-oxid gebildet.
Das für die Herstellung der Brennelemente in Kernkraftwerken benötigte Uran(IV)-oxid wird überwiegend aus Uran(VI)-fluorid hergestellt. Für die Umwandlung gibt es mehrere Verfahren. Nasschemische Verfahren sind das AUC- und das ADU-Verfahren.
Beim AUC-Verfahren (AmmoniumUranylCarbonat-Verfahren) wird mit Hilfe von Wasser, Ammoniak und Kohlenstoffdioxid Ammoniumuranylcarbonat gebildet und dieses dann durch Erhitzen zu Uran(VI)-oxid umgewandelt. Dieses wird anschließend mit Wasserstoff zu Uran(IV)-oxid reduziert.[4]
Mit dem ADU-Verfahren (AmmoniumDiUranat-Verfahren) werden aus UF6 über Hydrolyse zu Uranylfluorid, Fällung mit Ammoniaklösung zu Ammoniumdiuranat und anschließendem Kalzinieren im Wasserstoffstrom Uran(IV)-oxid hergestellt.[5] Die Gleichungen für das ADU-Verfahren lauten:
Das ADU-Verfahren ist auch für die Rückgewinnung von Uran aus Lösungen mit Uran(VI)-verbindungen gut geeignet.
Neben diesen Verfahren wird auch ein trockenes Verfahren, das DC-Pulver-Verfahren, verwendet.[6] Bei diesem Verfahren wird das Hexafluorid direkt zu Uran(IV)-oxid bei höheren Temperaturen umgewandelt. Vorteilhaft ist hier, dass keine Abfalllösungen mit Urangehalten anfallen, die einer weiteren Aufbereitung bedürfen. Die Gleichung für dieses Verfahren lautet:
Ein weiteres Verfahren zur Herstellung von Uran(IV)-oxid ist der für die Wiederaufbereitung von Brennelementen verwendete PUREX-Prozess. Bei diesem wird durch eine Extraktion Uranylnitrat gebildet, das wiederum durch Erhitzen in Uran(VI)-oxid umgewandelt und anschließend zu Uran(IV)-oxid reduziert wird.[7]
Eigenschaften
Physikalische Eigenschaften
Uran(IV)-oxid ist ein dunkelbraunes bis schwarzes, kristallines Pulver. Es weist ein kubisches Kristallsystem auf, hat die Raumgruppe Fm3m (Nr. 225), mit einem Gitterparameter a = 547 pm und vier Formeleinheiten pro Elementarzelle. Der Strukturtyp ist der CaF2-Typ (Fluorit) und die Koordinationszahlen sind U[8], O[4].
Uran(IV)-oxid ist zudem ein Halbleiter.[8] So konnte in Laborversuchen aus UO2 eine funktionsfähige Schottkydiode hergestellt werden.[9] Wegen Problemen aufgrund der ionisierenden Strahlung sowie mit der Dotierung findet dieser Werkstoff in der elektronischen Schaltungstechnik keine Anwendung.
Frisch erzeugtes Uran(IV)-oxid aus irdischem Natururan hat eine spezifische Aktivität von etwa 11400 Bq/g.
Chemische Eigenschaften
Uran(IV)-oxid-Luft-Gemische (Staubwolken) sind explosionsfähig, als feines Pulver reagiert es heftig mit der Luft unter Freisetzung von Wärme (pyrophor). Hierbei verbrennt es zu Triuranoctoxid U3O8.
- Urandioxid
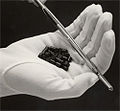
- Kernreaktorbrennstoff aus gesintertem Urandioxid
- Urandioxid-Pellets für einen Kernreaktor
Anwendungen
Uran(IV)-oxid ist der wichtigste Kernbrennstoff in Kernreaktoren. Es wird zu sogenannten „Pellets“ verarbeitet, um in Brennstäben genutzt zu werden. Sowohl in Leichtwasserreaktoren, welche angereicherten Brennstoff verwenden, als auch in Natururanreaktoren wie dem CANDU kommt hauptsächlich Urandioxid zum Einsatz.
Weiterhin wurde Uran(IV)-oxid früher als farbgebender Zusatz in diversen Gläsern und Keramiken genutzt. In Form eines URDOX-Widerstandes mit Heißleitereigenschaften diente es zur Strombegrenzung in Heizkreisen von Allstromgeräten.
Literatur
- Ingmar Grenthe, Janusz Drożdżynński, Takeo Fujino, Edgar C. Buck, Thomas E. Albrecht-Schmitt, Stephen F. Wolf: Uranium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 253–698; doi:10.1007/1-4020-3598-5_5.
Einzelnachweise
- ↑ a b c d e Eintrag zu Urandioxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 16. Februar 2017. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag uranium compounds with the exception of those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung.
- ↑ M. Volkmer: Basiswissen Kernenergie, Hamburgische Elektricitäts-Werke-AG, 1996, S. 76; ISBN 3-925986-09-X.
- ↑ Patent DE3587334T2: Gewinnung von Uran aus Lösungen. Angemeldet am 25. Oktober 1985, veröffentlicht am 28. Oktober 1993, Anmelder: Siemens AG, Erfinder: Richard Anthony Hermens et al.
- ↑ Patent DE10115015C1: Verfahren zur Herstellung eines Kernbrennstoff-Sinterkörpers. Angemeldet am 27. März 2001, veröffentlicht am 15. Mai 2003, Anmelder: Framatome ANP GmbH, Erfinder: Gerhard Gradel, Wolfgang Dörr.
- ↑ Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente, 1. Auflage, VCH Verlagsgesellschaft, Weinheim 1988, S. 1616; ISBN 3-527-26169-9.
- ↑ Yong Q. An, Antoinette J. Taylor, Steven D. Conradson, Stuart A. Trugman, Tomasz Durakiewicz, and George Rodriguez: Ultrafast Hopping Dynamics of 5f Electrons in the Mott Insulator UO2 Studied by Femtosecond Pump-Probe Spectroscopy. In: Phys. Rev. Lett. 107. Jahrgang, Nr. 20, 2011, S. 207402–207405, doi:10.1103/PhysRevLett.106.207402 (englisch).
- ↑ Thomas Meek: Semiconductive Properties of Uranium Oxides. (PDF; 88 kB) Materials Science Engineering Department, University of Tennessee, 2000, abgerufen am 2. September 2024.
Auf dieser Seite verwendete Medien
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Crystal structure of CaF2 with coordination polyhedra
Autor/Urheber: Chemolunatic, Lizenz: CC BY-SA 4.0
Nuclear reactor fuel pellet (Mass: 10g)
Autor/Urheber: Chemolunatic, Lizenz: CC BY-SA 4.0
UO2 Powder used for making reactor fuel
Brennelement und radioaktive Brenstoffpelets