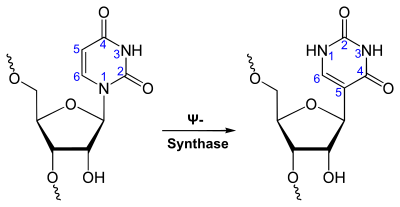Uracil
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Uracil | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H4N2O2 | ||||||||||||||||||
| Kurzbeschreibung | weißer, pulvriger Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 112,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | mäßig löslich in kaltem Wasser[2], leicht löslich in heißem Wasser[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 | −429,4 kJ/mol[4] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
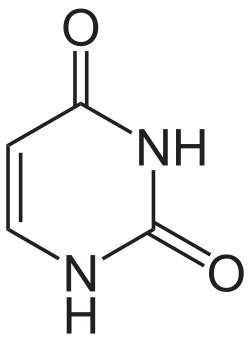
Uracil (U, Ura) ist eine der vier wichtigsten Nukleinbasen in der RNA, zusammen mit Adenin, Cytosin und Guanin. In der DNA steht an seiner Stelle Thymin. Es ist eine heterocyclische organische Verbindung mit einem Pyrimidingrundgerüst und zwei Substituenten (Sauerstoffatome an den Positionen 2 und 4). Die Nukleoside von Uracil sind das Uridin in der RNA und das sehr seltene Desoxyuridin in der DNA. In der Watson-Crick-Basenpaarung bildet es zwei Wasserstoffbrücken mit Adenin.
Geschichte
Uracil wurde 1900 in Marburg als ein Spaltprodukt des Nukleins aus Hefe von dem Italiener Alberto Ascoli isoliert,[5] beraten durch seinen Lehrer Albrecht Kossel.[6] Der Name für Uracil geht jedoch auf den Leipziger Chemiker Robert Behrend zurück, der 1885 die Struktur dieser Verbindung aus dem Methyl-Derivat hergeleitet hatte – bei seinen Versuchen, Abkömmlinge der Harnsäure zu synthetisieren.[7]
Darstellung
Uracil lässt sich durch Kondensation von Harnstoff mit 3-Oxopropansäure („Formylessigsäure“, C3H4O3) erhalten. Die C3-Komponente ist jedoch in diesem Fall nicht lagerfähig und wurde daher durch Äpfelsäure ersetzt. Diese wird in konzentrierter Schwefelsäure unter Wasserabspaltung decarbonyliert, verliert also Kohlenmonoxid. Die in situ gebildete 3-Oxopropansäure kondensiert mit dem Harnstoff in der schwefelsauren Lösung unter zweifacher Abspaltung von Wasser.
Eigenschaften
Uracil ist ein weißer, pulvriger Feststoff, der bei 341 °C schmilzt.[3]
Die Verbindung wurde beim hydrolytischen Abbau von Nukleinsäuren entdeckt. Eine Röntgenkristallstrukturanalyse bewies, dass von den möglichen tautomeren Formen im festen Zustand (mehrere desmotrope Formen existieren) die Dioxo-Form vorliegt.[8]
Uracil ist eine schwache Säure (pKa = 9,45). Die Aciditätskonstante liegt im Bereich von Phenol (pKa = 10,0) und anderen Enolen. Im Uracil-Anion ist die negative Ladung delokalisiert (mesomere Grenzstrukturen). Daher löst sich Uracil in wässrigen Alkalien und wässrigem Ammoniak.
Biologische Bedeutung
Uracil kommt im Körper hauptsächlich an Ribosephosphat gebunden vor, entweder als eines der Nukleotide Uridinmonophosphat (UMP), Uridindiphosphat (UDP) oder Uridintriphosphat (UTP) oder als Bestandteil der Ribonukleinsäure (RNA).
Bestandteil der RNA
Uracil bildet über die 4-Oxogruppe und die N–H-Gruppe die Basenpaarung zu Adenin mit zwei Wasserstoffbrücken aus.
Physiologisch wird Uracil nur in die einsträngige RNA, nicht aber in die doppelsträngige Desoxyribonukleinsäure (DNA) eingebaut. Zur Paarung mit Adenin kommt es während der Transkription, in den Schleifen (Loops) der tRNA und während der Translation (Proteinbiosynthese).
Nukleoside
Uracil bildet mit Ribosen zwei verschiedene Nukleoside, das Uridin (U) (Verknüpfung über das N1-Atom) und das Pseudouridin (Ψ) (Verknüpfung über das C5-Atom).
Nukleotide
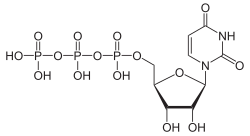
Über die Phosphorylierung des Uridins am C5-Atom der Ribose gelangt man zu den wichtigen Nukleotiden Uridinmonophosphat (UMP), Uridindiphosphat (UDP) und Uridintriphosphat (UTP).
Vergleich von Uracil und Thymin
In RNA kommen als Nukleobasen neben den Purin-Basen Adenin (A) und Guanin (G) die beiden Pyrimidin-Basen Cytosin (C) und Uracil (U) vor, in DNA anstelle von Uracil das Thymin (T). Aus einem Cytosin kann relativ einfach durch Desaminierung und Hydrolyse ein Uracil entstehen, wodurch dann die Basensequenz geändert (mutiert) wird und die in der Nukleotidsequenz genetisch codierte Information verändert werden kann.
Vom Uracil unterscheidet sich Thymin durch eine zusätzliche Methylgruppe (5-Methyl-Uracil); es kann daher nicht ganz so einfach aus Cytosin entstehen. In einer DNA auftretendes Uracil kann von spezifischen Reparaturenzymen als mutierte Base erkannt, entfernt und gegen Cytosin ausgetauscht werden (Basenexzisionsreparatur).
Biochemischer Abbau
Uracil wird zu Kohlenstoffdioxid (CO2), zwei Ammoniumionen (NH4+) und 3-Oxopropansäure abgebaut. Letzteres reagiert weiter zu Malonyl-CoA, das zum Beispiel in der Fettsäuresynthese Verwertung finden kann.
Verwandte Verbindungen und Derivate
 |  |  |  |  |  |  |  |
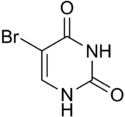
| Dihydrouracil | 1-Methyluracil | 3-Methyluracil | 5-Methyluracil (= Thymin) | 5-Fluoruracil | 5-Chloruracil | 5-Bromuracil | 5-Ioduracil |
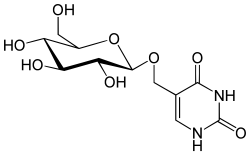
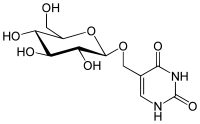 |
| Glucopyranosyloxymethyluracil |
Einzelnachweise
- ↑ Eintrag zu URACIL in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- ↑ a b c d Datenblatt Uracil, 99+% bei AlfaAesar, abgerufen am 6. Dezember 2019 (PDF) (JavaScript erforderlich).
- ↑ a b c Datenblatt Uracil (PDF) bei Calbiochem, abgerufen am 7. Dezember 2015.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- ↑ Alberto Ascoli: Ueber ein neues Spaltprodukt des Hefenucleins. In: Hoppe-Seyler (Hrsg.): Zeitschrift für physiologische Chemie. Band 31, Nr. 1–2, 2. Oktober 1900, S. 161–164, doi:10.1515/bchm2.1901.31.1-2.161.
- ↑ Siehe auch Danksagung auf S. 164.
- ↑ Robert Behrend: Versuche zur Synthese von Körpern der Harnsäurereihe. In: Justus Liebigs Annalen der Chemie. Band 229, Nr. 1–2, 4. März 1885, S. 1–44, doi:10.1002/jlac.18852290102.
- ↑ R. F. Stewart, L. H. Jensen: „Redetermination of the crystal structure of uracil“, Acta Cryst, 1947, 23, S. 1102–1105 (doi:10.1107/S0365110X67004360).
Weblinks
- Eintrag zu Uracil in der Human Metabolome Database (HMDB), abgerufen am 12. Oktober 2013.
Auf dieser Seite verwendete Medien
Structure of 5-chlorouracil
Autor/Urheber: Durfo, Lizenz: CC BY-SA 3.0
Synthese von Uracil aus Äpfelsäure und Harnstoff via 3-Oxopropansäure (Formylessigsäure)
5-Ioduracil
Struktur von Uridintriphosphat
Die tautomeren Strukturen des Uracils
Struktur von Dihydrouracil
Structure of 3-Methyluracil
Struktur des beta-D-Glucopyranosyloxymethyluracil (Base J, J-Base)
Chemical structure of 5-bromouracil
Basenpaar Adenin Uracil (AU)
Struktur von Thymin
Desaminierung Cytosin zu Uracil
chemical structure of Fluorouracil
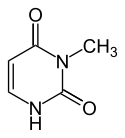
1-Methyluracil