Ulcus cruris venosum

| Klassifikation nach ICD-10 | |
|---|---|
| I83.2 | Varizen der unteren Extremitäten mit Ulzeration und Entzündung |
| ICD-10 online (WHO-Version 2019) | |
Der Begriff Ulcus cruris venosum (lateinisch ulcus ‚Wunde‘, crus ‚Wade‘, vena ‚Blutader‘) bezeichnet ein Ulcus cruris („offenes Bein“, Unterschenkelgeschwür), das infolge eines fortgeschrittenen Venenleidens infolge einer so genannten chronisch venösen Insuffizienz aufgetreten ist. Es handelt sich um eine chronische Wunde, die meist im unteren Drittel des Unterschenkels, im Bereich des Innenknöchels, zu finden ist. Verantwortlich für sein Auftreten ist letztlich der im Rahmen des Venenleidens in diesem Bereich besonders hohe Druck des Blutes in den Venen. Der Begriff „Ulcus“ bedeutet in die Alltagssprache übersetzt so viel wie „Geschwür“. Das ist etwas irreführend, denn bei einem Ulcus cruris venosum handelt es sich um einen mindestens bis in die Lederhaut reichenden Substanzdefekt des Gewebes. Er ist grundsätzlich immer von Bakterien besiedelt und heilt oft nur sehr schlecht und langsam ab. Das Ulcus cruris venosum ist die mit Abstand häufigste Ursache für Ulcera an den Beinen, seine Behandlung erfolgt durch eine Verminderung des Blutstaus im venösen System der Beine durch Kompressionstherapie, Reduzierung der entzündlichen Veränderungen und Anregung der Granulation des Gewebes.
Verbreitung
Bei dem Großteil der chronischen Wunden an den Beinen handelt es sich um ein Ulcus cruris venosum.[1] Je nach Quelle liegt der Anteil zwischen 31 und 80 Prozent. Ältere Patienten sind am häufigsten betroffen. Durchschnittlich etwa 0,6 Prozent aller Menschen zwischen dem 18. und dem 79. Lebensjahr waren zumindest einmalig davon betroffen, ab dem 8. bis 9. Lebensjahrzehnt beträgt die Vorkommenshäufigkeit etwa 1 bis 3 Prozent.[2][3] Die sogenannte „Bonner Venenstudie“ der Deutschen Gesellschaft für Phlebologie, die im Jahr 2003 die Verbreitung des Ulcus cruris venosum erhob, schätzte die Anzahl der Betroffenen auf 80.000.[2] Fast eine halbe Million Menschen weisen in Deutschland zudem ein bereits abgeheiltes Ulcus cruris venosum auf. Das Risiko, ein solches Beingeschwür zu entwickeln, steigt mit zunehmenden Lebensalter an.
Ursache und Entstehung
Ursächlich für ein Ulcus cruris venosum ist eine chronisch-venöse Insuffizienz (CVI). Dabei kommt es insbesondere infolge defekter Venenklappen zu einer Druckerhöhung in den Venen. Da der Mensch aufrecht steht, sind dabei die unteren Extremitäten aufgrund des hydrostatischen Drucks besonders betroffen. Dort ist also der Druck des Blutes in den Venen (venöse Hypertonie) am höchsten und die Venen sind dort besonders prall gefüllt (venöse Hypervolämie).[4][3]

Durch diesen hohen Druck in den großen Venen der Beine steigt auch der Druck in den venösen (post-)kapillaren Gefäßen. Dadurch strömen vermehrt Proteine daraus ins Gewebe und führen dort zu Ödemen. Zugleich werden die Kapillargefäße geschädigt und zeigen langfristig einen mikroangiopathischen Umbau; als Folge wird das Gewebe nicht mehr versorgt (es gibt Anhaltspunkte, dass beispielsweise die Sauerstoffdiffusion abnimmt), reagiert anfangs durch Vernarbungsvorgänge und stirbt dann langsam ab. Als Vorstufen eines Ulcus cruris venosum können sich dabei zunächst als erste Anzeichen die sogenannten "Warnvenen" (Corona phlebectatica paraplantaris) und die typischen Ödeme entwickeln. Zudem zeigt sich oft eine bräunliche Hauitverfärbung durch eine Einlagerung von Eisen-Eiweiß-Verbindungen, die sogenannte "Purpura jaune d'ocre". Beim Fortschreiten der CVI zeigt sich in späteren Chronisch-venöse Insuffizienz#Widmer Klassifikation oft eine „Atrophie blanche“ (Capillaritis alba) und die „Dermatoliposklerose“.[5][6] Von den krankhaften Veränderungen des Venensystems unabhängige Störungen der Blutgerinnung können den Verlauf deutlich schwerer werden lassen und beschleunigen. Durch eine Zunahme von Fibrinogen im Blut nehmen dessen Viskosität und der Umfang der Verklumpungsneigung der roten Blutkörperchen zu. Auch gibt es Hinweise, dass neurologische Störungen auftreten können: So konnte eine Verlängerung der Nervenleitgeschwindigkeit des Nervus peroneus zusammen mit einer Verminderung der Wahrnehmung von Kälte und Hitze sowie von Vibrationen nachgewiesen werden. Auch die nervale Steuerung der Kapillaren ist messbar verändert und der Abfluss der Lymphe über die Lymphgefäße vermindert.[4][6]
Ein Ulcus cruris venosum entsteht hauptsächlich infolge eines Krampfaderleidens (Varicosis). Es kann aber auch als Symptom eines postthrombotischen Syndroms auftreten, das die chronische Folge einer tiefen Beinvenenthrombose ist.[5] Führen CVI und eine periphere arterielle Verschlusskrankheit (pAVK) gemeinsam zur Entstehung eines Ulcus, so spricht man von einem Ulcus cruris mixtum.[7] Das Ulcus cruris mixtum macht etwa 15 % der Fälle von Ulcus cruris aus.
Klinische Erscheinungen

Typischerweise imponiert ein Ulcus cruris venosum als entzündeter und oft schmerzhafter Substanzdefekt des Gewebes am distalen Unterschenkel bei Patienten mit einem chronischen Krampfaderleiden oder nach einer Thrombose. Am häufigsten findet es sich im Bereich des Innenknöchels, seltener auch am Außenknöchel, oder zirkulär den Unterschenkel umfassend (Gamaschenulcus). Vor dem 40. Lebensjahr tritt es nur ausnahmsweise auf. Ein Ulcus cruris venosum ist im Anfangsstadium meist relativ flach, der Boden typischerweise „schmierig-eitrig“ belegt. In seiner Umgebung finden sich meist auch andere, durch eine chronisch venöse Insuffizienz ausgelöste Veränderungen wie Atrophie blanche, Hyperpigmentierung und Dermatosklerose.[3]
Untersuchungsmethoden
Letztlich handelt es sich beim klassischen Ulcus cruris um eine „Blickdiagnose“, zu deren Sicherung die leitlinienkonforme Diagnostik der chronisch venösen Insuffizienz nötig ist, insbesondere auch im Hinblick auf die Erkennung möglicher Differenzialdiagnosen eines Ulcus cruris. Das Ulcus cruris venosum ist klar abzugrenzen vom Ulcus cruris arteriosum, der Vaskulitis, dem Pyoderma gangraenosum, der Livedo-Vaskulopathie, der Kalziphylaxie sowie der Necrobiosislipoidica, die alle in den Unterschenkeln auftreten können.[8] Wegweisend für die Diagnostik sind typische Veränderungen der Umgebung bei gleichzeitig fehlenden anderen Risikofaktoren für die Entstehung eines Ulcus cruris und seine Lokalisation. Apparative Verfahren (beispielsweise Dopplersonographie) sind zur Sicherung der Diagnose einer CVI ergänzend sinnvoll.[3]
Zur Dokumentation des Heilungsverlaufes kann das Ulcus ausgemessen oder auch photographisch dokumentiert werden. Bei auffälligem Heilungsverlauf sind in einigen Fällen (nicht routinemäßig) auch eine Gewebeentnahme zum Ausschluss eines Malignoms oder ein Abstrich zur bakteriologischen Testung angezeigt.[8] In der feingeweblichen Aufarbeitung eines Ulcus cruris venosum finden sich Nekrosen und chronische Infiltrationen. Jeglicher Anhalt für Malignität fehlt.
Behandlung
Die Behandlung ist primär darauf ausgerichtet, den Stau (Druck- und Volumenüberlastung) im venösen System und damit insbesondere auch in den venösen Haargefäßen sowie die entzündlichen Veränderungen zu reduzieren und anschließend die Granulation des Gewebes zu fördern.[4][3] Wesentliche Maßnahme hierfür ist die den Druck in den Venen reduzierende Kompressionstherapie.[9] Allerdings wird in Deutschland ein erheblicher Anteil der Menschen, die ein Ulcus cruris venosum ausgebildet haben, nicht mit Kompressionstherapie versorgt.[10] Die Kompressionstherapie unterteilt sich in zwei Phasen. In der einleitenden Entstauungsphase wird das oft stakt ödematose Bein mit Kompressionsbandagierungen gewickelt. Wenn das Ödem sich entsprechend zurückgebildet hat, wird die Versorgung bei noch bestehender Wunde auf "Ulkus-Strumpfsysteme" umgestellt – dabei handelt es sich um zwei Kompressionsstrümpfe, die übereinandergezogen werden.[5] Die Therapie wird ergänzt durch gerinnungshemmende, wundreinigende und operative Verfahren. Bei Schmerzen ist eine stadiengerechte Schmerztherapie angezeigt.[3][11]
Druck- und Volumenüberlastung behandelnde Verfahren
Die möglichen operativen Maßnahmen umfassen entstauende Maßnahmen, wie die Entfernung von Varizen (oberflächliche Venen) und begleitender transfaszialer Perforansvenen (die Unterschenkelfaszie durchbohrende Venen), die Rekonstruktion und Transplantation von Venenklappen im tiefen Venensystem sowie die chirurgische Behandlung der Unterschenkelfaszie (paratibiale Fasziotomie und Fasziektomie).[5]
Als weiteres die Druck- und Volumenüberlastung im venösen System reduzierendes Verfahren bietet sich die Sklerotherapie an. Grundsätzlich sind dazu natürlich alle Verfahren geeignet, die den pathologischen Blutfluss (vom Körper Richtung Zehen) reduzieren oder gänzlich unterbrechen. Hierbei werden die tiefen Stammvenen der Beine verschlossen, was beispielsweise durch Einspritzen eines aufschäumenden Mittels („Schaumsklerosierung“), durch Lasertechnologie oder durch chirurgische Verfahren – das sogenannte „Venenstripping nach Babcock“ – erfolgen kann.[5] Bei letzteren beiden Verfahren treten im Nachhinein weniger Rezidive auf. Die Nachhaltigkeit der Erfolge einer Schaum-Sklerotherapie hängt allerdings mit dem Durchmesser der behandelten Vene zusammen und ist umso erheblicher, je geringer dieser ist. Vorteil dieser Methode ist das geringere damit zusammenhängende Schmerzaufkommen im Anschluss an den Eingriff. Die Wirksamkeit einer frühen endovenösen Ablation, beispielsweise durch Radiofrequenzablation oder ultraschallgeführte Schaum-Sklerotherapie, konnte in der britischen EVRA-Studie gezeigt werden.[12] Bei Patienten mit Ulcus cruris venosum kann die Durchblutungssituation durch sklerosierende Verfahren zumindest kurzfristig normalisiert und eine Abheilung der Wunde gefördert werden.
Bewegung
Auch eine Funktionsunterstützung der Muskelpumpe des Unterschenkels und der Sprunggelenkpumpe durch vermehrte Mobilisierung eines Patienten ist eine wichtige Unterstützung der Therapie des Ulcus cruris venosum. Unter Steigerung der Mobilität durch Eigenbewegung verbessert sich die Abheilung des Ulcus cruris venosum. Daher wird der Patient von Seiten der Pflegefachkräfte durch edukative Maßnahmen über die Bedeutung der ausreichenden und täglichen Bewegung informiert und entsprechend auch dazu angeregt.[13] Zudem sind Übungen des Venen- oder Gefäßsports, sowie die Beachtung des Merksatzes „Sitzen und stehen ist schlecht, lieber laufen und liegen“ (3S-3L-Regel) etablierte grundsätzliche Maßnahmen der Therapie von Menschen mit chronisch venöser Insuffizienz.[14] Weitere ergänzende Maßnahmen sind die physikalische Therapie mittels manuelle Lymphdrainage und intermittierende pneumatische Kompression.[4][3][9]
Lokale Wundbehandlung
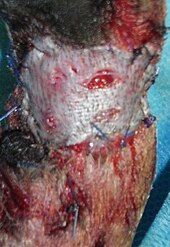
Das Ulcus cruris venosum zählt zu den sogenannten Chronischen Wunden und benötigt in den meisten Fällen eine entsprechend längere Abheilungszeit von etwa einem Jahr in 30 – 66 % der Fälle. Bei 20 % der Betroffenen nimmt der Heilungsverlauf zwei Jahre und bei 8 % sogar bis zu fünf Jahre in Anspruch. Werden die Faktoren, die zu Ulcusbildung führen ausreichend behandelt, so kann durch eine Lokaltherapie des Ulcus der Heilungsverlauf unterstützt werden. Grundsätzlich muss eine geeignete Lokaltherapie eine ungestörte Wundheilung zulassen. Die Wundheilung (körpereigener Vorgang) kann sie jedoch per se nicht beschleunigen. Eine feuchte Wundbehandlung ist einer trockenen dabei vorzuziehen. Von der Industrie werden dazu verschiedene Verbandsstoffe angeboten. Dazu zählen Gazen, Schaumstoffe, Calciumalginatwatten bzw. -kompressen, Hydrogele, Hydrokolloide und hydroaktive Verbände. Bislang konnte nicht nachgewiesen werden, dass eine bestimmte Art von Wundauflagen bei der Wundversorgung des Ulcus cruris venosum prinzipiell einer anderen überlegen ist. Der behandelnde Arzt wählt anhand der vorliegenden Indikationen die für den Einzelfall am geeignetsten erscheinende Lokaltherapie aus. Hierbei gibt es keine nachgewiesenen Vorteile für gewöhnliche Kompressen oder Hydrokolloidauflagen, Alginatauflagen sowie Schaumstoffverbänden. Allerdings können schmerzmittelhaltige Schaumstoffverbände die Schmerzsituation des Patienten verbessern.[13]
Die Ulcera können auch mittels Débridement und Exzision behandelt werden. Dabei ist die Verwendung einer lokalen Anästhesie, beispielsweise mit Lidocain, empfohlen.[13] Anschließend kann das betroffene Areal, insbesondere bei mangelhafter Heilungstendenz mittels Hauttransplantation (beispielsweise Spalthaut- oder Meshgraft-Plastik) gedeckt werden.[11] Ein Débridement der Wunde kann auch medikamentös, beispielsweise mittels Salicylvaseline oder enzymatischer Wundreinigung durchgeführt werden. Besonders auf die entzündlichen Veränderungen ausgerichtet ist der Einsatz von Antibiotika, lokalen Antiseptika (z. B. Jod-PVP) oder Silber-Ionen freisetzenden Wundauflagen. Ein sicherer Wirknachweis besteht jedoch bislang für kein lokales Antiseptikum.[15] Für die topische Anwendung von zur Schmerzlinderung gedachten Mitteln konnte bislang kein Nachweis für eine Förderung der Abheilung erbracht werden. Ein Gemisch aus Lidocain und Prilocain scheint jedoch den Schmerz zeitlich begrenzt abzumildern.[16] Gerade bei der Lokaltherapie besteht eine Herausforderung auch darin, dass die Patienten besonders häufig und umfangreich zur Sensibilisierung gegen lokal eingesetzte Substanzen neigen. Diese sollten deshalb so inert wie irgend möglich sein.[4][3] Bei Antibiotika sollte aufgrund der Resistenzentwicklung zudem der Einsatz nur bei klinisch manifesten Infektionen und nicht bei der ulcustypischen bakteriellen Besiedelung erfolgen.[15]
Medikamentöse Therapie (systemisch)
Die medikamentöse Therapie ersetzt weder die entstauende noch die lokale Behandlung. Die möglichen unerwünschten Wirkungen und etwaige Kontraindikationen schränken den Einsatz zudem ein.
Ein positiver Wirknachweis liegt bislang für Acetylsalicylsäure, Pentoxiphyllin, Iloprost, Prostaglandin E1 und die Flavoinoide Diosmin/Hesperidin (Kombination), Kumarin/Troxerutin (Kombination), Sulodexide und Rosskastanien-Extrakt vor. Zudem kann eine Substitution bei Mangelernährungszuständen von Zink, Eisen, Folat, Albumin, Vitamin C und Selen die Heilung unterstützen.[4]
Vorbeugung
Um der Bildung eines Ulcus cruris venosum vorzubeugen, muss eine vorbestehende chronisch venöse Insuffizienz konsequent behandelt werden.
Da eine Thrombophilie ein wesentlicher Zusatzfaktor ist, kann im Rahmen der Vorbeugung auch die Risikoeinschätzung naher Verwandter von Patienten mit einem Ulcus cruris venosum sinnvoll sein. Dazu eignen sich statistisch signifikante laborchemische Veränderungen von Ulcus cruris venosum-Patienten im Vergleich zur Normalbevölkerung. Dazu können, abhängig vom Einzelfall, Untersuchungen auf Faktor-V-Leiden-Mutation, Antithrombin-Mangel, Protein-C-Mangel, Protein-S-Mangel, Lupusantikoagulans und Antikardiolipin-Antikörper angezeigt sein.[4]
Heilungsaussicht
Die Heilungsaussichten sind grundsätzlich gut, wenngleich die Behandlung auch sehr langwierig sein kann. Ein Ulcus gilt als therapieresistent, wenn es unter optimaler Therapie nicht nach drei Monaten die erste Heilungstendenz aufweist oder nicht binnen zwölf Monaten abgeheilt ist. Ist es abgeheilt, bedarf es konsequenter Vorbeugung, um ein erneutes Aufbrechen zu verhindern.[4][3]
Geschichtliche Aspekte
Traditionell werden lange bestehende nässende Wunden an den unteren Extremitäten als „offenes Bein“ bezeichnet.[17] Eine frühe medizinisches Abhandlung zur Behandlung des Ulcus cruris (venosum), mittelhochdeutsch alt(er) schaden, stellt das Buch von alten Schäden[18][19] dar, welches um 1450 im südwestdeutschen Raum entstanden ist[20] und das wohl älteste Spezialrezeptar für das Krampfader-Leiden der Beine darstellt.[21] Bis ins 19. Jahrhundert hielt sich in der Volksmedizin eine Meinung, dass man die Ulcera bei gleichzeitig bestehendem Herzleiden nicht zur Abheilung bringen dürfe.[22] 1877 führte Max Schede die venenchirurgische Behandlung des Ulcus cruris venosum mittels eines nach ihm benannten Verfahrens ein.[23]
Literatur
- Kerstin Protz: Moderne Wundversorgung – Praxiswissen, Standards und Dokumentation. 8. Auflage. Elsevier Verlag, München 2016, ISBN 978-3-437-27885-3.
Weblinks
- S2k-Leitlinie "Diagnostik und Therapie des Ulcus cruris venosum" auf der Website der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften
Einzelnachweise
- ↑ Finja Jockenhöfer, Harald Gollnick, Katharina Herberger, Georg Isbary, Regina Renner, Markus Stücker et al: "Aetiology, comorbidities and cofactors of chronic leg ulcers: retrospective evaluation of 1000 patients from 10 specialised dermatological wound care centers in Germany". International Wound Journal 2016;13(5):821-8.
- ↑ a b Bonner Venenstudie der DGP. (PDF; 700 kB). Eberhard Rabe et al.: Phlebologie, 32(1), Schattauer, 2003, S. 1–14.
- ↑ a b c d e f g h i Peter Altmeyer u. a.: Basiswissen Dermatologie: Eine vorlesungsbegleitende Darstellung. Verlag W3l, 2005, ISBN 3-937137-95-5, S. 377, books.google.de
- ↑ a b c d e f g h S3-Leitlinie der Deutschen Gesellschaft für Phlebologie für die Diagnostik und Therapie des Ulcus cruris venosum. awmf.org (PDF) Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften.
- ↑ a b c d e Joachim Dissemond, Knut Kröger (hrsg.): Chronische Wunden. Diagnostik – Therapie – Versorgung, 2. Auflage, Elsevier Verlag, München 2024, ISBN 978-3-437-25642-4, Seite 103–108
- ↑ a b A. Berger u. a.; Plastische Chirurgie: Grundlagen, Prinzipien, Techniken. Springer, 2002, ISBN 3-540-42591-8, S. 64, books.google.de
- ↑ J. Braun u. a.: Klinikleitfaden innere Medizin. Urban & Fischer-Verlag, 2009, ISBN 978-3-437-22293-1, S. 180ff., books.google.de
- ↑ a b Kerstin Protz, Joachim Dissemond, Knut Kröger: Kompressionstherapie. ein Überblick für die Praxis, Springer Medizin Verlag, Berlin Heidelberg 2016, ISBN 978-3-662-49743-2, Seite 8–16
- ↑ a b S. O’Meara u. a.: Compression for venous leg ulcers. In: Cochrane Database Syst Rev. 2009 Jan 21, PMID 19160178
- ↑ Kristin Sauer, Heinz Rothgang, Gerd Glaeske: Barmer GEK Heil- und Hilfsmittellreport 2014, Schriftenreihe zur Gesundheitsanalyse, Band 28, September 2014, Seite 89–90
- ↑ a b J. E. Jones u. a.: Skin grafting for venous leg ulcers. In: Cochrane Database Syst Rev. 2007 Apr 18;(2), PMID 17443510
- ↑ Manjit S. Gohel, Francine Heatley, Xinxue Liu, Andrew Bradbury, Richard Bulbulia: A Randomized Trial of Early Endovenous Ablation in Venous Ulceration. In: New England Journal of Medicine. 24. April 2018, doi:10.1056/NEJMoa1801214 (nejm.org [abgerufen am 13. Dezember 2018]).
- ↑ a b c Deutsches Netzwerk für Qualitätsentwicklung in der Pflege (Hrsg.): Expertenstandard Pflege von Menschen mit chronischen Wudnen einschließlich Kommentierung und Literaturstudie, 1. Aktualisierung, Osnabrück 2015, ISBN 978 3 00 023708 9, Seite 82–94
- ↑ Joachim Dissemond: Ulcus cruris – Genese, Diagnostik und Therapie. Uni-Med Verlag, Bremen u. a. 2007, ISBN 978-3-89599-298-8, S. 105
- ↑ a b S. O’Meara u. a.: Antibiotics and antiseptics for venous leg ulcers. In: Cochrane Database Syst Rev. 2010 Jan 20;(1), PMID 20091548.
- ↑ M. Briggs u. a.: Topical agents or dressings for pain in venous leg ulcers. In: Cochrane Database Syst Rev., 2010 Apr 14, 4, PMID 20393931
- ↑ Amtsblatt für den Regierungsbezirk Düsseldorf, Verlag Bagel, 1866, S. 395, books.google.de
- ↑ Hans-Joachim Peters (Hrsg.): Das „Buch von alten Schäden“. Teil I: Text. Medizinische Dissertation, Bonn 1973 (in Kommission bei Königshausen & Neumann, Würzburg).
- ↑ Ingrid Rohland: Das „Buch von alten Schäden“. Teil II: Kommentar und Wörterverzeichnis. (Medizinische Dissertation Würzburg) Pattensen bei Hannover (jetzt: Verlag Königshausen & Neumann, Würzburg) 1982 (= Würzburger medizinhistorische Forschungen. Band 23). Rezension darüber: Bernhard D. Haage, in: Leuvense Bijdragen. Band 74, 1985, S. 505–507.
- ↑ Gundolf Keil: Buch von alten Schäden. In: Burghart Wachinger u. a. (Hrsg.): Die deutsche Literatur des Mittelalters. Verfasserlexikon. 2., völlig neu bearbeitete Auflage. Berlin / New York 1978–2008, ISBN 3-11-022248-5, Band 1 (‘A solis ortus cardine’ - Colmarer Dominikanerchronist.), 1978, Sp. 1080 f.
- ↑ Wolfgang Wegner: ‚Buch von alten Schäden‘. In: Werner E. Gerabek u. a.: Enzyklopädie Medizingeschichte. 2005, S. 218.
- ↑ W. Hach u. a.: Blickpunkte in die Medizingeschichte des 19. Jahrhunderts. Schattauer Verlag, 2007, ISBN 978-3-7945-2592-8, S. 20, books.google.de
- ↑ W. Hach u. a.: Venenchirurgie: Leitfaden für Gefäßchirurgen, Angiologen, Dermatologen und Phlebologen. Schattauer Verlag, 2007, ISBN 978-3-7945-2570-6, S. 68, books.google.de
Auf dieser Seite verwendete Medien
Autor/Urheber: Enter, Lizenz: CC BY-SA 4.0
Typische Lokalisation des Ulcus cruris venosum
Autor/Urheber: Uwe Gille, Lizenz: CC BY 3.0
Hauttransplantat auf der Beugeseite der Mittelhand eines Hundes unmittelbar nach der Transplantation
Autor/Urheber: Redlinux, Lizenz: CC BY-SA 3.0
Bild eines echten Ulcus cruris venosum
Autor/Urheber: de:User:Robodoc, Lizenz: CC BY-SA 3.0
Ulcus cruris, eigene Fotografie (Robodoc)



