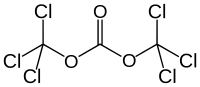
Triphosgen
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Triphosgen | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3Cl6O3 | ||||||||||||||||||
| Kurzbeschreibung | weißer bis gelblicher Feststoff mit unangenehmem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 296,74 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Dichte | 1,6 g·cm−3 [1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | 203–206 °C[1] | ||||||||||||||||||
| Dampfdruck | 16 hPa (90 °C)[1] | ||||||||||||||||||
| Löslichkeit | nahezu unlöslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Triphosgen ist ein starkes Gift, das farblose Kristalle bildet und chemisch ein perchlorierter Dimethylester der Kohlensäure ist.
Gewinnung und Darstellung
Triphosgen wird durch Photochlorierung von Dimethylcarbonat hergestellt.[2]
Eigenschaften
Die Verbindung zersetzt sich beim Sieden teilweise unter Abgabe von Phosgen und Diphosgen. Chemisch verhält sich Triphosgen ähnlich wie diese Stoffe, jedoch verlaufen alle Reaktionen langsamer. Die heutige Bedeutung ist eher gering. Triphosgen wird durch die Atemwege aufgenommen und führt zu lungenödemähnlichen Symptomen wie Hustenreiz, Übelkeit, Kurzatmigkeit und Erbrechen. Im späteren Verlauf können Lungenembolien oder Herzinfarkte auftreten. Auch die Augen werden angegriffen, sodass nach Kontamination eine sofortige Ausspülung der Augen notwendig wird.
Im Ersten Weltkrieg wurde Triphosgen als Feststoff im Gemisch mit Pyridin als potenzieller Kampfstoff („Hexa-Stoff“) verschossen.
Verwendung
Als Synthesechemikalie kann festes Triphosgen in Lösungsmitteln oft das hochgiftige gasförmige Phosgen ersetzen. Triphosgen wird zur Herstellung von Octalactin B verwendet.[3]
Einzelnachweise
- ↑ a b c d e f g h Datenblatt Bis(trichlormethyl)-carbonat bei Merck, abgerufen am 12. Juni 2018.
- ↑ Livius Cotarca, Heiner Eckert: Phosgenations – A Handbook. Wiley-VHC, Weinheim 2004, ISBN 3-527-29823-1, S. 23 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ P. T. O’Sullivan, W. Buhr, M. A. M. Fuhry, J. R. Harrison, J. E. Davies, N. Feeder, D. R. Marshall, J. W. Burton und A. B. Holmes: Total synthesis of Octalactin B. In: Journal of the American Chemical Society 2004, 126, 2194–2207. (engl.)
Auf dieser Seite verwendete Medien
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Strukturformel von Triphosgen


