Thioredoxin
| Humanes Thioredoxin | ||
|---|---|---|
 | ||
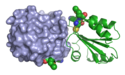
| Bändermodell (rechts), Oberflächenmodell (links) des Thioredoxin-Dimers (reduzierte Form) nach PDB 1AIU. Katalytische Aminosäuren 35–37 als Kalotten dargestellt. | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 104 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Bezeichner | ||
| Gen-Namen | TXN, TRDX, TRX | |
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Thioredoxin | |
| Übergeordnetes Taxon | Lebewesen | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 7295 | 22166 |
| Ensembl | ENSG00000136810 | ENSMUSG00000028367 |
| UniProt | P10599 | P10639 |
| Refseq (mRNA) | NM_001244938 | NM_011660 |
| Refseq (Protein) | NP_001231867 | NP_035790 |
| Genlocus | Chr 9: 110.24 – 110.26 Mb | Chr 4: 57.94 – 57.96 Mb |
| PubMed-Suche | 7295 | 22166 |
Thioredoxine sind kleine Proteine mit etwa 100 Aminosäuren und einer Disulfidbrücke als aktivem Zentrum, die als elektronenübertragende Kofaktoren in praktisch allen Organismen große Bedeutung haben. In der reduzierten Form agieren Thioredoxine enzymatisch als Oxidoreduktase. Beim Menschen sind zwei Thioredoxine bekannt, je nach Lokalisierung im Zytoplasma oder den Mitochondrien. Aus Studien an der Ratte gibt es Hinweise auf eine Rolle als Antioxidans und Regulator biomechanischer Signaltransduktion. Nicht zu verwechseln ist Thioredoxin mit der Familie von Proteinen, die eine Thioredoxin-Domäne enthalten.[1][2] Thioredoxin bindet an TXNIP.
In Pflanzen sind Thioredoxine maßgeblich an der Regulation des primären Kohlenstoffwechsels beteiligt: sie steuern unter anderem die Aktivität von Enzymen des Calvin-Zyklus, der Rubisco-Aktivase und unterstützen die Assemblierung der CF1-Untereinheit der ATP-Synthase.
Struktur
Thioredoxine sind etwa 12 kDa schwer. Sie tragen in ihrem aktiven Zentrum, das nach außen gerichtet ist, die Sequenz Cystein-Glycin-Prolin-Cystein, die für die Elektronenübergänge verantwortlich ist. Die beiden Cysteingruppen können zwei verschiedene Redoxzustände annehmen: Beim oxidierten Thioredoxin sind die Cysteinreste zu einer Disulfidbrücke verknüpft, reduziert liegen im Enzym zwei SH-Gruppen vor.
Einzelnachweise
- ↑ PROSITE documentation PDOC0172. Thioredoxin family. Swiss Institute of Bioinformatics (SIB), abgerufen am 12. August 2011 (englisch).
- ↑ Thioredoxin. In: Online Mendelian Inheritance in Man. (englisch)
Auf dieser Seite verwendete Medien
3d model of reduced thioredoxin dimer, left surface, right ribbons, with active residues 35-37 space filling, after PDB 1AIU. Ref.: J.F.Andersen et al. (1997). Human thioredoxin homodimers: regulation by pH, role of aspartate 60, and crystal structure of the aspartate 60 --> asparagine mutant.. Biochemistry, 36, 13979-13988. PMID 9369469 [DOI: 10.1021/bi971004s]