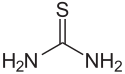
Thioharnstoff
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Thioharnstoff | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | CH4N2S | |||||||||||||||
| Kurzbeschreibung | weißer geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 76,12 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest[1] | |||||||||||||||
| Dichte | 1,41 g·cm−3 bei 20 °C[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | Zersetzung[1] | |||||||||||||||
| Löslichkeit | 137 g·l−1 bei 20 °C[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | nicht festgelegt[1] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | −89,1 kJ/mol[3] | |||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Thioharnstoff ist ein Derivat des Harnstoffs, dessen Sauerstoffatom durch ein Schwefelatom ersetzt ist.
Geschichte
Die Verbindung wurde erstmals 1869 durch den irischen Chemiker James Emerson Reynolds analog zur Wöhlerschen Harnstoff-Synthese aus Ammoniumthiocyanat hergestellt.[4][5]
Gewinnung und Darstellung
Thioharnstoff kann aus Ammoniumthiocyanat gewonnen werden, wobei die Auftrennung von Produkt und Edukt in der Gleichgewichtsreaktion schwierig ist.[6]

Die technische Synthese erfolgt durch das Einleiten von Schwefelwasserstoff und Kohlendioxid in eine wässrige Suspension von Calciumcyanamid.[6]
Eigenschaften
Physikalische Eigenschaften
Thioharnstoff bildet farblose und geruchlose Kristalle. Die Verbindung zeigt keinen scharfen Schmelzpunkt, da ab 153 °C eine Umlagerung zum Ammoniumthiocyanat erfolgt.[6] Die Literatur gibt Schmelzpunkte zwischen 167 °C und 182 °C an.[6] Thioharnstoff hat bei Raumtemperatur eine orthorhombische Kristallstruktur mit Raumgruppe Pnma (Raumgruppen-Nr. 62).[7] Das Kohlenstoff- und das Schwefelatom liegen auf einer Spiegelebene, sodass das Molekül die Punktgruppensymmetrie CS besitzt. Es ist beinahe planar und die Symmetrie somit näherungsweise C2v. Beim Abkühlen des Kristalls[8] oder bei hohem Druck[9] entstehen durch Fest-fest-Phasenübergänge Kristallstrukturen mit anderer Symmetrie.
Chemische Eigenschaften
Thioharnstoff ist eine organische Verbindung und ein Komplexbildner. Er tritt in zwei tautomeren Formen auf. In wässrigen Lösungen dominiert die Thionform (links):

Verwendung
Im Jahr 1993 betrug die weltweite jährliche Produktion 10.000 Tonnen.[10] Als reine Verbindung wird Thioharnstoff hauptsächlich (25 % der Produktion) zur Extraktion von Metallen wie Gold und Silber aus Erzen eingesetzt. Außerdem wird er als Hilfsstoff in Diazo-Papier (16 % der Produktion) und als Katalysator zur Isomerisierung von Maleinsäure in Fumarsäure verwendet (12 % der Produktion). Als Reaktant dient Thioharnstoff vor allem zur Herstellung von Thioharnstoffdioxid (27,5 % der Produktion.[11]). Weitere wichtige Anwendungen sind:
- Als Glanzzusatz in galvanischen Bädern[12]
- In der Analytik zum Nachweis von Bismut (Gelbfärbung in salpetersaurer Lösung)[13]
- Additiv in Sprengstoffen (Sprengschlamm)[10]
- Metallveredelung (Kupferveredelung)[10]
- Metallreinigung (Silberreinigung)[10]
- Modifikation von Harzen[10]
- Herstellung von Hilfsstoffen für die Textil- und Farbenindustrie[10]
- Herstellung von chemischen Zwischenstufen[10]
- Umsetzen zu Thiobarbituraten (Barbiturate, Arzneimittel wie etwa Thiopental) mittels Diethylmalonsäureesterderivate
- Trennung von n-Alkanen und iso-Alkanen in der Harnstoff-Extraktiv-Kristallisation[14]
Biologische Bedeutung
Thioharnstoff kann die Enzyme Tyrosinase und Urease hemmen.
Sicherheitshinweise
Thioharnstoff ist als krebserregend, Kategorie 2 (Verdacht auf karzinogene Wirkung beim Menschen) und reproduktionstoxisch, Kategorie 2 (Kann vermutlich das Kind im Mutterleib schädigen) eingestuft.[1] Er kann nur sehr schwer mit normalen Abwasserreinigungsmethoden aus Abwässern entfernt werden.
Weblinks
Einzelnachweise
- ↑ a b c d e f g h i j k Eintrag zu Thioharnstoff in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ Eintrag zu Thioharnstoff im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-20.
- ↑ J. E. Reynolds in J. Chem. Soc.22 (1869) 1.
- ↑ Rolf Werner Soukup: Chemiegeschichtliche Daten organischer Substanzen, Version 2020, S. 156 pdf.
- ↑ a b c d Mertschenk, B.; Knott, A.; Bauer, W.: Thiourea and Thiourea Derivatives, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2013; doi:10.1002/14356007.a26_803.pub3.
- ↑ M. R. Truter: Comparison of photographic and counter observations for the X-ray crystal structure analysis of thiourea. In: Acta Crystallographica. Band 22, Nr. 4, 1967, S. 556–559, doi:10.1107/S0365110X67001124.
- ↑ I. Takahashi, A. Onodera, Y. Shiozaki: Structural changes of thiourea in connection with its phase transitions: reappraisal of rigidity and libration of the molecule. In: Acta Crystallographica Section B. Band 46, Nr. 5, 1990, S. 661–664, doi:10.1107/S0108768190006012.
- ↑ T. Asahi, K. Hasebe, A. Onodera: Crystal Structure of the High Pressure Phase VI of Thiourea. In: Journal of the Physical Society of Japan. Band 69, 2000, S. 2895–2899, doi:10.1143/JPSJ.69.2895.
- ↑ a b c d e f g Concise International Chemical Assessment Document (CICAD) für Thiourea, abgerufen am 9. Dezember 2014.
- ↑ Herwig Hulpke, Herbert A. Koch, Reinhard Nießner: RÖMPP Lexikon Umwelt, 2. Auflage, 2000. Georg Thieme Verlag, 2014, ISBN 3-13-179342-2, S. 795 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Ullmanns Enzyklopädie: Ullmanns Enzyklopädie der technischen Chemie, Wiley Verlag.
- ↑ Jander/Blasius: Lehrbuch der analytischen und präparativen anorganischen Chemie, S. Hirzel-Verlag Stuttgart, 1985.
- ↑ Friedrich Asinger: Chemie und Technologie der Paraffinkohlenwasserstoffe. Akademie Verlag, 1956, S. 53–59.
Auf dieser Seite verwendete Medien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Struktur von Thioharnstoff
Tautomerie von Thioharnstoff
Struktur von Gleichgewicht zwischen Ammoniumthiocyanat und Thioharnstoff