Thermoproteota
| Thermoproteota | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 Sulfolobus tengchongensis, | ||||||||||
| Systematik | ||||||||||
| ||||||||||
| Wissenschaftlicher Name | ||||||||||
| Thermoproteota | ||||||||||
| Garrity & Holt 2021 |
Die Thermoproteota (früher auch „Crenarchaeota“ genannt, ursprünglich „Eozyten“ oder wissenschaftlich „Eocyta“) sind ein Phylum (Stamm bzw. Abteilung) einzelliger Lebewesen aus der Domäne der Archaeen (Archaea). Früher wurden die Thermoproteota ausschließlich für Extremophile gehalten (d. h. entweder (extrem) thermophil bzw. thermoacidophil oder psychrophil), jedoch zeigten weitere Untersuchungen, dass die Thermoproteota zu den häufigsten Archaeen im Meer gehören.[1] Diese Gruppe wird als mesophile, „marine Gruppe I“ bezeichnet.
Eigenschaften
Innerhalb der Thermoproteota findet man Organismen, die an extreme Umweltbedingungen angepasst und in Bereichen mit sehr hoher oder sehr niedriger Temperatur zu finden sind. Viele Vertreter leben im arktischen Plankton, wo sie bei Temperaturen oft unter 0 °C überleben. Diese Psychrophilen bzw. Kryophilen sind jedoch erst vereinzelt unter Laborbedingungen kultiviert worden. Eine andere Gruppe innerhalb der Thermoproteota lebt unter hyperthermischen Bedingungen, also bei Temperaturen von 80–110 °C, Pyrolobus fumarii lebt sogar bei 113 °C und überlebt auch einstündiges Autoklavieren. Viele der Thermoproteota wie z. B. Sulfolobus acidocaldarius tolerieren auch hohe Säurekonzentrationen (pH-Werte von 1–2) und sind damit thermoacidophil.
Einer der am besten charakterisierten Organismen der Thermoproteota ist Sulfolobus solfataricus (heute in eine andere Gattung transferiert, nun Saccharolobus solfataricus). Ursprünglich wurde dieser Organismus aus schwefelhaltigen heißen Quellen in Italien isoliert und wächst bei 80 °C und einem pH-Wert von 2–4.[2]
Da in ihrem Lebensraum oft kein organisches Substrat vorhanden ist, leben viele von der Fixierung von Schwefel, Kohlenstoffdioxid oder Wasserstoff. Andere können jedoch auch organisches Material verstoffwechseln. Bei der Kohlenstoffdioxidassimilation verwenden sie entweder den 3-Hydroxypropionat/4-Hydroxybutyratzyklus (z. B. Sulfolobus) oder den Dicarboxylat/4-Hydroxybutyratzyklus (z. B. Desulfurococcales oder Thermoproteales).[3]
Eine Reihe von Viren parasitiert Vertreter der Thermoproteota (oder ist zumindest mit diesen assoziiert), darunter zwei Familien der Ligamenvirales (Rudiviridae und Lipothrixviridae) und zwei Familien der Juravirales (Yangangviridae und Yanlukaviridae).
Etymologie
- Der Name Thermoproteota leitet sich ab von der Typusgattung Thermoproteus und damit von altgriechisch Θέρμηthermē, deutsch ‚Hitze‘ und dem griechischen Meeresgott ΠρωτεύςPrōteús, der – nach der Mythologie – verschiedene Formen annehmen konnte. Die Endung ‚-ota‘ kennzeichnet Stämme (Abteilungen bzw. Phyla).
- Die alte Bezeichnung „Crenarchaeota“ stammt von altgriechisch κρήνηςcrenos, deutsch ‚Ursprung‘ oder ‚Quelle‘, der Mittelteil verweist auf Archaeen, die Endung wieder auf ein Phylum: Es ist also ein Phylum urtümlich erscheinender Archaeen gemeint.
- Die Bezeichnung „Eocyta“ stammt von altgriechisch ἝωςHéōs, deutsch ‚Morgenröte‘ – im Sinn von Frühzeit (der Erde) – und κύτοςkýtos, deutsch ‚Gefäß‘, meint also Zellen der Urzeit.
Systematik
In den Jahren um 2017 fanden sich anhand von Metagenomik-Daten Hinweise auf eine Reihe weiterer Organismen und Linien, die mit den Thermoprotei [„Crenarchaeota“ s. a.] verwandt sind. Zunächst wurden gefunden:
- „Ca. Thaumarchaeota“ Brochier-Armanet et al. 2008[4]
- jetzt: Klasse Nitrososphaeria Stieglmeier et al. 2014 [„Thaumarchaea“] im Phylum Thermoproteota.
- „Ca. Augarchaeota“ corrig.Nunoura et al. 2011 [„Ca. Aigarchaeota“ Nunoura et al. 2011]
- Phylum „Ca. Verstraetearchaeota“ Vanwonterghem et al. 2016
- jetzt: Klasse „Ca. Methanomethylicia“ corrig.Vanwonterghem et al. 2016
- Phylum „Ca. Korarchaeota“"(G) Ludwig & Klenk 2001 bzw. S. M. Barns et al. 1996
- jetzt Klasse „Ca. Korarchaeia“ Rinke et al. 2021 (basal) im Phylum Themoproteota, evtl. aber weiter eigenes Phylum im TACK-Superphylum (jetzt Reich Thermoproteati).
Viele ursprünglich als Phyla angesehene Kladen gelten inzwischen (inhaltlich) als Klassen innerhalb der Thermoproteota. Da die bisherigen Namen mit der Endung ‚-ota‘ für Phyla stehen, gelten diese Bezeichner formal als Synonyme von ‚Thermoproteota‘ (Phylum).
Nach Einführung der taxonomischen Rangstufe ‚Reich‘ auch für Prokaryoten wurde 2024 die Bezeichnung Thermoproteota als einzig gültiger Name der vorliegenden Archaeengruppe festgelegt. Die Systematik nach der List of Prokaryotic names with Standing in Nomenclature (LPSN); ergänzt nach der Taxonomie des National Center for Biotechnology Information (NCBI) und der Genome Taxonomy Database (GTDB); ist wie folgt (Stand 14. Juni 2025):[7][8][6]
Phylum Thermoproteota Garrity & Holt 2021[9] [bzw. „Thermoproteota“ Whitman et al. 2018,
„Thermoproteaeota“ Oren et al. 2015, —
„Crenarchaeota“ Garrity & Holt 2001
„Ca. Geothermarchaeota“ Jungbluth et al. 2017,
„Ca. Korarchaeota“ Ludwig & Klenk 2001,[10]
„Xenarchaeota“[10]
„Nitrososphaeraeota“ Oren et al. 2015,
Nitrososphaerota Brochier-Armanet et al. 2021 bzw. „Nitrososphaerota“ Whitman et al. 2018,
„Ca. Thaumarchaeota“ Brochier-Armanet et al. 2008,
„Ca. Methanomethylicota“ corrig.Vanwonterghem et al. 2016,
„Ca. Verstraetearchaeota“ Vanwonterghem et al. 2016]
- Klasse „Ca. Bathyarchaeia“ McGonigle et al. 2019 [bzw. „Ca. Bathyarchaeia“ Khomyakova et al. 2023, „Ca. Bathyarchaeia“ Loh et al. 2021,
„Miscellaneous Crenarchaeotal Group“ (MCG)[11],
inhaltlich entsprechend dem früheren Phylum „Ca. Bathyarchaeota“ Meng et al. 2014[12][10] (nach LPSN herabgestuft)[A. 1]]

- ?Klasse „Ca. Korarchaeia“ Rinke et al. 2021 (vermutlich basal stehend, evtl. eigenes Phylum)
- Klasse „Ca. Methanomethylicia“ corrig.Vanwonterghem et al. 2016 [ „Ca. Methanomethylia“ Vanwonterghem et al. 2016]
- Klasse „Ca. Methanosuratincolia“ Wu et al. 2024
- Ordnung „Ca. Methanosuratincolales“ Wu et al. 2024
- Familie „Ca. Methanosuratincolaceae“ Wu et al. 2024
- Gattung „Ca. Methanosuratincola“ corrig.Vanwonterghem et al. 2016 [„Ca. Methanosuratus“ Vanwonterghem Vanwonterghem et al. 2016]
- Spezies „Ca. Methanosuratincola mesotaenarum“ Wu et al. 2024, mit
- Stamm GD_Cm_T35_P0_bin.90
- Spezies „Ca. Methanosuratincola petrocarbonis“ corrig.Vanwonterghem et al. 2016 [„Ca.Methanosuratus petracarbonis“ Vanwonterghem et al. 2016] (Typusart), mit
- Spezies „Ca. Methanosuratincola subterraneus“ corrig.Kadnikov et al. 2019 [„Ca. Methanosuratus subterraneum“ Kadnikov et al. 2019], mit
- Stamm Ch88 alias RXGA00000000
- Stamm LCB019-019 – Fundort: nahe Snort Spring,[16] Lower Culex Basin, Yellowstone-Nationalpark
- Spezies „Ca. Methanosuratincola thermotaenarum“ Wu et al. 2024, mit
- Stamm XY_C20_T55_P1_bin.49
- Spezies „Ca. Methanosuratincola verstraetei“ Kohtz et al. 2024, mit
- Stamm LCB70 – Fundort: Lower Culex Basin, Yellowstone-Nationalpark[14][15][13]
- Spezies „Ca. Methanosuratincola mesotaenarum“ Wu et al. 2024, mit
- Gattung „Ca. Methanosuratincola“ corrig.Vanwonterghem et al. 2016 [„Ca. Methanosuratus“ Vanwonterghem Vanwonterghem et al. 2016]
- Familie „Ca. Methanosuratincolaceae“ Wu et al. 2024
- Ordnung „Ca. Methanosuratincolales“ Wu et al. 2024

- Klasse Nitrososphaeria Stieglmeier et al. 2014
[Conexivisphaeria Kato et al. 2021,
„Soil Crenarchaeotic Group“ (SCG)[17][18][19],
inhaltlich entsprechend dem früheren Phylum „Nitrososphaeraeota“ Oren et al. 2015,
„Ca. Thaumarchaeota“ Brochier-Armanet et al. 2008[20][4]]
- Klasse Nitrososphaeria_A (GTDB: abgetrennt von Nitrososphaeria)
inhaltlich entsprechend dem früheren Phylum „Candidatus Augarchaeota“ corrig.Nunoura et al. 2011 (LPSN),
[„Ca. Aigarchaeota“ Nunoura et al. 2011[10] (LPSN)]
- Klasse Thermoprotei Reysenbach 2002
[„Thermoproteia“ Oren et al. 2016,
„Thermoprotea“ Oren et al. 2015,
inhaltlich entsprechend dem früheren Phylum Crenarchaeota Cavalier-Smith 2002[10] (s. s.),
„Filarchaeota“ Cavalier-Smith 2014[21] (als Subphylum)]
- in der LPSN ohne Klassenzuweisung, in der GTDB zur Klasse Nitrososphaeria (Details siehe dort), in der NCBI-Taxonomie in eigenem Phylum „Ca. Geothermarchaeota“
- ?Ordnung „Ca. Geothermarchaeales“ Adam et al. 2022
- in der LPSN Thermoproteota ohne Klassenzuweisung, in der NCBI-Taxonomie zu einem Phylum Nitrososphaerota [Aigarchaeota] ohne Klassenzuweisung, in der GTDB unbekannt[A. 2]
- ?Gattung „Ca. Gigantothauma“ corrig.Muller et al. 2010
„Ca. Giganthauma“ Muller et al. 2010- Spezies „Ca. Gigantothauma karukerense“ corrig.Muller et al. 2010
„Ca. Giganthauma karukerense“ Muller et al. 2010 (Typusart) - Spezies „Ca. Gigantothauma porcinsulae“ corrig.Muller et al. 2010
[„Ca. Giganthauma porcinsulae“ Muller et al. 2010]
- Spezies „Ca. Gigantothauma karukerense“ corrig.Muller et al. 2010
- ?Gattung „Ca. Gigantothauma“ corrig.Muller et al. 2010
- in der LPSN Thermoproteota ohne Klassenzuweisung
- Gattung „Candidatus Nitrosodeserticola“ Hwang et al. 2021
- Spezies „Ca. Nitrosodeserticola atacamensis“ corrig.Hwang et al. 2021
[„Ca. Nitrosodeserticola atacamae“ corrig.Hwang et al. 2021], mit- Stamm LB2
- Spezies „Ca. Nitrosodeserticola subpetralis“ Hwang et al. 2021, mit
- Stamm MB1
- Spezies „Ca. Nitrosodeserticola atacamensis“ corrig.Hwang et al. 2021
- Gattung „Candidatus Nitrosodeserticola“ Hwang et al. 2021
Anmerkungen
- ↑ in der NCBI-Taxonomie im Phylum Bathyarchaeota Meng et al. 2014 [MCG].
- ↑ In der NCBI-Taxonomie gehört diese Klade zum Phylum Nitrososphaerota des Reichs Thermoproteati (TACK-Superphylum); diese Klade wird in der LPSN als Klasse Nitrososphaeria bezeichnet − in Frage käme daher auch die GRDB-Abspaltung „Nitrososphaeria_A“.
Einzelnachweise
- ↑ Michael T. Madigan, John M. Martinko, Thomas D. Brock: Biology of Microorganisms. 11. Edition. Prentice Hall, 1. Januar 2005, ISBN 0-13-144329-1, 1088 Seiten (englisch)
- ↑ Wolfram Zillig, Karl O. Stetter, Simon Wunderl, Wolfgang Schulz, Harro Priess, Ingrid Scholz: The Sulfolobus-„Caldariellard“ group: Taxonomy on the basis of the structure of DNA-dependent RNA polymerases. In: Archives of Microbiology, Band 12, Nr. 3, April 1980, S. 259–269; doi:10.1007/BF00446886 (englisch).
- ↑ Ivan A. Berg, Daniel Kockelkorn, W. Hugo Ramos-Vera, Rafael F. Say, Jan Zarzycki, Michael Hügler, Birgit E. Alber, Georg Fuchs: Autotrophic carbon fixation in archaea. In: Nature Reviews Microbiology. Band 8, 10. Mai 2010, S. 447–460; doi:10.1038/nrmicro2365, PMID 20453874, ResearchGate:44583907 (englisch).
- ↑ a b Céline Brochier-Armanet, Bastien Boussau, Simonetta Gribaldo, Patrick Forterre: Mesophilic crenarchaeota: Proposal for a third archaeal phylum, the Thaumarchaeota. In: Nature Reviews Microbiology. Band 6, Nr. 3, März 2008, S. 245–252, doi:10.1038/nrmicro1852, PMID 18274537 (englisch).
- ↑ Céline Petitjean, Philippe Deschamps, Purificación López-García, David Moreira: Rooting the Domain archaea by phylogenomic analysis supports the foundation of the new kingdom proteoarchaeota. In: Genome Biology and Evolution, Band 7, Nr. 1, Januar 2015, S. 191–204; doi:10.1093/gbe/evu274, ResearchGate: 269819840, ePub: 19. Dezember 2014 (englisch).
- ↑ a b GTDB: Thermoproteota (Phylum).
- ↑ LPSN: Phylum Thermoproteota Garrity and Holt 2021.
- ↑ NCBI Taxonomy Browser: Thermoproteota, Details: Thermoproteota corrig. Garrity and Holt 2021 …, "Crenarchaeota" Woese et al. 1990, heterotypic synonym: Eocyta, …. Graphisch: Thermoproteota (Eozytes); auf: LifeMap.
- ↑ NamesforLife: Thermoproteota corrig. Garrity and Holt 2021.
- ↑ a b c d e Cindy J. Castelle, Jillian F. Banfield: Major New Microbial Groups Expand Diversity and Alter our Understanding of the Tree of Life. In: Cell. 172. Jahrgang, Nr. 6, 8. März 2018, S. 1181–1197, doi:10.1016/j.cell.2018.02.016, PMID 29522741 (englisch).
- ↑ Panagiotis S. Adam, Guillaume Borrel, Céline Brochier-Armanet, Simonetta Gribaldo: The growing tree of Archaea: new perspectives on their diversity, evolution and ecology. In: The ISME journal. Band 11, Nr. 11, November 2017, ISSN 1751-7370, S. 2407–2425, doi:10.1038/ismej.2017.122, PMID 28777382, PMC 5649171 (freier Volltext) – (englisch).
- ↑ NCBI Taxonomy Browser: Candidatus Bathyarchaeota (phylum), acronym: MCG, equivalent: Bathyarchaeota Meng et al. 2014.
- ↑ a b Kejia Wu, Lei Zhou, Guillaume Tahon, Laiyan Liu, Jiang Li, Jianchao Zhang, Fengfeng Zheng, Chengpeng Deng, Wenhao Han, Liping Bai, Lin Fu, Xiuzhu Dong, Chuanlun Zhang, Thijs J. G. Ettema, Diana Z. Sousa, Lei Cheng: Isolation of a methyl-reducing methanogen outside the Euryarchaeota. In: Nature, 24. Juli 2024; doi:10.1038/s41586-024-07728-y (englisch). Dazu:
- Carly Cassella: Whole New Group of Methane-Burping Microbes Discovered in Yellowstone Springs. Auf: sciencealert vom 31. Juli 2024.
- ↑ a b Anthony J. Kohtz, Nikolai Petrosian, Viola Krukenberg, Zackary J. Jay, Martin Pilhofer & Roland Hatzenpichler: Cultivation and visualization of a methanogen of the phylum Thermoproteota. In: Nature, Band 632, 29. August 2024, S. 1118–1123; doi:10.1038/s41586-024-07631-6, PMID 39048824; ResearchGate:368671014, ePub 24. Juli 2024 (englisch). Dazu:
- Unusual New Life Forms Discovered in Yellowstone Offer Clues to Alien Life. Auf: SciTechDaily vom 26. Juli 2024. Quelle: Montana State University.
- Montana State scientists publish evidence for new groups of methane-producing organisms. Auf: EurekAlert! vom 24. Juli 2024.
- Evelyn Boswell: MSU team discovers organism in Yellowstone hot spring potentially linked to earliest life on Earth. Montana State University (montana.edu) vom 4. März 2019.
- ↑ a b Carly Cassella: Whole New Group of Methane-Burping Microbes Discovered in Yellowstone Springs. Auf: sciencealert vom 31. Juli 2024.
- ↑ Snort Spring. Auf: GeoNames.
- ↑ Rüdiger Ortiz Álvarez, Emilio O. Casamayor: High occurrence of Pacearchaeota and Woesearchaeota (Archaea superphylum DPANN) in the surface waters of oligotrophic high-altitude lakes. In: Environmental Microbiology Reports. 8. Jahrgang, Nr. 2, April 2016, ResearchGate:288701274, S. 210–217, doi:10.1111/1758-2229.12370, PMID 26711582 (englisch).
- ↑ Archaea (domain), auf: SILVA – Datenbank des Deutschen Netzwerks für Bioinformatik-Infrastruktur (db.NBI).
- ↑ Keqiang Shao, Xingyu Jiang, Yang Hu, Xiangming Tang, Guang Gao: Thaumarchaeota affiliated with Soil Crenarchaeotic Group are prevalent in the alkaline soil of an alpine grassland in northwestern China. In: BMC: Annals of Microbiology, Band 69, 26. Juni 2019, S. 867–870; doi:10.1007/s13213-019-01492-5 (englisch).
- ↑ NCBI Taxonomy Browser: Thaumarchaeota (phylum).
- ↑ Thomas Cavalier-Smith: The neomuran revolution and phagotrophic origin of eukaryotes and cilia in the light of intracellular coevolution and a revised tree of life. In: Cold Spring Harbor Perspectives in Biology. 6. Jahrgang, Nr. 9, 2014, S. a016006, doi:10.1101/cshperspect.a016006, PMID 25183828, PMC 4142966 (freier Volltext) – (englisch).
Auf dieser Seite verwendete Medien
Autor/Urheber: Jong-Geol Kim, Khaled S. Gazi, Mart Krupovic, Sung-Keun Rhee, Lizenz: CC BY-SA 4.0
Thaspiviridae, species Nitmarvirus NSV1. Nitrosopumilus spindle-shaped virus 1 particles attached to the surface of a host cell. Scale bar, 200 nm
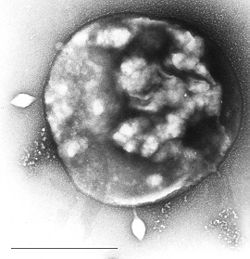
Cell of Sulfolobus infected by virus STSV1 observed under microscopy. Two spindle-shaped viruses were being released from the host cell. The strain of Sulfolobus and STSV1 (Sulfolobus tengchongensis Spindle-shaped Virus 1) were isolated by Xiaoyu Xiang and his colleagues in an acidic hot spring in Yunnan Province, China. At present, STSV1 is the largest archaeal virus to have been isolated and studied. Its genome sequence has been sequenced.
Korarchaeota, REM-Aufnahme einer Anreicherungskultur aus dem Obsidian Pool im Yellowstone Nationalpark