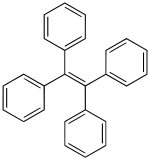
Tetraphenylethen
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tetraphenylethen | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C26H20 | ||||||||||||||||||
| Kurzbeschreibung | schwach gelber Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 332,44 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Schmelzpunkt | 222–224 °C[1] | ||||||||||||||||||
| Siedepunkt | 420 °C[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Tetraphenylethen, agebkürzt TPE, ist eine aromatische Verbindung. Die Verbindung ist ein synthetischer molekularer Motor.[2]
Darstellung
Die erstmalige Synthese wurde 1888 von P. de Boissieu beschrieben. In dieser wurde Diphenylmethan bromiert und das Produkt erhitzt, destilliert und umkristallisiert.[3][4]

Möglich ist auch eine Knoevenagel-Kondensation durch Umsetzen von Diphenylmethan mit n (n-BuLi) unter Kühlen mit anschließender Zugabe von Benzophenon und Dehydratisierung mittels p-Toluolsulfonsäure (PTSA).[5][4]

Die Synthese ist mittels einer McMurry-Reaktion möglich. Zur Synthese wird Benzophenon mit Titan(IV)-chlorid und Zink als Reduktionsmittel umgesetzt.

Verwendung
In der Forschung werden aktuell hauptsächlich die photochemischen Eigenschaften der Verbindung untersucht.[2][6][7] Während Lösungen der Verbindungen keine Lumineszenz zeigen, kann diese für den Festkörper oder Aggregate beobachtet werden. In Lösung können die Phenylringe um die Einfachbindung frei rotieren, wodurch nach der Literatur ein strahlungsfreier Übergang für die Relaxation der Elektronen im angeregten π-System gegeben ist.[8] Da im Festkörper die Rotation gehindert ist, steht dieser Relaxationsweg nicht zur Verfügung, weshalb es zur ausgeprägten Photolumineszenz kommt.[4] Derivate der Verbindung mit Adenin und Thymin wurden als molekularer Sensor für Silber und Quecksilberionen untersucht, nach Koordination des Ions wurden Fluoreszenz beobachtet.[9]
Einzelnachweise
- ↑ a b c d e Datenblatt 1,1,2,2-Tetraphenylethylene bei Sigma-Aldrich, abgerufen am 12. Juli 2020 (PDF).
- ↑ a b Young-Jae Jin, Hyojin Kim, Jong Jin Kim, Nam Ho Heo, Jong Won Shin, Masahiro Teraguchi,Takashi Kaneko, Toshiki Aoki,Giseop Kwak: Asymmetric Restriction of Intramolecular Rotation in Chiral Solvents. In: Cryst. Growth Des. Band 16, Nr. 5, März 2016, S. 2804–2809, doi:10.1021/acs.cgd.6b00128.
- ↑ P. de Boissieu: New method for the preparation of tetraphenylethylene. In: J. Chem. Soc. Band 54, 1888, S. 928–972.
- ↑ a b c Duong Duc La, Sidhanath V. Bhosale, Lathe A. Jones und Sheshanath V. Bhosale: Tetraphenylethylene-Based AIE-Active Probes for SensingApplications. In: ACS Appl. Mater. Interfaces. Band 10, Nr. 15, Oktober 2017, S. 12189–12216, doi:10.1021/acsami.7b1.
- ↑ Weizhi Wang, Tingting Lin, Min Wang, Tian-Xi Liu, Lulu Ren, Dan Chen und Shu Huang: Aggregation Emission Properties of Oligomers Based on Tetraphenylethylene. In: J. Phys. Chem. B. Band 114, 2010, S. 5983–5988, doi:10.1021/jp911311j.
- ↑ Natalia B. Shustova, Ta-Chung Ong, Anthony F. Cozzolino, Vladimir K. Michaelis, Robert G. Griffin, Mircea Dincă: Phenyl Ring Dynamics in a Tetraphenylethylene-Bridged Metal–Organic Framework: Implications for the Mechanism of Aggregation-Induced Emission. In: J. Am. Chem. Soc. Band 134, Nr. 36, August 2012, S. 15061–15070, doi:10.1021/ja306042w.
- ↑ Hongshen Yuan, Kai Wang, Bingbing Liu, Bo Zou: Luminescence Properties of Compressed Tetraphenylethene: The Role of Intermolecular Interactions. In: J. Phys. Chem. Lett. Band 5, Nr. 17, August 2014, S. 296–2973, doi:10.1021/jz501371k.
- ↑ Yuning Hong, Jacky W. Y. Lam, Ben Zhong Tang: Aggregation-induced emission. In: Chemical Society Reviews. Band 40, Nr. 11, 17. Oktober 2011, S. 5361–5388, doi:10.1039/C1CS15113D.
- ↑ Lei Liu, Guanxin Zhang, Junfeng Xiang, Deqing Zhang und Daoben Zhu: Fluorescence “Turn On” Chemosensors for Ag+ and Hg2+ Based on Tetraphenylethylene Motif Featuring Adenine and Thymine Moieties. In: Chem. Lett. Band 10, Nr. 20, August 2008, S. 4581–4584, doi:10.1021/ol801855s.
Auf dieser Seite verwendete Medien
McMurry-Reaktion 1
Structure of Tetraphenylethylene; 1,1,2,2-Tetraphenylethylene; Tetraphenylethene
Beispielhafter Syntheseweg um Tetraphenylethylen (TPE) mittels einer Aldol-Kondensation darzustellen
Weg von de Boissieu um Tetraphenylethylen (TPE) zu synthetisieren



