Tetraethylzinn
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tetraethylzinn | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C8H20Sn | |||||||||||||||
| Kurzbeschreibung | farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 234,96 g·mol−1 | |||||||||||||||
| Aggregatzustand | flüssig | |||||||||||||||
| Dichte | 1,187 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | 181 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | praktisch unlöslich in Wasser[1] | |||||||||||||||
| Brechungsindex | 1,473 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
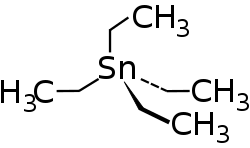
Tetraethylzinn ist eine chemische Verbindung aus der Gruppe der Zinnorganischen Verbindungen und hat die Konstitutionsformel Sn(C2H5)4.
Geschichte
Die Verbindung wurde erstmals im Jahr 1852 vom deutschen Chemiker Carl Löwig als Stannäthyl beschrieben.[3][4]
Gewinnung und Darstellung
Tetraethylzinn kann durch Reaktion von Ethylmagnesiumbromid mit Zinn(IV)-chlorid gewonnen werden.[5]
Eigenschaften
Tetraethylzinn ist eine entzündliche farblose Flüssigkeit, die praktisch unlöslich in Wasser ist.[1]
Reaktivität
Bei der Reaktion von Tetraethylstannan mit Iod entsteht Triethyliodstannan:[6]

Verwendung
Tetraethylzinn wird als Reaktionsgas im CVD-Verfahren zur Herstellung funktioneller Schichten und leitfähiger transparenter Schichten verwendet. Es wurde auch als Pestizid, Fungizid und Bakterizid verwendet.[7]
Es wurde in den 1920er Jahren kurzfristig für den Einsatz als Antiklopfmittel für Ottokraftstoffe untersucht, jedoch schnell durch das effektivere Tetraethylblei ersetzt.[8]
Sicherheitshinweise
Die Dämpfe von Tetraethylzinn können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 53 °C) bilden.[1] Im Körper wandelt es sich zu dem toxischeren Triethylzinn um.[9] Diese Verbindung wurde 1953/54 als neurotoxische Substanz bekannt, als in Frankreich 110 Todesfälle durch das bakterizid wirkende Präparat Stalinon auftraten, das 10 % Triethylzinn enthielt.[10] Triethylzinn hemmt die oxidative Phosphorylierung, die Glucose-Oxidation sowie den Einbau von Phosphaten in Phospholipide und ist immunotoxisch.[11]
Weblinks
Einzelnachweise
- ↑ a b c d e f g h i j Eintrag zu Tetraethylzinn in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Datenblatt Tetraethyltin, 97 % bei Sigma-Aldrich, abgerufen am 12. Januar 2012 (PDF).
- ↑ Rolf Werner Soukup: Chemiegeschichtliche Daten anorganischer Substanzen, Version 2020, S. 154 pdf.
- ↑ C. Löwig: Über Zinnäthyle in Ann. Chem. Pharm. 84 (1852) 308–335.
- ↑ G. J. M. Van Der Kerk and J. G. A. Luijten: Tetraethyltin In: Organic Syntheses. 36, 1956, S. 86, doi:10.15227/orgsyn.036.0086; Coll. Vol. 4, 1963, S. 881 (PDF).
- ↑ Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 552, ISBN 3-342-00280-8.
- ↑ Werner Baumann, Bettina Herberg-Liedtke: Chemikalien in der Metallbearbeitung. Springer, 1995, ISBN 978-3-540-60094-7, S. 1467 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Vaclav Smil Distinguished Professor University of Manitoba: Transforming the Twentieth Century : Technical Innovations and Their Consequences. Oxford University Press, 2006, ISBN 0-19-803775-9, S. 171 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Jill E. Cremer: The biochemistry of organotin compounds. The conversion of tetraethyltin into triethyltin in mammals. In: Biochem J. 68, 1958 (4), S. 685–692, PMC 1200418 (freier Volltext).
- ↑ Wolfgang Remmele, Günter Klöppel, Hans Kreipe und Werner Paulus: Pathologie: Neuropathologie. Springer, 2011, ISBN 978-3-642-02323-1, S. 373 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Burkhard Madea: Praxis Rechtsmedizin: Befunderhebung, Rekonstruktion, Begutachtung. 2006, ISBN 978-3-540-33719-5, S. 402 (eingeschränkte Vorschau in der Google-Buchsuche).
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Autor/Urheber: Jü, Lizenz: CC BY-SA 4.0
Synthese von Triethyliodstannan







