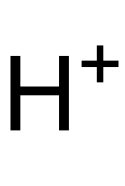Tetrachlorogoldsäure
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tetrachlorogold(III)-säure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | H[AuCl4] | |||||||||||||||
| Kurzbeschreibung | zitronengelbe, hygroskopische Nadeln[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 339,786 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | 3,9 g·cm−3 (Trihydrat)[1] | |||||||||||||||
| Schmelzpunkt | ca. 30 °C (Trihydrat)[1] | |||||||||||||||
| Löslichkeit | leicht in Wasser (150 g·l−1 bei 20 °C, Trihydrat)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Tetrachlorogoldsäure, HAuCl4 ist eine chemische Verbindung von Gold und Chlor und ein wichtiger Ausgangsstoff für andere Goldverbindungen.
Gewinnung und Darstellung
Die einfachste und wichtigste Gewinnungsart von Tetrachlorogoldsäure ist die Auflösung von elementarem Gold in Königswasser, einer Mischung aus Salz- und Salpetersäure. Nitrosylchlorid – das aktive Reagens in Königswasser – muss durch Abrauchen mit Salzsäure entfernt werden, wobei Nitrose Gase bzw. Stickstoffdioxid entweichen:[2]
Eine weitere Möglichkeit, Tetrachlorogoldsäure darzustellen, ist die Reaktion von Gold(III)-chlorid und Salzsäure.[2]
Eigenschaften

Tetrachlorogoldsäure kristallisiert in langen, hellgelben Nadeln, die in feuchter Umgebung leicht zerfließen. In Wasser und Ethanol löst sie sich leicht.[2] Sie besitzt eine monokline Kristallstruktur mit der Raumgruppe P21/c (Raumgruppen-Nr. 14) (a = 6,57, b = 11,6, c = 15,0 Å, β = 104°).[3]
Verwendung
Da sich Tetrachlorogoldsäure leicht gewinnen lässt, dient sie als Ausgangssubstanz zur Herstellung anderer Goldverbindungen, oder von Gold-Nanopartikeln. In der Photographie wird sie für Tonbäder verwendet, um einen purpurnen Farbton des Fotos zu erhalten. Auch für die Vergoldung kann Tetrachlorogoldsäure eingesetzt werden.[2]
Sicherheit
Gelangt Tetrachlorogoldsäure auf die Haut, wird diese unter Blasenbildung verätzt. Lichteinstrahlung auf die betroffene Stelle verfärbt diese violett.[2]
Einzelnachweise
- ↑ a b c d e f Eintrag zu Tetrachlorogold(III)-säure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 16. August 2022. (JavaScript erforderlich)
- ↑ a b c d e Eintrag zu Gold-Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Mai 2014.
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1014.
Auf dieser Seite verwendete Medien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Struktur des Tetrachloridoaurat-Ions
Struktur des H+-Ions (Proton)