Tauopathie

Die Gruppe der Tauopathien umfasst eine Gruppe neurodegenerativer Krankheitsbilder, deren gemeinsames Merkmal die Ansammlung von Tau-Proteinen im Gehirn ist.
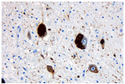
Bei der mikroskopischen Untersuchung des Hirngewebes von Erkrankten findet man diese Tau-Protein-Ablagerungen in Nerven- und Gliazellen. Sie treten häufig als neurofibrilläre Bündel (engl. neurofibrillary tangles) auf. Sie lassen sich mit Spezialfärbungen (z. B. Versilberungen, weil sie argyrophile Strukturen sind) oder immunohistochemisch mit Antikörpern gegen Tau-Proteine sichtbar machen. Das Elektronenmikroskop zeigt, dass es – je nach Erkrankung – verschiedene Typen von Neurofibrillenbündeln gibt. Es existieren je nach Isoform unterschiedliche Tau-Ablagerungsprodukte. Eine häufige Einteilung erfolgt nach der Anzahl bestimmter Wiederholungen an der Mikrotubuli-Bindungstelle. Nach der Anzahl dieser Tandem-Repeats werden Tauopathien oft in 3R- oder 4R-Tauopathien weiter unterteilt.

Tauopathien gehören zu den Amyloidosen, bei denen sich Proteine in eine alternative Struktur, die β-Helix, falten. Dies kann spontan erfolgen (altersbedingt) oder infolge von ererbten Mutationen im Protein (mit deutlich jüngeren Patienten). Das umgefaltete Protein präzipitiert dann als Amyloid (so benannt von Rudolf Virchow, weil die Partikel wie Stärke mit Jodtinktur eine Blaufärbung geben[1]).
Die Ursache der meisten Tauopathien ist unbekannt. Einige Tauopathien sind erblich. So findet man z. B. über 60 verschiedene Mutationen des Tau-Gens bei Patienten mit FTLD-MAPT.
Zur Gruppe der Tauopathien zählen:
- Chronisch-traumatische Enzephalopathie (CTE, früher auch Dementia pugilistica) genannt
- FTLD-MAPT (früher: FTDP-17, Frontotemporale Demenz und Parkinsonismus des Chromosoms 17)
- Kortikobasale Degeneration (CBD: 4R-Tau)
- Morbus Alzheimer
- Morbus Pick (3R Tau)
- Neurofibrilläre Tangle-Demenz
- Progressive supranukleäre Blickparese (PSP: 4R-Tau)
- Silberkornkrankheit (AGD: 4R-Tau)
- Tauopathie mit gliobulären glialen Einschlüssen
- Unklassifizierbare Tauopathien
Siehe auch
Literatur
- T. Lebouvier, F. Pasquier, L. Buée: Update on tauopathies. In: Curr Opin Neurol. Band 30, Nr. 6, Dezember 2017, S. 589–598, doi:10.1097/WCO.0000000000000502, PMID 28914736.
- M. E. Orr, A. C. Sullivan, B. Frost: A Brief Overview of Tauopathy: Causes, Consequences, and Therapeutic Strategies. In: Trends Pharmacol Sci. Band 38, Nr. 7, Juli 2017, S. 637–648, doi:10.1016/j.tips.2017.03.011, PMID 28455089.
- Y. Wang, E. Mandelkow: Tau in physiology and pathology. In: Nat Rev Neurosci. Band 17, Nr. 1, Januar 2016, S. 5–21, doi:10.1038/nrn.2015.1, PMID 26631930.
Einzelnachweise
- ↑ Rudolf Virchow: Ueber eine im Gehirn und Rückenmark des Menschen aufgefundene Substanz mit der chemischen Reaction der Cellulose. In: Archiv für pathologische Anatomie und Physiologie und für klinische Medicin. Band 6, Nr. 1, 1. März 1854, ISSN 0720-8723, S. 135–138, doi:10.1007/bf01930815 (springer.com [abgerufen am 31. Oktober 2017]).
Auf dieser Seite verwendete Medien
Autor/Urheber: Ebuxbaum, Lizenz: CC BY-SA 4.0
3-dimensionale Struktur des tau-Proteins aus den neurofibrillären Bündeln eines Alzheimer-Patienten, bestimmt durch Cryo-Elektronenmikroskopie (PDB-code 5o3t). Die Abbildung wurde mit DeepView erstellt.
Autor/Urheber: Marvin 101, Lizenz: CC BY-SA 2.0 de
Nachweis von hyperphposphorylierten Tau-Protein in Nervenzellen bei einer Tauopathie, hier (Corticbasale Degeneration).