Kelpwald


Ein Kelpwald (englisch kelp forest), auch Tangwald oder Algenwald genannt, ist ein in den Uferzonen von Meeren der gemäßigten Breiten auftretendes Ökosystem. Namensgebend ist der Seetang, darunter insbesondere einige groß wachsende mehrzellige Algen aus der Ordnung der Laminariales.[1] Die im Tangwald heimischen Algen sind überwiegend Braun‑ und Rotalgen. Sie bieten Lebensraum für eine Vielzahl von Fischen und Wirbellosen und spielen darüber hinaus für das Überleben verschiedener Vogelarten eine Rolle. Fressfeinde, wie Seeigel, Fischerei und die Erwärmung des Wassers unter anderem im Rahmen der El Niño-Southern Oscillation gefährden den Bestand der Unterwasserwälder aus Makroalgen.
Verbreitung
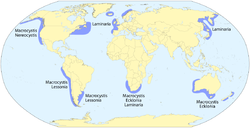

Eine wichtige Voraussetzung für die Tangwälder sind die lokalen Eigenschaften des Meeres: Die meisten mehrzelligen Algenarten benötigen ruhiges Wasser, weil sie bei zu starker Strömung keinen Halt finden würden. Es muss reich an Nährstoffen sein. Da Licht für die Photosynthese benötigt wird, muss das Wasser sehr klar sein, aus dem gleichen Grund befinden sich die Algenwälder in seichtem Wasser, das selten tiefer als 15 bis 40 Meter ist. Am häufigsten sind sie auf felsigem Boden anzutreffen, auf dem die Pflanzen leicht Halt finden. Im Gegensatz zu den Korallen benötigen sie eine niedrige Wassertemperatur. Die größeren Wälder befinden sich in kalten Gewässern, eine durchschnittliche Temperatur von 20 °C gilt als die Obergrenze.[2]
Die marinen Wälder wachsen an der gesamten Westküste Amerikas, von den Aleuten in Alaska bis zur Magellanstraße, allerdings wegen ihrer Abhängigkeit von einer eher ruhigen Strömung nie durchgängig. Besonders ausgeprägt sind die Tangwälder vor Kalifornien, zwischen San Diego und Santa Cruz und dort besonders in der Monterey Bay. Diese sind auch am besten erforscht, da unter anderem die Universitäten der beiden Städte dort Untersuchungen durchführen.
Im Atlantik sind sie vor der Küste von Argentinien zu finden. Vor der Westküste Südafrikas, teilweise im Indischen Ozean, vor der Südküste Australiens, vor Neuseeland und teilweise vor der Antarktis befinden sich weitere Algenwälder.
In Europa sind Tangwälder von Island, Orkney und Norwegen nach Süden bis zur Nordwestküste von Afrika verbreitet.[3] Vor Norwegen bewachsen sie eine Fläche von mehreren tausend Quadratkilometern. In der Nordsee und Ostsee sind sie auf Küsten mit felsigem Meeresgrund beschränkt. Das einzige Vorkommen in der Deutschen Bucht liegt bei Helgoland (Naturschutzgebiet Helgoländer Felssockel).[4] (Siehe auch Liste der Meeresalgen von Helgoland). Die Unterwasserwälder reichen auf Helgoland bis maximal 10 m Wassertiefe hinab, im klareren Mittelmeer bis zu 120 m. In der Ostsee sind Tangwälder beispielsweise im Biosphärenreservat Südost-Rügen zu finden.[5]
Merkmale
Die Großalgen, die das Ökosystem dominieren, bestehen aus drei wesentlichen Teilen: dem krallenartigen Haftorgan auf dem Boden (Rhizoid), diesem schließt sich der biegsame Stängel (Cauloid) an und an der Wasseroberfläche befinden sich blattähnliche Wedel (Phylloid). Diese Teile bilden gleichzeitig die auch für normale Wälder typische Schichtung in mehrere Lebensräume: Oben – teilweise sogar an der Wasseroberfläche – bilden die Wedel von größeren Tangen die Baumkrone. Dazwischen liegt der Mittelbau der Stängel im schemenhaften Licht, in dem sich zahlreiche Fischarten tummeln. Darunter befindet sich der dunkle Meeresboden. Ähnlich den Korallenriffen ist der Kampf um das Licht oder auch das Schattenwerfen ein wichtiger Mechanismus im Wettbewerb zwischen verschiedenen Arten, aber auch verschiedenen Lebewesen gleicher Art.
Einzelne Algen erreichen eine große Höhe, der Riesentang (Macrocystis pyrifera) kann bis zu 45 Meter lang werden und dabei ein Wachstum von 30 bis zu 50 cm pro Tag erreichen. Das schnelle Wachstum führt zu einer sehr wechselhaften Vegetation und einem häufigen Wandel des Waldes zwischen den Jahreszeiten. Stürme im Herbst und Winter reißen alte Wedel der Krone aus, sodass mehr Licht zum Boden gelangt. Dabei kann es auch dazu kommen, dass sich das Haftorgan vom Boden löst und der Tang beginnt, frei herumzuschweben. Die Pflanze schwebt dann zur Oberfläche und wächst weiterhin, bis sie strandet oder zu warmes Wasser erreicht. Dabei kann sie einen Sammelpunkt vieler Meerestiere bilden.
Ökologie

Kelpwälder gelten als submarine Gegenstücke der Regenwälder, weil sie ebenfalls eine große Artenvielfalt und eine ähnliche vertikale Struktur aufweisen. Der Molekularbiologe J. Craig Venter errechnete aus neu gefundenen Genen über 1000 unentdeckte Arten allein in der Sargassosee. Demzufolge könnten sich in Tangwäldern weltweit noch mehrere Tausend bislang unbeschriebene Arten befinden. Darunter fallen vor allem viele Mikroorganismen des Phytoplanktons.
Unterschiedliche Typen
Die Tangwälder haben gewöhnlich eine komplexe räumliche Struktur mit vielen koexistierenden Gattungen, auf die der Begriff „Wald“ am besten zutrifft. Im Ost- und Nordpazifik dominiert oft die einjährige Nereocystis luetkeana (Bullkelp), die auch stärkeren Strömungen trotzt. Im Tangwald vorkommende Algen wie Riesentang (Macrocystis) und Nereocystis haben Schwimmkörper, die ihre Wedel an der Wasseroberfläche halten, um effektiver Photosynthese betreiben zu können. Dabei beginnen die Algen weiter in die Breite zu wachsen. Es kann neben den durch die Wedel entstehenden Kronen weitere ausgeprägte vertikale Schichten geben.
Auf der Nordhalbkugel dominieren niedrigere Tangwälder aus Laminaria-Arten[3], in der Nordsee und Ostsee sind dies Palmentang (Laminaria hyperborea), Fingertang (Laminaria digitata) und Zuckertang (Saccharina latissima, Syn. Laminaria saccharina). Vor Alaska kann es, wenn der Tang von Seeigeln ungestört ist, dazu kommen, dass der perennierende Tang Laminaria groenlandica die Oberhand gewinnt und anderen Arten das Licht nimmt.
Tangwälder an der Atlantikküste von Nordamerika treten nicht mit einer so hohen Artenvielfalt auf, sind dafür aber üppig und unterstützen reiche Gemeinschaften von benthischen Wirbellosen. Sie reichen dort nach Süden bis Cape Cod und tauchen nur sporadisch am östlichen Ende von Long Island auf.
In der Sargassosee, im Atlantik, kommt kein Wald aus Riesentangen vor, sondern stattdessen frei im Wasser schwebende Braunalgen der Gattung Golftange (Sargassum, aus der Ordnung der Fucales). Deshalb ist hier die allgemeine Bezeichnung „Algenwald“ oder auch „Sargassumwald“ zutreffender. Die Sargassosee stellt einen besonderen Lebensraum für kleine Krabben, Würmer und andere Meerestiere dar. Die Planktonproduktion ist hier bedeutend: Es wird geschätzt, dass ein Drittel der Planktonproduktion des Atlantiks in der Sargassosee erfolgt.
Artenvielfalt

Der Kelpwald bietet für viele Lebewesen ein Habitat, beispielsweise für Chordatiere, Gliederfüßer, Ringelwürmer, Stachelhäuter, Moostierchen, Nesseltiere, Weichtiere, Plattwürmer, Armfüßer und Schwämme.[3]
Algen sind Vitaminlieferanten und darüber hinaus reich an Eiweiß und Spurenelementen. Algen sind sowohl für Menschen (besonders in Asien) als auch für zahlreiche Tiere ein wichtiges Nahrungsmittel. Vor allem setzt abgestorbener Tang gelöste organische Feststoffe frei. Bis zu 80 % des Tangs werden losgerissen und in Regionen mit niedriger Primärproduktion getrieben, wo sie ebenfalls eine wichtige Nahrungsquelle sind.[6]
Selbst während und nach der Zersetzung dienen die Algen als Nahrung für sogenannte Suspensionsfresser, die sich von organischen Zerfallsprodukten ernähren.[7]
Ein Teil des im abgetriebenen Tang enthaltenen, durch Photosynthese aufgenommenen Kohlenstoffs gelangt in die Tiefsee und wird dort in Sedimenten abgelagert.[8] Damit spielen Tangwälder, zusammen mit anderen küstennahen Ökosystemen, eine nicht zu vernachlässigende Rolle in der Funktion der Ozeane als Kohlenstoffsenke und damit für das Weltklima.[9][10][11]
Das für die Tangwälder charakteristische, meist langsam fließende Wasser sorgt für große Ansammlungen von Plankton und weiteren benthischen Wirbellosen sowie Mikroorganismen. Auf dem Tang selbst, bevorzugt auf den großen Wedeln, leben häufig Epizoen, also Aufsitzertiere wie Seeanemonen und Moostierchen, auf den Stielen siedeln zahlreichen Algenarten (Epiphyten). Der Meeresboden ist gesäumt von Schwämmen und Moostierchen.
Unter den vom Tangwald abhängigen Tieren befinden sich Pflanzenfresser und Filtrierer wie Muscheln, Moostierchen, Vielborster, Meeresschnecken und Krebse, von denen sich in der Nahrungskette größere Tiere ernähren können. In den Wäldern fallen vor der Küste Südafrikas besonders die Abalonen auf. Die Pflanzenfresser ernähren sich vom Tang oder anderen Algen, die im Tangwald wachsen.
Im Mittelbau des Tangwalds tummeln sich zahlreiche Fischarten aller Größen, die zumeist Fleischfresser bzw. Räuber sind, wie Seepferdchen und Seedrachen, Lippfische und Feilenfische.[12] Unter anderem ernährt sich der zu den Riffbarschen gehörende Blacksmith (Chromis punctipinnis) von Parasiten des Tangs. Hummer sind dort ebenfalls anzutreffen. Derartige Arten ziehen Jäger wie den Blauhai, die Große Bernsteinmakrele (Seriola lalandei) und den Mondfisch an. Es werden Wale, die sich vom Plankton ernähren, gesichtet, Rochen wie beispielsweise der Adlerrochen oder auch Zitterrochen, die zwischen dem Tang nach Beute suchen. Der Riesentang bietet aber auch Verstecke und Niststätten für viele Meeresbewohner: So suchen beispielsweise Jungfische und Fliegende Fische Zuflucht – auch inmitten frei driftendem Seetangs. Delfine, wie den Weißstreifendelfin, hat man beim Spielen mit Stücken umhertreibenden Tangs beobachtet. Auch sie nutzen die Wälder als Verstecke. Seeotter ernähren sich unter anderem vom Seeigel, der ein großer Fressfeind des Tangs ist.[13] Die reichlich vorhandenen Seesterne verspeisen gleichfalls Seeigel. Darüber hinaus jagen Seevögel wie Kormorane Fische in den Tangwäldern.
Bedrohungen
Das sensible Ökosystem der submarinen Wälder ist zahlreichen Bedrohungen ausgesetzt. Verschmutztes Süßwasser aus den Flüssen trägt Pestizide, Herbizide und weitere Chemikalien ins Meer und die unterschiedlichen Lebensräume. Dadurch wird das natürliche Gleichgewicht gestört, die Artenvielfalt gemindert und der stabile Fortbestand des Ökosystems bedroht.
Klimawandel
Durch globale Erwärmung sind alle marinen Ökosysteme, zu denen neben Algenwäldern auch Seegraswiesen oder Korallenriffe zählen, sowohl von Erwärmung (siehe Marine Hitzewelle) als auch von Versauerung betroffen. Meeresbiologen gehen mittlerweile davon aus, dass die räumliche und zeitliche Zunahme anomal warmer Meerestemperaturen, die acquatischen Ökosysteme verändern werden, da sie sich auf die geographische Verbreitung von Meeresbewohnern auswirkt.[14]
Aufgrund der Erderwärmung zählen Seegraswiesen und Kelpwälder zu den am schnellsten verschwindenden Ökosystemen. Ihr Absterben setzt noch dazu gebundene Treibhausgase frei, was den Prozess der Erderwärmung weiter vorantreibt.[15]
Bereits im Jahr 2011 ging durch die marine Hitzewelle Ningaloo-Niño vor der Küste Westaustraliens ein Algenwald von mehr als 100 km Länge verloren.[16][17]
Die Intensität und Häufigkeit von Meeresstürmen, die Wälder aus Riesentang und andere Großalgengemeinschaften beschädigen und vernichten nimmt zu. Ein amerikanisches Forscherteam der Universität von Virginia und der Universität von Kalifornien konnte durch eine Langzeitsimulation nachweisen, welche Auswirkungen der Rückschnitt der Algenwälder, durch welchen Sturmschäden nachgeahmt wurden, auf die Artenvielfalt hat. Eine Verdoppelung kleiner Pflanzen und Wirbelloser wie Korallen, Seeanemonen und Schwämmen war die Folge, sowie ein Rückgang um 30 bis 60 Prozent bei Fische und Krebstieren. Während sich die Algenwälder nach vereinzelten Stürmen relativ gut erholten, hat die Zunahme der Stärke und Häufigkeit massive Auswirkungen; so geht nicht nur die Zahl der Fische zurück, auch Hummer, Meeresschnecke und Muscheln werden weniger.[18]
Veränderungen von Meeresströmungen, wie dem Ostaustralstrom bringen ebenfalls einen Rückgang der betroffenen Kelpwälder sowie eine Zunahme der Seeigel mit sich, da so immer mehr warmes Wasser die Küsten Tasmaniens erreicht.[19]
Veränderte Bedingungen für Fressfeinde
Diademseeigel zählen zu den Fressfeinden der Großalgen. Sie profitieren, unter anderem vor Australien von den veränderten Meeresströmungen und steigenden Wassertemperaturen, bei denen sie sich z. B. vor Tasmanien massenhaft vermehren konnten, bis sie den gesamten Meeresboden bedeckten. Auch vor der Küste der japanischen Insel Hokkaido gibt es solche Meeresbereiche, die auch als Seeigelwüste bezeichnet werden.[17][20] Die Artenvielfalt nimmt auch dort ab, wo die Seeigel die Algenwälder lediglich abgeweidet haben und so den Lebensraum von Tieren wie z. B. Hummern zerstören.[19]
Doch auch Seeigel haben Fressfeinde, vor Kalifornien werden sie unter anderem durch Seeotter und Sonnenblumenseesterne dezimiert. Nach einem Massensterben der Seesterne vermehrten sich die Seeigel so stark, dass auch die Otter die Bildung von Seeigelfeldern und eine umfangreiche Schädigung der pazifischen Kelpwälder nicht verhindern konnten, zumal die Otter bevorzugt Seeigel verspeisen, die sie in möglichst intakten Unterwasserwäldern erbeuten.[21]
Überangebot von Nährstoffen
Üppige Nährstoffeinträge, durch die Einleitung von Abwässern oder die Überfischung von Tieren, die sich von Algen ernähren, können zu massivem Wachstum der Großalgen führen. In der Folge werden Korallenriffe überwuchert oder der bakterielle Abbau der organischen Algenbiomasse führt zu Sauerstoffarmut im Wasser.[22]
Nutzung von Algenbeständen

Die weltweite, kommerzielle Produktion von Makroalgen liegt bei mehr als 30 Millionen Tonnen pro Jahr, die fast vollständig in Asien angebaut werden – wobei die dort angewendeten Methoden nicht immer umweltfreundlich sind. Dagegen macht die europäische Produktion bisher nur etwa ein Prozent des weltweiten Handelsvolumens aus, wobei sowohl gezüchtete Algen als auch Algen aus Wildbeständen erhältlich sind. Insgesamt handelt es sich um einen Industriezweig, dessen Umfang und Bedeutung weiterhin zunehmen werden.[23]
Asien
Rotalgen der Gattung Pyropia (insbesondere Pyropia tenera) werden in Asien häufig verzehrt und ihre Nutzung als Nahrungsmittel hat dort eine lange Tradition. Durch ihre Verwendung bei Sushi wird die weltweite Nachfrage mittlerweile auch durch gezielten Anbau in Aquakulturen gedeckt. Südkorea zählt zu den Ländern, die so intensiv anbauen, dass man die Algenfarmen deutlich auf Satellitenbildern erkennen kann.[24]
Europa
In Europa hat der Anbau von Algen noch keine nennenswerte Tradition. Nach der Jahrtausendwende sind jedoch vor Sylt und in den Niederlanden Algenfarmen entstanden, in denen marine Makroalgen angebaut und überregional vertrieben werden. In den Niederlanden setzt das Unternehmen, welches Lebensmittelproduzenten die Algen in Form von Trockenflocken verkauft, dabei gezielt auf nachhaltige Produktion und verzichtet, beim Anbau von Zuckertang auf die Zugabe von Chemikalien. Mittlerweile besteht eine Kooperation mit norwegischen Zuckertangzüchtern.[25][23]
Nordamerika
Vor dem amerikanischen Küsten, wird sowohl Meersalat, als auch die mit dem Zuckertang verwandte Algenart Saccharina sessilis, aus der Gattung Saccharina, kommerziell genutzt. Dabei gelten sowohl für die Erntemenge als auch für die angewendeten Methode Vorschriften, die je nach Bundesstaat variieren. Die kommerzielle Nutzung von Seegräsern und See-Palmen ist, unter anderem in Kalifornien, mittlerweile verboten. In Meeresschutzgebieten darf keine Art von Algen geerntet werden.[26]
In British Columbia sind es unter anderem junge Kelpfarmer, die auf die Gefährdung der Bestände hinweisen und nach Möglichkeiten für den dauerhaften Erhalt der Kelpwälder, bei gleichzeitiger Bewirtschaftung, zu suchen. Neben der Vermarktung von Kelp als Nahrungsmittel, beruft sich der Jungunternehmer zusätzlich auf dessen Effekt als Kohlenstoffsenke.[27]
Literatur
- Sektion Phykologie der Deutschen Botanischen Gesellschaft: Seetang Laminaria ist Alge des Jahres 2007. Pressemitteilung 2007.
- Paul Dayton: Annual Review of Ecology and Systematics. Ecology of Kelp Communities (PDF; 3,6 MB): 16 (1985); S. 215–245.
- George Karleskint et al. Introduction to Marine Biology (2009), ISBN 0-495-56197-5.
- Ronald McPeak, Dale A. Glantz, Carole Shaw: Amber Forest the Beauty and Biology of California's Submarine Forest. Watersport, San Diego CA 1988, ISBN 0-922769-00-1.
- Jeannie Baker: The Hidden Forest. Greenwillow Books, New York 2000, ISBN 0-688-15760-2 (Roman).
- Aaron Eger, Cayne Layton, Tristin Anoush McHugh, Mary Gleason, Norah Eddy: Kelp Restoration Guidebook: Lessons Learned from Kelp Projects Around the World. The Nature Conservancy, Arlington 2022, ISBN 978-0-578-38123-7 (online).
Weblinks
- Kelp Forest Alliance (englisch)
- Marine Education Society Australia (englisch)
- Monterey Bay National Marine Sanctuary (englisch)
- Alastair Bland: Das Sterben der Urwälder im Meer In: www.taz.de, 4. Januar 2018: „Besorgt beobachten Wissenschaftler, wie riesige Tangwälder vor den Küsten verschwinden. Übrig bleibt abgefressenes Ödland auf dem Meeresgrund“
- Spektrum.de: Das verkannte Riff 28. September 2019
Einzelnachweise
- ↑ Dayton, Seite 215.
- ↑ Karleskint, Seite 447.
- ↑ a b c Robert Steneck (2002): Kelp forest ecosystems: biodiversity, stability, resilience and future. Environmental Conservation 29 (4): 436–459 (2002) doi:10.1017/S0376892902000322
- ↑ P. Kornmann, P.H. Sahling: Meeresalgen von Helgoland – Benthische Grün-, Braun- und Rotalgen. Biologische Anstalt Helgoland, Hamburg 1983, ISSN 0017-9957
- ↑ Biosphärenreservat Südost-Rügen – Lebensräume.
- ↑ Karen Filbee-Detxer, Thomas Wernberg: Rise of Turfs: A New Battlefront for Globally Declining Kelp Forests. In: BioScience. Februar 2018, doi:10.1093/biosci/bix147.
- ↑ William R. Miller & H. Page (2012): Kelp as a trophic resource for marine suspension feeders: a review of isotope-based evidence. Marine Biology, [s. l.], v. 159, n. 7, p. 1391–1402, 2012, doi:10.1007/s00227-012-1929-2
- ↑ Ina Frings: Seetang und Kohlenstoffspeicherung. In: Helmholtz. 5. Juni 2024, abgerufen am 14. Oktober 2024 (deutsch).
- ↑ John Raven: Blue carbon: past, present and future, with emphasis on macroalgae. In: Biology Letters. Oktober 2018, doi:10.1098/rsbl.2018.0336.
- ↑ Dorte Krause-Jense u. a.: Sequestration of macroalgal carbon: the elephant in the Blue Carbon room. In: Biology Letters. Juni 2018, doi:10.1098/rsbl.2018.0236.
- ↑ Karen Filbee-Dexter, Albert Pessarrodona, Morten F. Pedersen, Thomas Wernberg, Carlos M. Duarte, Jorge Assis, Trine Bekkby, Michael T. Burrows, Daniel F. Carlson, Jean-Pierre Gattuso, Hege Gundersen, Kasper Hancke, Kira A. Krumhansl, Tomohiro Kuwae, Jack J. Middelburg, Pippa J. Moore, Ana M. Queirós, Dan A. Smale, Isabel Sousa-Pinto, Nobuhiro Suzuki, Dorte Krause-Jensen: Carbon export from seaweed forests to deep ocean sinks. In: Nature Geoscience. Band 17, Nr. 6, Juni 2024, ISSN 1752-0908, S. 552–559, doi:10.1038/s41561-024-01449-7 (nature.com [abgerufen am 14. Oktober 2024]).
- ↑ Marine Education Society of Australasia 4. Species Composition – Consumers, aufgerufen am 21. Januar 2011.
- ↑ Jamie Womble: A Keystone Species, the Sea Otter, Colonizes Glacier Bay. National Park Service, 29. Juli 2016, abgerufen am 23. November 2021 (englisch).
- ↑ Meeresklima: Marine Hitzewellen vom 2. September 2020 WWF, abgerufen am 17. Juni 2023
- ↑ Welche Potentiale bieten Kelpwälder und Seegraswiesen? Salzwasser.eu, abgerufen am 17. Juni 2023
- ↑ Thomas Wernberg u. a.: Climate-driven regime shift of a temperate marine ecosystem. In: Science. Juli 2016, doi:10.1126/science.aad8745.
- ↑ a b Alastaire Blant: As Oceans Warm, the World’s Kelp Forests Begin to Disappear vom 20. November 2017 Yale School of the Environment, abgerufen am 17. Juni 2023
- ↑ Artenvielfalt in Algenwäldern bedroht vom 1. November 2018 Bild der Wissenschaft, abgerufen am 17. Juni 2023
- ↑ a b Australien: Die ostaustralische Strömung im Klimawandel vom 1. November 2018 Umweltnetz Schweiz, abgerufen am 17. Juni 2023
- ↑ Das Sterben der Urwälder im Meer: Zurück bleibt eine Seeigelwüste Die Tageszeitung, abgerufen am 17. Juni 2023
- ↑ Esther Megbel: Pazifikküste: Seeotter verschmähen Zombie-Seeigel Spektrum der Wissenschaft, abgerufen am 17. Juni 2023
- ↑ Kai Bischof & Markus Molis: Wälder unter Wasser – Großalgengemeinschaften vom 20. Dezember 2016 Springer Nature, abgerufen am 17. Juni 2023
- ↑ a b Denis Loctier & Sabine Sans: Lebensmittel der Zukunft: Algenanbau in Europa vom 15. Oktober 2020 Euronews, abgerufen am 20. Juni 2023
- ↑ Satellitenbild der Woche. Südkoreas grüne Ernte der Spiegel, abgerufen am 20. Juni 2023
- ↑ Sylter Algen auf dem Teller vom 21. April 2006 Die Welt, abgerufen am 20. Juni 2023
- ↑ Recreational Harvest of Kelp and Other Marine Algae California Department of Fish and Wildlife, abgerufen am 20. Juni 2023
- ↑ Canada's kelp forests are at risk. A seaweed farmer is trying to save them vom 11. Juni 2022 CBC/Radio-Canada, abgerufen am 20. Juni 2023
Auf dieser Seite verwendete Medien
Fischschwärme zwischen Riesenkelp; vor Kalifornien; Mitte der 1980er
Riesenkelp, der täglich bis zu 50 cm wachsen kann, bis zu einer Länge von 50 Metern; vor Kalifornien.
"As a biology student and someone who is passionate about ocean conservation, I learn more and more of the negative trends in which our environment is heading. Sanctuaries give me hope that not all will be lost. Sanctuary waters are full of healthy marine life and incredibly beautiful ecosystems. Seeing how vibrant our ocean can be inspires me to be a better guest to this planet." – Savanna Mahn, constituent and legislative affairs volunteer intern, NOAA's Office of National Marine Sanctuaries (Photo: Robert Schwemmer/NOAA)
Autor/Urheber: sodai gomi, Lizenz: CC BY 2.0
The Hidaka region is famous for race horses and konbu. Konbu is kelp that's gathered in small boats, then dried on the pebbley beaches. Konbu is delicious in soups and has a soft, chewy texture.
Autor/Urheber: Maximilian Dörrbecker (Chumwa), Lizenz: CC BY-SA 2.0
Verbreitungskarte von Kelpwäldern (Algenwäldern)
(c) "Mike" Michael L. Baird, CC BY 2.0
Sea Otter (Enhydra lutris) with her pup in Morro Bay, CA, 13may2007 - Photo by Mike Baird bairdphotos.com - taken with a Canon 5D w/ 600mm IS on tripod, polarizer on max attenuation. That frisky otter pup was all over the half-dozen otters in the area trying to nurse every adult!
Autor/Urheber: Richard Ling from NSW, Australia, Lizenz: CC BY-SA 2.0
A Kelpfish (Chironemus marmoratus). Statis Rock, Forster, NSW










