Succinat-Dehydrogenase

Das Enzym Succinat-Dehydrogenase (SDH), genauer Succinat:Ubichinon-Oxidoreduktase (systematischer Name), auch Komplex II genannt, ist ein Enzymkomplex, der aus vier Untereinheiten besteht. Es ist das einzige membranständige Protein des Citratzyklus und als Komplex II der Atmungskette direkt in die Elektronentransportkette der inneren Mitochondrien-Membran eingebunden. Das Enzym katalysiert
die Oxidation von Succinat zu Fumarat mit FAD als Oxidans:
den gleichzeitigen Transport von zwei Elektronen über die Membrangrenze:
- innen: FADH2 innen: FAD außen: 2H+ + 2e−
mithilfe dieser Elektronen die Reduktion von Ubichinon (Coenzym Q) zu Ubichinol (EC 1.3.5.1):
- Q + 2H+ + 2e− QH2
Mutationen in einem der vier codierenden Gene können beim Menschen für erbliche Stoffwechselkrankheiten verantwortlich sein (siehe Tabelle).[1][2][3][4]
Struktur
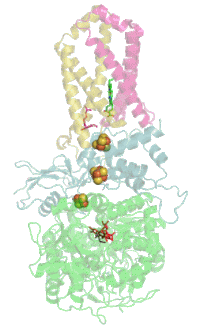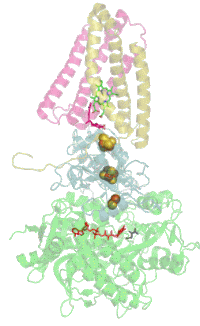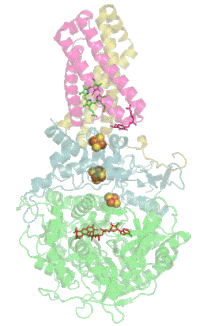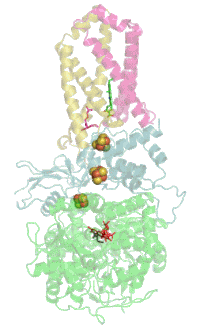
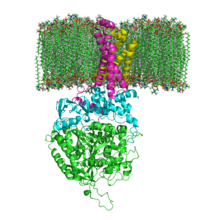
Das Protein besteht beim Menschen aus vier Protein-Untereinheiten (siehe Tabelle).
| Gen | Protein | Amino- säuren | UniProt | OMIM | Kommentar |
|---|---|---|---|---|---|
| SDHA | Flavoprotein-Untereinheit | 621 | P31040 | 600857 | Komplex-II-Defizienz |
| SDHB | Eisen-Schwefel-Protein-Untereinheit | 252 | P21912 | 185470 | Phäochromozytom, Paragangliom, Carney-Stratakis-Syndrom |
| SDHC | Cytochrom-b560-Untereinheit | 140 | Q99643 | 602413 | 4 Isoformen; Paragangliom, Carney-Stratakis-Syndrom |
| SDHD | Cytochrom-b560-Untereinheit | 103 | O14521 | 602960 | Phäochromozytom, Paragangliom, Carney-Stratakis-Syndrom, Leigh-Syndrom und kolorektale Karzinome |
Evolutionsbiologisch ist das Flavoprotein die älteste Untereinheit und homologe Proteine sind daher bereits in vielen Bakterien zu finden (EC 1.3.99.1). Mit der Evolution der Eukaryoten kam das Eisen-Schwefel-Protein hinzu, und mit den Wirbeltieren und dem dann hinzugekommenen Cytochrom wurde der Komplex in der Membran verankert.[5]
Funktion
Das Enzym katalysiert die Oxidation von Succinat zu Fumarat und die Reduktion von Ubichinon (Coenzym Q) zu Ubichinol. Das im Citratzyklus als Wasserstoffüberträger bei dieser Oxidation entstehende FADH2 tritt – im Gegensatz zum NADH – nicht frei auf, sondern ist als prosthetische Gruppe an die SdhA Untereinheit des Enzymkomplex gebunden. Seine Reoxidation erfolgt durch eine Kette von Einelektronenübertragungen beginnend bei den drei Eisen-Schwefel-Clustern Fe2S2, Fe4S4, Fe3S4 der SdhB Untereinheit, hin zum Cytochrom b560 (in Mitochondrien) bzw. Cytochrom b556 (in Bakterien) der Untereinheiten SdhC und SdhD. Dieses reduziert schließlich die chinoide – also oxidierte – Form des Coenzym Q (Ubichinon), in die phenolische Form, das Ubichinol.
Da die beteiligten Eisenkomplexe nur zu Einelektronenübertragungen fähig sind, erfolgt die Reoxidation des FADH2 zu FAD bzw. die Reduktion des Ubichinons, die je zwei Elektronen liefern bzw. benötigen, in zwei Stufen über radikalische, jedoch stabile, semichinoide Zwischenstufen. Die Bindetasche für Succinat befindet sich in der Untereinheit SdhA; die für Ubichinon wird von den drei Untereinheiten SdhB, SdhC und SdhD gebildet. Ubichinon/Ubichinol ist, bedingt durch seine lipophile Polyisoprenyl-Kette, membranlöslich. Es dient daher als mobiler Elektronenüberträger vom Komplex II auf den Komplex III der Atmungskette.
Die Redoxkette der Succinat-Dehydrogenase:
Die Bilanzierung dieses Schrittes des Citratzyklus ergibt also eine Übertragung zweier Elektronen vom Succinat auf Ubichinon. Ein Protonentransport findet über dieses Enzym jedoch nicht statt.
Inhibitor
Siehe auch
Weblinks
- Video: Succinat-Dehydrogenase. Institut für den Wissenschaftlichen Film (IWF) 2005, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.3203/IWF/C-12757.
Einzelnachweise
Auf dieser Seite verwendete Medien
(c) Minutemen, CC BY-SA 3.0
Mechanismus des Oxidation des Succinats durch den Komplex II der Atmungskette
JohnST, self-made, Inkscape
Struktur von Succinat
Struktur von Fumarat
Animation of SDH complex showing proteins as ribbons and cofactors as balls, after 1NEK. Ref.: Yankovskaya V, Horsefield R, Törnroth S, et al. (January 2003). "Architecture of succinate dehydrogenase and reactive oxygen species generation". Science 299 (5607): 700–4. DOI:10.1126/science.1079605. PMID 12560550.
(c) Zephyris aus der englischsprachigen Wikipedia, CC BY-SA 3.0
By Richard Wheeler (Zephyris) 2006.
en:Category:Protein images