Strombidium
| Strombidium | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
 LM-Aufnahme von Strombidium | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Strombidium | ||||||||||||

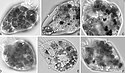
Alexandra Kraberg (2015)[2]


Strombidium (ursprünglich Strombidion[4]) ist eine Gattung fast ausschließlich mariner planktonischer Wimpertierchen (Ciliaten) in der Ordnung Oligotrichida, die etwa 30 Arten (Spezies) umfasst. Wie andere Ciliaten sind sie einzellige Eukaryoten (Protisten), die sich mit Hilfe von Flimmerhärchen fortbewegen. Bei Strombidium sind wie bei den anderen Oligotrichida diese Flimmerhärchen am Zellkörper jedoch entweder stark reduziert (zu „Borsten“, englisch bristles) oder ganz verloren gegangen. Nur die Flimmerhärchen um die Mundöffnung bilden große und auffällige Strukturen, die Membranellen genannt werden und ebenfalls der Fortbewegung dienen.[5]
Nach WoRMS gibt es außer den marinen Art auch eine im Brackwasser lebende (Strombidium inclinatum); die als Süßwasserarten ausgewiesenen Spezies (Strombidium mirabile und Strombidium viride) sind nach dortigen Angaben aber anderen Gattungen zuzuordnen (Pelagostrombidium respektive Limnostrombidium).[6]
Beschreibung
Viele Arten der Gattung Strombidium können funktionale Chloroplasten von einer Vielzahl von erbeuteten Algen erwerben und gelten daher als generalistische, nicht-konstitutive Mixotrophe eingestuft (en. General Non-Constitutive Mixotroph, GNCM).[7][3] Strombidium gehört zu einer großen Gruppe von Wimpertierchen (Ciliaten), zu der im Taxon Choreotrichia Small & Lynn, 1985 die Unterordnungen Tintinnina Kofoid & Campbell, 1929 (syn. Tintinnida)[8]; Strobilidiina[9] und Strombidinopsina[10] und im Taxon Oligotrichia die Familien Tontoniidae (mit der Gattung Laboea) und eben die Familie Strombidiidae mit der Gattung Strombidium gehören. Diese zeichnen sich durch einen m. o. w. konischen Körper aus sowie ein Büschel von Zirren (den namensgebenden Wimpern) und hochkomplexen Membranellen, zwischen denen sich ihr Cytostom („Mund“) öffnet.[11]

Die genaue Ausprägung der Mixotrophie kann von Art zu Art unterschiedlich sein. Ein Beispiel für die räuberische Lebensweise von Strombidium-Arten ist die „Vertilgung“ (Indigestion) von Cyanobakterien, etwa der Gattung Crocosphaera.[12]
Verschiedene Strombidium-Arten, darunter S. capitatum, S. conicum, S. acutum und S. chlorophilum fingen in einem Experiment isolierte Chloroplasten mikroplanktonischer Algen (oder gar die intakten Algenzellen selbst) ein, benutzten diese dann aber zur deutlichen Steigerung ihrer Photosyntheserate. S. chlorophilum war die am stärksten photosynthetisch aktive der vier Arten, etwa fünfeinhalb mal so stark wie bei S. capitatum mit der geringsten Aktivität. Die Beobachtung wird erklärt durch Endosymbiose (genauer: Endocytobiose) beziehungsweise Kleptoplastidie, je nachdem, ob die aufgenommenen Algenzellen intakt bleiben, oder nur ihre Chloroplasten. Solche Oligotrichia, die aufgenommene Chloroplasten behalten, sind dadurch mixotroph.[13]

Durchmesser der Zyste ca. 40 μm.[14]
In marinen Systemen dominiert das Vorhandensein von Kleptoplastiden neben einer Reihe von intrazellulären Dinoflagellaten (siehe Zooxanthellen) und Kryptophyten. Kleptoplastiden können einen Zwischenschritt beim Erwerb von funktionellen Plastiden oder anderen phototrophen Symbionten darstellen. Die intakten Chloroplasten in den marinen Wimpertierchen Strombidium und Prorodon, die sich nicht in Vakuolen befinden und vom Wirt nicht verdaut werden, sind hier ein Beispiel. In der Ostsee wurde in Strombidium-Arten wie auch in Laboea strobila oft endosymbiotische Algen gefunden. Ob diese funktionellen Endosymbionten oder Kleptochloroplasten den Hauptanteil darstellen, muss im Einzelfall untersucht werden.[15]
Bei der Art Strombidium rassoulzadegani wurde „Zystenbildung“ beobachtet.
Systematik
Im Lauf der Forschungsgeschichte gab es zahlreiche Veränderungen bzgl. des Umfangs der zur Gattung zugehörigen Arten (Spezies); dieser Prozess ist sicher auch noch nicht abgeschlossen. Die hier wiedergegebene Artenliste basiert auf der in der AlgaeBase angegebenen, vergleichsweise restriktiven Liste (Stand 9. August 2021).[16] Wegen der Namensähnlichkeit von Strombidium zu Strobilidium und etlicher Verschiebungen zwischen beiden Gattungen werden hier Abkürzungen für Gattungsnamen („S.“) vermieden.
Weitere Quellen sind wie angegeben:
- Nordic Microalgae, Swedish Meteorological and Hydrological Institute (SMHI)[17]
- Global Biodiversity Information Facility (GBIF)[18]
- National Center for Biotechnology Information (NCBI)[19]
- Deutsches Netzwerk für Bioinformatik-Infrastruktur – de.NBI (Silva)[20]
- World of Marine Species (WoRMS)[6]
GenBank-Zugriffsnummern (englisch Accession number) sind u. a. bei NCBI und Silva verfügbar.
- Arten
Gattung: Strombidium Claparède & Lachmann, 1859
- Nach AlgaeBase bestätigte Arten
- Strombidium acutum Leegaard 1915(W)

- Strombidium conicum (Lohmann) Wulff 1919 bzw. Lohmann, 1908(GNSWµ) – syn. Strombidium acuminatum(W)
- Strombidium crassulum Leegaard, 1915(GNSW)
- Strombidium lagenula Fuaré-Fremiet 1924[21](Wµ)

Balken 25 µm.[22]
- Strombidium sulcatum Claparède & Lachmann 1858/1859[23](GNWµ) – Typus, syn. Strombidium compressum (gültig und kein Synonym bei WoRMS), Strombidium emergens (gültig und kein Synonym bei WoRMS), Strombidium minutum(W)
- Nach AlgeBase gelistete, aber nicht verifizierte Kandidaten

- Strombidium capitatum (Leegaard, 1915)Kahl, 1932(GSNWµ) – veraltet: Laboea capitata Leegaard, 1915(GN)
- Strombidium chlorophilum Montagnes, Lynn, Stoecker & Small, 1988(Wµ) bzw. Van As, Basson & Van As, 1998(GSN)
- Strombidium conicoides Leegaard, 1915(µ) (AlgaeBase: fraglich, WoRMS: nomen dubium. m)
- Strombidium constrictum (Meunier, 1910) Wulff 1919 bzw. Meunier, 1910(µ) (⇒ Foissneridium constrictum(W))
- Strombidium delicatissimum (Leegaard) Bush (⇒ Strombidium vestitum(W))
- Strombidium reticulatum Leegaard, 1915(µ) (WoRMS: nomen dubium)
- Strombidium vestitum (Leegaard, 1915) Kahl, 1932 bzw. Leegaard, 1915(Wµ) – syn. Strombidium delicatissimum(W)
- Strombidium wulffi (Wulff, 1919) Kahl, 1932[24](Wµ)
- Nicht in AlgaeBase gelistete Arten
- Strombidium antarcticum (Busch, 1930) Kahl, 1932(W)
- Strombidium apolatum Wilbert & Song, 2005(GSNW)
- Strombidium arenicola Dragesco, 1960(W)
- Strombidium basimorphum Martin & Montagnes, 1993(GSNW)
- Strombidium biarmatum Agatha, Strüder-Kypke, Beran & Lynn, 2005(SNW) – syn. Strombidium sp. MCS-2004(GN)
- Strombidium bilobum Lynn & Gilron, 1993(W)
- Strombidium clavellinae Buddenbrock, 1922(W)
- Strombidium caudispina(SNG) – syn. Strombidium sp. FG-2015c(GN)
- Strombidium cornucopiae (Wailes, 1929) Kahl, 1932(W)
- Strombidium corsicum (Gourret & Roeser, 1888) Kahl, 1932(W)
- Strombidium costatum Tucolesco, 1962(W)
- Strombidium cuneiforme Song et al. 2015(GSN) – Strombidium sp. FG-2015a(GN)
- Strombidium dalum Lynn, Montagnes & Small, 1988(W)
- Strombidium epidemum Lynn, Montagnes & Small, 1988(W)
- Strombidium eurystomum Lynn & Gilron, 1993(W)
- Strombidium faurei Dragesco, 1960(GNW)
- Strombidium filificum Kahl, 1932(W)
- Strombidium foissneri Xu, Sun, Song & Warren, 2008(W)
- Strombidium fourneleti Dragesco, 1960(W)
- Strombidium glaciale Petz, Song & Wilbert, 1995(W)
- Strombidium globosaneum Song & Packroff, 1997(W)
- Strombidium grande Levander, 1894(GNW)
- Strombidium guangdongense Liu et al. 2016(GSN)
- Strombidium hausmanni Xu et al. 2009(GN)
- Strombidium inclinatum Montagnes, Taylor & Lynn, 1990(GSNW)

a: Seitenansicht,
b: Ansicht vom vorderen (stumpfen) Ende her (mit Zilienring),
c: Zelle in der Teilungsphase, die beiden Tochterzellen stehen im rechten Winkel zueinander.[25]
- Strombidium intermedium Maskell, 1887(GSN)
- Strombidium ioanum Lynn & Gilron, 1993(W)
- Strombidium kahli Bock, 1952(GNW)
- Strombidium kryale Petz, 1994(W)
- Strombidium latum Kahl, 1932(W)
- Strombidium lingulum Montagnes & Humphrey, 1998(W)
- Strombidium lynni Martin & Montagnes, 1993(W)
- Strombidium macronucleatum Dragesco, 1960(W)
- Strombidium maedai Lynn & Gilron, 1993(W)
- Strombidium meganucleatum Dragesco & Dragesco-Kerneis, 1986(W)
- Strombidium minor Kahl, 1935(W) – syn. Strombidium calkinsi, Strombidium caudatum(W)
- Strombidium oblongum Leegaard, 1915(W) (Unterscheide: Strombidium oblongum Entz, 1884 ⇒ Spirostrombidium oblongum(W))
- Strombidium oculatum(GSN) (nach WoRMS ein Synonym von Strombidium tintinnodes)
- Strombidium opisthostomum Tucolesco, 1962(W)
- Strombidium paracalkinsi (Lei, Xu & Song, 1999) Agatha, 2004(GSNW)
- Strombidium paracapitatum Song et al. 2015(GN) – syn. Strombidium sp. FG-2015b(GN)
- Strombidium parastylifer Xu, Warren & Song, 2009(W)
- Strombidium pollostomum Lynn & Gilron, 1993(W)
- Strombidium pseudorapulum Li, Huang, Yu, Liu & Lin, 2020(N) – inkl. Strombidium sp. Lwi-2020a(N)
- Strombidium pseudostylifer Song et al. 2014(GN) – inkl. Strombidium sp. FG-2014(GN)
- Strombidium purpureum Kahl, 1932(GNW)
- Strombidium rapulum (Yagiu, 1933) Kahl, 1934(NW)
- Strombidium rassoulzadegani McManus, Xu, Costas & Katz, 2010[14](GW) bzw. Van As, Basson & Van As, 1998(N) – syn. Strombidium sp. HZ-2009a, Strombidium sp. HZ-2009c(GN)
- Strombidium rehwaldi Petz & Foissner, 1992[4](W)
- Strombidium rhynchum Lynn, Montagnes & Small, 1988(W)
- Strombidium sphaericum Lynn & Gilron, 1993(W)
- Strombidium stylifer Levander, 1894(GNW) – syn. Strombidium styliferum(GN)
- Strombidium suzukii Xu, Warren & Song, 2009(W)
- Strombidium syowaense (Hada, 1970) Maeda & Carey, 1985
- Strombidium taylori Martin & Montagnes, 1993(W)
- Strombidium tintinnodes Entz, 1884(W) – syn. Strombidium hadai, Strombidium oculatum, Strombidium typicum(W)
- Strombidium tressum Lynn, Montagnes & Small, 1988(W)
- Strombidium triquetrum Agatha & Riedel-Lorjé, 1997(GNW)
- Strombidium tropicum Liu et al. 2015(GN) – inkl. Strombidium sp. FG-2015d(N)
- Strombidium turcicum Hovasse, 1932(W)
- Strombidium ventropinnum Martin & Montagnes, 1993(W)
- Strombidium velox Beardsley, 1902, (partim, Fig. 5b)[26][4]
- Strombidium cf. parastylifer FG-2016(N)
- Weitere nach WoRMS als nomen dubium eingestufte Kandidaten
- Strombidium alveolare Bullington, 1940(W)
- Strombidium atlanticum (Busch, 1921) Maeda & Carey, 1985(W) – syn. Strombidium atlantica(W)
- Strombidium buehringae Busch, 1921(W)
- Strombidium cylindromorphum Perejaslawzewa, 1886(W)
- Strombidium diversum Busch, 1930(W)
- Strombidium elongatum (Leegaard, 1915) Kahl, 1932(W)
- Strombidium nasutum Smith, 1897(W)
- Strombidium prorogatum Busch, 1930(W)
- Strombidium spirale Busch, 1950(W)
- Strombidium virgatum Wulff, 1919(W)
- Synonyme

Zeichnung: Gary N. Calkins, 1901[28]
- Synonyme innerhalb der Gattung nach AlgaeBase
- Strombidium compressum (Leegaard, 1915) Kahl, 1932 bzw. Leegaard, 1915(W)(µ) ⇒(A) Strombidium sulcatum – kein Synonym nach WoRMS!
- Strombidium emergens (Leegaard) Kahl bzw. Leegaard, 1915(µ) syn. Strombidium petzi ⇒(A) Strombidium sulcatum – kein Synonym nach WoRMS!
- Synonyme innerhalb der Gattung nach WoRMS
- Strombidium acuminatum (Leegaard, 1915) Kahl, 1932 ⇒(W) Strombidium conicum (Lohmann, 1908) Wulff, 1919
- Strombidium atlantica (Busch, 1921) Maeda & Carey, 1985 ⇒(W) Strombidium atlanticum (Busch, 1921) Maeda & Carey, 1985
- Strombidium calkinsi Kahl, 1932 ⇒(W) Strombidium minor Kahl, 1935 – siehe auch NIES Strombidium Zeile 68[24] und M. A.-L. Sauvadet (2010) S. 36 (PDF S. 50), Fig. 2.5 B.[29]
- Strombidium caudatum Calkins, 1901[28] ⇒(W) Strombidium minor Kahl, 1935
- Strombidium delicatissimum (Leegaard, 1915) Busch, 1921 ⇒(W) Strombidium vestitum (Leegaard, 1915)Kahl, 1932
- Strombidium hadai (Hada, 1970) Maeda & Carey, 1985 ⇒(W) Strombidium tintinnodesEntz, 1884
- Strombidium minutum Wulff, 1919 ⇒(W) Strombidium sulcatum Claparède & Lachmann, 1859
- Strombidium oculatum Gruber, 1884 ⇒(W) Strombidium tintinnodes Entz, 1884
- Strombidium petzi Song, 2005 ⇒(W) Strombidium emergens (Leegaard, 1915) Busch, 1921
- Strombidium typicum (Lankester, 1874) Bütschli, 1889 ⇒(W) Strombidium tintinnodes Entz, 1884
Die Spezies Strombidium wulffi (Wulff, 1919) Kahl, 1932 wird beim National Institute for Environmental Studies (NIES), Japan, als ein Synonym für Strombidium striatum Wulff, 1919 gelistet; siehe Strombidium auf Zeile 129.[24] Diese ist aber nach WoRMS verschoben zu Strobilidium striatum.
Die Spezies Strombidium gryrans A.Stokes 1885 ist bei AlgaeBase zwar als bestätigt gelistet, lässt sich aber anderweitig nicht verifizieren. Vermutlich handelt es sich um eine Verschreibung für Strombidium gyrans Stokes, 1887, wie beim NIES, Japan, angegeben; siehe Strombidium auf Zeile 51.[24]
Der Name Strombidium caudatum Calkins, 1901[28] gilt als Synonym für Strombidium minor Kahl, 1932/1935 bzw. (Kahl, 1935) Maeda & Carey, 1985 (nach WoRMS[27] und NIES Strombidium Zeile 16 und 68[24]). Dagegen sieht NIES den Namen Strombidium caudatum Fromentel, 1874 als ein Synonym für Strobilidium gyrans (NIES Strombidium Zeile 17[24] und NIES Strobilidium Zeile 15[30]) Auf die Problematik mit dem doppelt vergebenen Namen wird auch bei Petz und Foissner (1992) hingewiesen (S. 160)[4]

a: Ventrale Ansicht eines ruhenden Individuums mit abgerundetem hinterem Ende, CV = kontraktile Vakuole („Vesikel“), 𝒻 = aufgenommene Nahrung, Zoom 370×.
b: Dorsale Ansicht eines am Substrat (links) angehefteten Individuums (das aber offenbar Rimostrombidium caudatum darstellt).
c: Isolierte Zellkerne dieser Wimpertierchen (gefärbt mit Karminessigsäure); Zoom 600×.
Beardsley, 1902[26][4]
Die Situation ist bei Strombidium velox (NIES Strombidium Zeile 123.[24]) sehr ähnlich. Das in der Erstbeschreibung von Arthur E. Beardsley (1902) auf S. 58f Tafel XI Fig. 5a–c wiedergegebene Wimpertierchen bildet in b einen Faden, mit dem es sich am Substrat festhält und um dem es sich dreht.[26] Nach Beurteilung von Petz und Foissner (1992, S. 160) zeigt a mit dem abgerundeten Ende eindeutig einen Vertreter von Strombidium. Offenbar seien hier auch zwei unterschiedliche Spezies durcheinandergebracht. Eine Nachzeichnung dieser Abbildung ist auch als Fig. 128 Strombidium velox ganz oben, zweite Abb. von links, zu finden bei P. Eigner (2001)[31] und M. A.-L. Sauvadet (2010).[29] Für die andere Spezies schlugen diese Autoren den Namen Strobilidium kahli vor, der heute laut WoRMS als Synonym von Rimostrombidium caudatum (Kahl, 1932) Agatha & Riedel-Lorjé, 1998 gilt.[26][4][32] Eine weitere Synonymisierung in diesem Zusammenhang ist Strombidium velox Fauré-Fremiet, 1924, aktuell: Rimostrombidium velox (Faure-Fremiet, 1924) Jankowski, 1978,[33] webenso wie Strobilidium velox Faure-Fremiet, 1924 (nach WoRMS[34] und NIES Strobilidium, Zeile 42[30]).
- Verschiebungen
- Synonyme mit Zuordnung zu einer anderen (ggf. neuen) Gattung nach AlgaeBase/WoRMS
- Strombidium cinctum Kahl, 1932 ⇒ Spirostrombidium cinctum (Kahl, 1932) Petz, Song & Wilbert, 1995(W)
- Strombidium constrictum (Meunier, 1910) Wulff, 1919 ⇒ Foissneridium constrictum (Meunier, 1910) Agatha, 2011(W)
- Strombidium cornutum (Leegaard, 1915) Kahl, 1932 ⇒ Pseudotontonia cornuta (Leegaard, 1915) Agatha, 2004(W)
- Strombidium coronatum (Leegaard, 1915) Kahl, 1932 ⇒ Spirostrombidium sauerbreyae (Kahl, 1932) Petz, Song & Wilbert, 1995(W)
- Strombidium echini Song, Wilbert & Hill, 1994 ⇒ Spirostrombidium echini (Song, Wilbert & Hill, 1994) Song, Wilbert & Warren, 1999(W)
- Strombidium elegans Florentin, 1901 ⇒ Spirostrombidium elegans (Florentin, 1901) Petz, Song & Wilbert, 1995 ⇒ Omegastrombidium elegans (Florentin, 1901) Agatha, 2004(W)
- Strombidium gracillimum (Fauré-Fremiet, 1924) Alekperov & Mamajeva, 1992 ⇒ Tontonia gracillima Fauré-Fremiet, 1924 ⇒ Paratontonia gracillima (Fauré-Fremiet, 1924) Jankowski, 1978(W)
- Strombidium kielum Maeda & Carey, 1985 ⇒ Varistrombidium kielum (Maeda & Carey, 1985) Xu, Sun, Clamp, Ma & Song, 2011(W)
- Strombidium marinum Fauré-Fremiet, 1910 ⇒ Strobilidium marinum (Fauré-Fremiet, 1910) Fauré-Fremiet, 1924 ⇒ Strombidinopsis marina (Fauré-Fremiet, 1910) Alekperov, 2005(W)
- Strombidium minimum Gruber, 1884 ⇒ Strombidinopsis minima (Gruber, 1884) Lynn, Montagnes, Dale, Gilron & Strom, 1991(W)
- Strombidium mirabile Penard ⇒ Pelagostrombidium mirabile (Penard, 1916) Krainer, 1991(W)
- Strombidium montagnesi Xu, Song & Warren, 2006 ⇒ Opisthostrombidium montagnesi (Xu, Song & Warren, 2006) Agatha, 2011(W)
- Strombidium obliquum Kahl, 1932 ⇒ Novistrombidium testaceum (Anigstein, 1914) Song & Bradbury, 1998(W)
- Strombidium oblongum Entz, 1884 ⇒ Spirostrombidium oblongum (Entz, 1884) Petz, Song & Wilbert, 1995(W) (Unterscheide: Strombidium oblongum Leegaard, 1915(W) – gültiger Name)
- Strombidium ovale (Leegaard, 1915) Kahl, 1932 ⇒ Tontonia ovalis (Leegaard, 1915) Laval-Peuto & Rassoulzadegan, 1987(W)
- Strombidium pulchrum (Leegaard, 1915) Kahl, 1932 ⇒ Spirostrombidium pulchrum (Leegaard, 1915) Agatha, 1998(W)
- Strombidium sauerbreyae Kahl ⇒ Spirostrombidium sauerbreyae (Kahl, 1932) Petz, Song & Wilbert, 1995(W)
- Strombidium schizostomum Kahl, 1932 ⇒ Spirostrombidium schizostomum (Kahl, 1932) Xu, Song, Lin & Warren, 2006(W)
- Strombidium siculum Montagnes & Taylor, 1994 ⇒ Parallelostrombidium siculum (Montagnes & Taylor, 1994) Agatha, 2004(W)
- Strombidium spiniferum Leegaard, 1915 ⇒ Strombidinopsis spinifera (Leegaard, 1915) Lynn, Montagnes, Dale, Gilron & Strom, 1991(W)
- Strombidium striatum (Meunier, 1910) Kahl, 1932 ⇒ Strobilidium striatum (Meunier, 1910) Kahl, 1933(W)
- Strombidium strobilum Lohmann bzw. (Lohmann, 1908) Wulff, 1919 ⇒ Laboea strobila Lohmann, 1908(AW)
- Strombidium strobilus (Lohmann, 1908) Wulff, 1919 ⇒ Laboea strobila Lohmann, 1908(W)
- Strombidium testaceum Anigstein, 1914 ⇒ Novistrombidium testaceum (Anigstein, 1914) Song & Bradbury, 1998(W)
- Strombidium urceolare Stein, 1867 ⇒ Spirostrombidium urceolare (Stein, 1867) Lei, Xu & Song, 1999 (W)
- Strombidium viride Stein, 18675 ⇒ Limnostrombidium viride (Stein, 1867) Krainer, 1995(W)
- Strombidium wilberti Song, 2005 ⇒ Opisthostrombidium wilberti (Song, 2005) Agatha, 2011(W)
Legende
Strombidium lagenula
Strombidium lagenula wurde 1924 von Emmanuel Fauré-Fremiet beschrieben[21] und ist kugel- oder glockenförmig, etwa 60 µm lang und unterscheidet sich von den anderen Strombidium-Arten durch einen erhabenen Gürtel (englisch girdle) aus Trichozysten nahe dem hinteren (posterioren) Ende der Zelle.[5]
Strombidium sulcatum
Die Zellen von Strombidium sulcatum haben einen ausgeprägten vorderen Vorsprung, die Mundhöhle (Cytostom) ist kurz. Eine Kontraktile Vakuole befindet sich in der Körpermitte auf der linken Seite. Der äquatoriale Ring (englisch kinety)[35] befindet sich unterhalb von der Körpermitte, bestehend aus Dikinetiden.[Anm. 1] Es gibt etwa 12 vordere und 7-8 ventrale Membranellen im Adoralbereich (Bereich um die Mundöffnung; lateinisch ad ‚um‘ und oral). Die Einzeller führen mäßig schnelle, ruckartige Bewegung aus. Ihre Größe liegt bei 30-60 × 25-30 µm.[23][36] Zahlreiche Populationen, die vor 1990 als Strombidium sulcatum identifiziert wurden, gehören tatsächlich zu anderen Arten.[23][36]
Strombidium conicum
Wegen seiner konischen Form könnte die Spezies Strombidium conicum auch spanisch zanahoria de mar ‚Seemöhre‘, ‚Seekarotte‘ genannte werden, heißt es in der Encyclopedia of Life (EOL), in Anlehnung an die Wortbildungen Seepferdchen, Seesterne oder Seegurken.[11] Diese Mikrobe bewegt sich in ihrer marinen Umgebung durch Wellenbewegungen ihrer sternförmigen Flimmerhärchen sehr schnell und schwimmt in Spiralen oder in kleinen Sprüngen in schnellen Vor- und Rückwärtsbewegungen auf der Suche nach Nahrung. Diese besteht aus Mikroalgen (insbesondere Kieselalgen), Bakterien und anderen Mikroben. Aufgrund seines Chloroplasten kann Strombidium conicum wie die anderen Vertreter dieser Gattung Photosynthese betreiben und von den Produkten dieser Assimilation leben, die es im Sonnenlicht produziert.[11]
Strombidium conicum hat eine ausgeprägt konische Form, ähnlich wie eine Eistüte, wenn auch mit einer abgerundeten Spitze. Im Inneren befindet sich ein großer, einzelner, zentral positionierter Makronukleus. Der hintere Teil weist dünne Längsstreifen von Trichozysten auf. Diese Bänder haben möglicherweise eine Verteidigungsfunktion, denn aus diesen Strukturen können in bestimmten Stress- oder Gefahrensituationen eine Art schleimiger Pfeile abgefeuert werden.[11]
Strombidium intermedium
Strombidium intermedium ist eine eiförmige, freischwimmende Mikrobe, mit einer kurzen posterioren (hinteren) Verlängerung, fast spitz zulaufend. Die Farbe ist weißlich, dabei sind eingeschlossene Körnchen sichtbar. Die Einzeller sind etwa eineinhalbmal so lang wie breit bei einer Länge von ca. 38,5 µm. Der vordere Rand ist abgerundet, hinterer Vorsprung (englisch prolongation, projection) fast spitz zulaufend. Auf dem vorderen Teil befindet sich ein Ring langer, feiner Flimmerhärchen (Zilien), die in der Aufsicht spiralförmig angeordnet erscheinen. Einzelne kontraktile Vakoulen („Vesikel“) befinden sich nahe dem hinteren Fortsatz. Der Zellkern ist länglich-oval und ist schräg unter dem Zilienring angeordnet. Außer in diesem Ring gibt es sonst keine Flimmerhärchen. Die Zellen führen sehr schnelle, ruckartige Bewegung aus, weshalb sie unter dem Lichtmikroskop schwer zu verfolgen sind.[25]
Strombidium purpureum
Strombidium purpureum Kahl ist ein anaerobes Wimpertierchen mit endosymbiotischen phototrophen Purpur-Nichtschwefelbakterien. Wie andere anaerobe Wimpertierchen reagiert auch S. purpureum auf O2-Druck. Im Licht meiden die Individuen selbst geringe Spuren von O2 von weniger als 1 % der atmosphärischen Sättigung. Im Dunkeln hingegen sie sich an in Wasser mit einem O2-Druck von 1-4 % der atmosphärischer Sättigung. Experimente zeigen diese Ciliaten, nachdem sie sich im Dunkeln angesammelt haben, bei Beleuchtung in sauerstoffärmere Regionen zu entkommen suchen.[37] Die Bakterien besitzen photosynthetische Membranen und Zellwände und enthalten Bakteriochlorophyll a sowie das Carotinoid Spirilloxanthin. Zum Überleben und Wachstum benötigen die Wimpertierchen unter anaeroben Bedingungen Licht. Die Ergebnisse werfen ein Schlaglicht auf die Theorien über den endosymbiotischen Ursprung der Mitochondrien.[38][39] S. purpureum hat Hydrogenosomen ohne Cristae (englisch acristate hydrogenosomes); bis heute (Stand Juni 2021) sind praktisch alle bekannten Photosymbiosen von eukaryotischer Mikroben entweder mit Cyanobakterien (primäre Endosymbiose) oder mit eukaryotischen Algen (sekundäre und höhere Endosymbiosen) verbunden, die aber alle aerobe Photosynthese betreiben – mit Ausnahme von Strombidium purpureum.[40]
Strombidium rassoulzadegani

Das marine Wimpertierchen Strombidium rassoulzadegani ernährt sich von der Grünalge Tetraselmis chui PLY 429 (Chlorodendrales). Auch in diesem Fall behält das Wimpertierchen die Chloroplasten aus seiner Nahrung und nutzt sie, um aus ihrer Photosynthese eine Nahrungsergänzung zu erhalten, betreibt also offenbar Kleptoplastidie.[14][41]
- S. rassoulzadegani, einverleibt vier verschiedenen Algenspezies, die das Wachstum im Licht unterstützten.
Pfeil: starre Zellwand der Algenzellen,
Pfeilspitze: teilw. verdautes Algenzytoplasma.[14] - S. rassoulzadegani aus Kulturen zusammen mit T. chui nach unterschiedlichen Zeiten und unter verschiedenen Lichtbedingungen.[14]
Strombidium capitatum
Auch Strombidium capitatum (Leegaard, 1915) Kahl, 1932 behält funktionelle Chloroplasten, die von aufgenommenen Algenzellen stammen. Das Phänomen wurde beobachtet bei Algenzellen von Isochrysis galbana (Prymnesiophyceae), Pyrenomonas salina (Cryptophyceae) und Pyramimonas sp. (Prasinophytae). 15 Minuten nach dem Kontakt wurden die Algenzellen von Strombidium capitatum aufgenommen, anfangs befanden sich deren Chloroplasten noch in den Vakuolen des Wimpertierchens, aber nach 2 Stunden waren die meisten fei in deren Zytoplasma. Zwar wurden die Chloroplasten der anderen Algen gegenüber denen der Kryptophyten bevorzugt, aber bei Nahrungsmangel blieben die Chloroplasten der Kryptophyten länger erhalten als die der anderen Algen. Wurden die Wimpertierchen nicht mit Algen versorgt, nahmen sie an Größe und Anzahl ab. Wurden sie gar nur mit Chloroplasten-freier Beute versorgt, stellten sie das Wachstum ganz ein.[42]
Strombidium oculatum
Ein besonderer Fall von Augenfleck (Stigma) findet sich bei Strombidium oculatum Gruber, 1884 (nach WoRMS ein Synonym für Strombidium tintinnodes Entz, 1884). Dieses Wimpertierchen benutzt Grünalgen der Unterordnung Chlamydomonadina[43] (Ordnung Chlamydomonadales) als Endosymbionten. Diese vermehren sich üblicherweise schneller als ihr Wirt, so dass die überschüssigen Endosymbionten abgebaut werden – bis auf deren Stigmata, die sich im vorderen Teil (‚apikal‘) des Strombidium-Wirts ansammeln und einen ‚Augenfleck‘ bilden. Da diese geraubten Stigmata aus der Plastiden-Verwandtschaft stammen, sind sie eine Form von Kleptoplastiden.[44][45]
Die Wimpertierchen dieser Spezies rauben auch der vielzelligen Alge Ulva die Chloroplasten für ihre mixotrophe Lebensweise.[46]
Anmerkungen
- ↑ Meistens sind die Zilien der Wimpertierchen in Mono- und Dikinetiden angeordnet, die jeweils ein bzw. zwei Kinetosomen (Basalkörper) besitzen, von denen jedes ein Zilium tragen kann. Diese sind in Reihen angeordnet, die Kinetien (englisch kineties, Einzahl kinety) genannt werden.
Weblinks
Einzelnachweise
- ↑ Patricio A. Díaz, Iván Pérez-Santos, Gonzalo Álvarez, Michael Araya, Francisco Álvarez, Beatriz Reguera: Cell Cycle, Division Rate, and Feeding of the Heterotroph Phalacroma rotundatum in a Chilean Fjord, in: MDPI Microorganisms, Band 7, Nr. 10, Special Issue Dinoflagellate Biology in the Omics Era, 451; doi:10.3390/microorganisms7100451
- ↑ Alexandra Kraberg: planktonnet.awi.de, auf plankton net, Heincke 443 - POGO Cruise 2015
- ↑ a b c d Lumi Haraguchi, Hans H. Jakobsen, Nina Lundholm, Jacob Carstensen: Phytoplankton Community Dynamic: A Driver for Ciliate Trophic Strategies, in: Front. Mar. Sci., Band 5, S. 272, doi:10.3389/fmars.2018.00272, ISSN 2296-7745
- ↑ a b c d e f Wolfgang Petz, Wilhelm Foissner: Morphology and Morphogenesis of Strobilidium caudatum (Fromentel), Meseres corlissi N. Sp., Halteria grandinella (Müller), and Strombidium rehwaldi N. Sp., and a Proposed Phylogenetic System for Oligotrich Ciliates (Protozoa, Ciliophora), in: J. Protozool., Band 39, Nr. 1, S. 159—176, Januar/Februar 1992
- ↑ a b K. J. Bock: Protozoa. In: www.ices.dk. Archiviert vom am 21. Februar 2012; abgerufen am 7. August 2021 (amerikanisches Englisch). Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Memento im WebArchiv vom 21. Februar 2012.
- ↑ a b c WoRMS: Strombidium Claparède & Lachmann, 1859, auf: World Register of Marine Species
- ↑ Erin Ann Hughes, Maira Maselli, Helle Sørensen, Per Juel Hansen: Metabolic Reliance on Photosynthesis Depends on Both Irradiance and Prey Availability in the Mixotrophic Ciliate, Strombidium cf. basimorphum, in: Front. Microbiol., 17. Juni 2021, doi:10.3389/fmicb.2021.642600
- ↑ WoRMS: Tintinnina, Tintinnida
- ↑ WoRMS: Strobilidiina
- ↑ WoRMS: Strombidinopsina
- ↑ a b c d STROMBIDIUM CONICUM. BALEA 2/2. RA DE AROUSA., Encyclopedia of Life (EOL), Proyecto Agua. Abb. Strombidium conicum aus einer Bodenprobe vom 27. August 2017 aus einer Tiefe von 3 Metern vor der Arosa-Bucht/Ästuar (spanisch ría de Arosa, galicisch ?ra de Arousa) in der Nähe des Strandes von Balea (spanisch playa de Balea) bei San Vicente do Mar in der Provinz Pontevedra, Galicien.
- ↑ Mathilde Dugenne, Fernanda Henderikx Freitas, Samuel T. Wilson, David M. Karl, Angelicque E. White: Life and death of Crocosphaera sp. in the Pacific Ocean: Fine scale predator–prey dynamics, in: Limnol. Oceanogr. 65, 29. Juni 2020, S. 2603–2617, doi:10.1002/lno.11473
- ↑ Diane K. Stoecker, Mary W. Silver, Ann E. Michaels, Linda H. Davis: Enslavement of Algal Chloroplasts by Four Strombidium spp. (Ciliophora, Oligo trichida), in: Mar Microb Food Webs, Band 3, Nr. 2, 1988, S. 79–100
- ↑ a b c d e f George B. McManus, Weiwei Liu, Rachel A. Cole, Daniel Biemesderfer, Jennifer L. Mydosh: Strombidium rassoulzadegani: A Model Species for Chloroplast Retention in Oligotrich Ciliates, in: Front. Mar. Sci., 12. Juni 2018, doi:10.3389/fmars.2018.00205
- ↑ Claudia Dziallas, Martin Allgaier, Michael T. Monaghan, Hans-Peter Grossart: Act together—implications of symbioses in aquatic ciliates, in: Front. Microbiol., 7. August 2012, doi:10.3389/fmicb.2012.00288
- ↑ a b AlgaeBase: Strombidium Claparède & Lachmann, 1859
- ↑ a b Nordic Microalgae: Strombidium Claparède & Lachmann, auf: Nordic Microalgae and aquatic protozoa, Swedish Meteorological and Hydrological Institute (SMHI)
- ↑ a b Strombidium in GBIF
- ↑ a b Strombidium (genus); graphisch: Strombidium, auf: Lifemap, NCBI Version.
- ↑ a b Silva: Silva, mit Suche „Strombidium“, z. B. Accession-Nr. AJ488911 Strombidium inclinatum, de.NBI
- ↑ a b WoRMS: Strombidium lagenula Fauré-Fremiet, 1924
- ↑ Xiao Chen, Xiaolu Zhao, Xiaohui Liu, Alan Warren, Fangqing Zhao, Miao Miao: Phylogenomics of non-model ciliates based on transcriptomic analyses, in: Protein & Cell, Band 6, S. 373–385, doi:10.1007/s13238-015-0147-3
- ↑ a b c D. Boltovskoy (Hrsg.): Strombidium sulcatum, Marine Species Identification Portal, ETI BioInformatics, KeyToNature / e-contentPlus
- ↑ a b c d e f g Strombidium Claparede & Lachmann, 1858, auf: The World of Protozoa, Rotifera, Nematoda and Oligochaeta. National Institute for Environmental Studies (NIES), Japan
- ↑ a b W. M. Maskell: On Freshwater Infusoria of the Wellington District, in: Transaction New Zealand Institute, Band 20, Nr. 1, 30. November 1887, Ausgabe Mai 1888, Trübner & Co., London. Hier: Tafel III
- ↑ a b c d Arthur E. Beardsley: Notes on Colorado Protozoa, in: Transactions of American Microscopical Society, Band 23, 1902 (sic!), S. 49–59. Hier S. 58f, Tafel XI
- ↑ a b WoRMS: Strombidium caudatum Calkins, 1901
- ↑ a b c Gary N. Calkins: Marine Protozoa from Woods Hole, Bulletin of the United States Fish Commission, Band 21, 1901; Washington, DC: Government Printing Office, 1902. Hier Fig. 46
- ↑ a b Mlle Anne-Laure Sauvadet: Interactions entre ciliés et métazoaires dans deux environnements marins contrastés: les sources hydrothermales et les sédiments anoxiques, Dissertation an der Universität Pierre und Marie Curie (UPMC), Sorbonne Universités, 25. Oktober 2010, hier: Fig. 2.2 auf S. 33. Übersetzung des französischen Begleitextes:
„Zeichnung zur Veranschaulichung der morphologischen Vielfalt der Wimpertierchen (Quelle: B.J. Finlay & G.F. Esteban via P. Eigner 2001). Die Zeichnungen sind maßstabsgetreu (1 mm) wie auf der rechten Seite der Tafel angegeben. Die 167 vertretenen Arten sind im Anhang (Annex A ab S. 171) aufgeführt.“
Dort (Légende déteillée de la figure 2.2): 128. Strombidium velox - ↑ a b Strobilidium Schewiakoff, 1892, auf: The World of Protozoa, Rotifera, Nematoda and Oligochaeta. National Institute for Environmental Studies (NIES), Japan
- ↑ P. Eigner: Some Ciliated Protozoa found in Lakes and Rivers (Fig.&128 ganz oben, 2. von links), auf: The Ciliate Diversity Chart, with friendly permission of B.J. Finlay and G.F. Esteban, Institute of Freshwater Ecology, Windermere Laboratory, UK – Some Ciliated Protozoa found in Lakes and Rivers (Memento im Web-Archiv vom 31. Januar 2009). Teil vom: Protozoa - Ciliophora - Hypotrichida (Memento vom 2. Februar 2009)
- ↑ WoRMS: Strobilidium kahli Petz & Foissner, 1992
- ↑ Strombidium velox Fauré-Fremiet, 1924 in GBIF
- ↑ WoRMS: Strobilidium velox Faure-Fremiet, 1924
- ↑ D. Boltovskoy (Hrsg.): Kinety, Marine Species Identification Portal, ETI BioInformatics, KeyToNature
- ↑ a b David J. S. Montagnes, F. J. R. Taylor, D. H. Lynn: Strombidium inclinatum n. sp. and a reassessment of Strombidium sulcatum Claparède and Lachmann (Ciliophora), in: J. Protozool., Juli 1090, S. 318-323, doi:10.1111/j.1550-7408.1990.tb01152.x, Epub 1. Mai 2007
- ↑ Catherine Bernard, Tom Fenchel: Chemosensory Behaviour of Strombidium purpureum, an Anaerobic Oligotrich with Endosymbiotic Purple Non-Sulphur Bacteria, in: J. of Eukaryotic Microbiology, Band 41, Nr. 4, Juli 1994, S. 391-396, doi:10.1111/j.1550-7408.1994.tb06095.x
- ↑ Tom Fenchel, Catherine Bernard: Endosymbiotic purple non-sulphur bacteria in an anaerobic ciliated protozoon, in: FEMS Microbiol. Lett., Band 110, S. 21–25, 1. Juni 1993, doi:10.1111/j.1574-6968.1993.tb06289.x
- ↑ Tom Fenchel, Catherine Bernard: A purple Protist, in: Nature Scientific Correspondence, Band 362, Nr. 300, 25. März 1993, PDF, doi:10.1038/362300a0
- ↑ Sergio A. Muñoz-Gómez, Martin Kreutz, Sebastian Hess: A microbial eukaryote with a unique combination of purple bacteria and green algae as endosymbionts, in: Science Advances, Band 7, Nr. 24, 11. Juni 2021, eabg4102, doi:10.1126/sciadv.abg4102, Supplement
- ↑ Wilfried Probst: Frühe Evolution und Symbiose, Europa-Universität Flensburg, Institut für Biologie und Sachunterricht und ihre Didaktik. Hier: §Pflanzentiere und Kleptoplasten
- ↑ Diane K. Stoecker, Mary W. Silver: Replacement and aging of chloroplasts in Strombidium capitatum (Ciliophora: Oligotrichida), in: Marine Biology, Band 107, S. 491–502, Oktober 1990, doi:10.1007/BF01313434
- ↑ Taxon: Suborder Chlamydomonadina (alga)
- ↑ David J. S. Montagnes, Chris D. Lowe, Alex Poulton, Per R. Jonsson: Redescription of Strombidium oculatum Gruber 1884 (Ciliophora, Oligotrichia), in: The Journal of Eukaryotic Microbiology, 12. Juli 2015, doi:10.1111/j.1550-7408.2002.tb00379.x
- ↑ E. Fauré-Fremiet: The Origin of the Metazoa and the Stigma of the Phytoflagellates, in: Journal of Cell Science 1958 s3-99: S. 123-129; PDF1 @paperity
- ↑ Aditee Mitra: Meeresbiologie – Das Beste aus zwei Welten. Spektrum der Wissenschaft, Nr. 4 2019, S. 54–60. Hier: S. 57.
Auf dieser Seite verwendete Medien
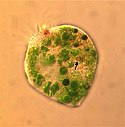
Autor/Urheber: Patricio A. Díaz, Iván Pérez-Santos, Gonzalo Álvarez, Michael Araya, Francisco Álvarez, Beatriz Reguera, Lizenz: CC BY-SA 4.0
Micrograph of ciliate genus Strombidium recorded in the net-haul samples.
Autor/Urheber: Internet Archive Book Images, Lizenz: No restrictions
Identifier: transactionsproc20newz (find matches)
Title: Transactions and proceedings of the New Zealand Institute
Year: 1887 (1880s)
Authors: New Zealand Institute
Subjects: Science
Publisher: Wellington : J. Hughes, Printer
Contributing Library: MBLWHOI Library
Digitizing Sponsor: MBLWHOI Library
View Book Page: Book Viewer
About This Book: Catalog Entry
View All Images: All Images From Book
Click here to view book online to see this illustration in context in a browseable online version of this book.
Text Appearing Before Image:
Genus Strombidium.
Strombidium intermedium, sp. nov. Plate III., fig. 17, a, b, c.
Animalcules free-swimming, ovoid, with a short posterior prolongation; colour whitish, with enclosed granules; about one and a half times longer than broad; anterior border rounded, posterior projection tapering nearly to a point. On the anterior portion is a ring of long, fine cilia, which in end-view (fig. 17, b) are seen to be disposed spirally. Contractile vesicle single, close to the posterior projection. Nucleus elongate-oval, placed diagonally below the ring of cilia. No cilia on any part except in the ring. Motion excessively rapid, jerking, and difficult to follow. An example observed of reproduction by fission is shown in fig. 17, c; the two bodies are at right angles to each other.
Length, 1/875 inch = 38.5 µ.
Otaki, W. M. Maskell.
Intermediate between S. claparedii, Kent, and S. gyrans, Stokes.*
…
* "Quart. Journ. Roy. Micros. Soc.," Feb., 1887, p. 37.
Note About The Image
Autor/Urheber: Lumi Haraguchi, Hans H. Jakobsen, Nina Lundholm, Jacob Carstensen, Lizenz: CC BY-SA 4.0
Selected images showing different ciliates morphotypes found in Roskilde Fjord
Strombidium cf. conicum, a General Non-Constitutive Mixotroph (GNCM)
Strombidium caudatum. (Accepted name: Strombidinium minor, see WoRMS: http://www.marinespecies.org/aphia.php?p=taxdetails&id=101283 Strombidium caudatum Calkins, 1901, accessed: 2021-08-09)
- Subject: Strombidium, Protozoa
- Tag: Invertebrates
Autor/Urheber: Arthur E. Beardsley: Notes on Colorado Protozoa. Trans. Am. Microsc. Soc. 23:49-59. 1902 (sic!). Here p58f. Modified from Internet Archive Book Images. Digitally enhanced extract, Lizenz: No restrictions
Identifier: transactionsmic22ameruoft (find matches)
Title: Transactions
Year: 1879 (1870s)
Authors: American Microscopical Society
Subjects: Microscope and microscopy
Publisher: Columbus, Ohio (etc.)
Contributing Library: Gerstein - University of Toronto
Digitizing Sponsor: University of Toronto
View Book Page: Book Viewer
About This Book: Catalog Entry
View All Images: All Images From Book
Click here to view book online to see this illustration in context in a browseable online version of this book.
Text Appearing After Image:
EXPLANATION OF PLATE
Plate XI
All figures (excepting … 5b) were drawn with aid of a camera lucida; the linear magnification of each figure is indicated by the number following the sign X.
…Fig. 5a-c. Strombidium velox n. sp. a. Ventral view of a quiescent individual with rounded posterior end, CV = Contractile Vesicle/Vacuole, f = ingested food, X370. b. Dorsal view of turbinate individual, showing mode of attachment. c. Isolated nuclei (stained with acetic acid carmine); ╳600.
Taxonomy (2021-08-10)
- Wolfgang Petz, Wilhelm Foissner: Morphology and Morphogenesis of Strobilidium caudatum (Fromentel), Meseres corlissi N. Sp., Halteria grandinella (Müller), and Strombidium rehwaldi N. Sp., and a Proposed Phylogenetic System for Oligotrich Ciliates (Protozoa, Ciliophora), in: J. Protozool. 39(1), jan/Feb 1992, pp159—176, here: p160
- WoRMS: Strobilidium kahli Petz & Foissner, 1992
- 5a also shown in P. Eigner: Some Ciliated Protozoa found in Lakes and Rivers (Fig. 128 top, 2nd from left) and Mlle Anne-Laure Sauvadet: Interactions entre ciliés et métazoaires dans deux environnements marins contrastés: les sources hydrothermales et les sédiments anoxiques, Fig. 2.2 on p33
Result:
- 5b may be Strobilidium kahli Petz & Foissner, 1992, which now is Rimostrombidium caudatum (Kahl, 1932) Agatha & Riedel-Lorjé, 1998
- 5a may be a Strombidium sp., i. e. Strombidium velox Beardsley, 1902, (partim, Fig. 5b)
- not to be confused: likely another synonymization is Strombidium velox Fauré-Fremiet, 1924, currently Rimostrombidium velox (Faure-Fremiet, 1924) Jankowski, 1978 (according to GBIF: Strombidium velox Fauré-Fremiet, 1924, source: The World Ciliate Catalog
Note About The Image
Autor/Urheber: Lumi Haraguchi, Hans H. Jakobsen, Nina Lundholm, Jacob Carstensen, Lizenz: CC BY-SA 4.0
Selected images showing different ciliates morphotypes found in Roskilde Fjord
Strombidium spp., a General Non-Constitutive Mixotroph (GNCM)
Autor/Urheber: George B. McManus, Weiwei Liu, Rachel A. Cole, Daniel Biemesderfer and Jennifer L. Mydosh, Lizenz: CC BY-SA 4.0
Strombidium rassoulzadegani fed four food algae that supported positive growth in the light (12:12 L:D). (A) S. rassoulzadegani fed Tetraselmis chui PLY429; arrowheads indicate different shapes and sizes of retained chloroplasts; (B) S. rassoulzadegani fed Rhodomonas lens RHODO; arrowheads as in A; (C) S. rassoulzadegani fed Isochrysis sp. ISO SP; arrowheads as in A; (D) S. rassoulzadegani fed Prorocentrum minimum JA; note that no retained plastids appear in the cell. Arrow marks the rigid wall of the algal cell and arrowhead marks the partially-digested algal cytoplasm.
Autor/Urheber: Mathilde Dugenne, Fernanda Henderikx Freitas, Samuel T. Wilson, David M. Karl, Angelicque E. White: Department of Oceanography, University of Hawaii at Manoa, Honolulu, Hawaii, Lizenz: CC BY-SA 4.0
Prey–predator dynamics of Crocosphaera grazers; here Strombidium pictured ingesting Crocosphaera cells (outlined in red).
Autor/Urheber: Lumi Haraguchi, Hans H. Jakobsen, Nina Lundholm, Jacob Carstensen, Lizenz: CC BY-SA 4.0
Selected images showing different ciliates morphotypes found in Roskilde Fjord
Strombidium cf. capitatum, a General Non-Constitutive Mixotroph (GNCM)
Autor/Urheber: Alexandra Kraberg (alexandra at planktonnet.awi.de), Lizenz: CC BY-SA 3.0
Strombidium Claparède and Lachmann, 1859. Formalin-fixed cell of a ciliate of the genus Strombidium at station P8-II; latitude 54.183 - longitude 7.7912, North Sea. Formalin-fixed cell from net haul, magnification x400, Zeiss Axioskop 2. Heincke 443 - POGO Cruise 2015.
Autor/Urheber: ja:User:NEON / commons:User:NEON_ja, Lizenz: CC BY-SA 2.5
Polykrikos(Dinoflagellate) and Strombidium(Ciliate) / from Tokyo bay, Yokohama, Kanagawa Pref., Japan / Microscope:Leica DMRD (DIC)
Autor/Urheber: George B. McManus, Weiwei Liu, Rachel A. Cole, Daniel Biemesderfer and Jennifer L. Mydosh, Lizenz: CC BY-SA 4.0
Strombidium rassoulzadegani from cultures grown on Tetraselmis chui PLY429 at 12:12 L:D (A–C) or 24 D (D–F). (A,D) Cells with adequate algae food (arrows). (B,E) Cells starved for 72 h; arrowheads mark empty vacuoles. (C,F) Algae were taken up again (arrows) after new algal food was added. Even in complete darkness (F), fed cells retain some chloroplasts.
Autor/Urheber: Xiao Chen, Xiaolu Zhao, Xiaohui Liu, Alan Warren, Fangqing Zhao, Miao Miao, Lizenz: CC BY-SA 4.0
Photomicrographs of Strombidium sulcatum in vivo (A–C) and protargol-stained specimen (D–F). Ma, macronucleus. Scale bars are 25 µm
Autor/Urheber: George B. McManus, Weiwei Liu, Rachel A. Cole, Daniel Biemesderfer and Jennifer L. Mydosh, Lizenz: CC BY-SA 4.0
Typical Strombidium rassoulzadegani cyst, with “frothy plug” at top left, and adhering organic layer. Cyst diameter is ca. 40 μm.
Autor/Urheber: George B. McManus, Weiwei Liu, Rachel A. Cole, Daniel Biemesderfer and Jennifer L. Mydosh, Lizenz: CC BY-SA 4.0
Micrograph of the marine ciliate Strombidium rassoulzadegani fed the alga Tetraselmis chui (PLY 429), showing variety of shapes and sizes of retained chloroplasts, including smaller dark green and brownish ones (arrow) that may be older than the larger “grass-green” ones.
![S. rassoulzadegani, einverleibt vier verschiedenen Algenspezies, die das Wachstum im Licht unterstützten. Pfeil: starre Zellwand der Algenzellen, Pfeilspitze: teilw. verdautes Algenzytoplasma.[14]](http://upload.wikimedia.org/wikipedia/commons/thumb/f/fc/Fmars-05-00205-g006.jpg/364px-Fmars-05-00205-g006.jpg)
![S. rassoulzadegani aus Kulturen zusammen mit T. chui nach unterschiedlichen Zeiten und unter verschiedenen Lichtbedingungen.[14]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d2/Fmars-05-00205-g007.jpg/465px-Fmars-05-00205-g007.jpg)