Sterol-Δ8/7-Isomerase
| 3-β-Hydoxysteroid-Δ8,7-Isomerase | ||
|---|---|---|
| Andere Namen |
| |
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 26,4 Kilodalton / 230 Aminosäuren | |
| Sekundär- bis Quartärstruktur | multipass Membranprotein (ER) | |
| Bezeichner | ||
| Gen-Name | EBP | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 5.3.3.5, Isomerase | |
| Reaktionsart | Umlagerung | |
| Substrat | Delta(8)-Sterol | |
| Produkte | Delta(7)-Sterol | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Eukaryoten[1] | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 10682 | 13595 |
| Ensembl | ENSMUSG00000031168 | |
| UniProt | Q15125 | P70245 |
| Refseq (mRNA) | NM_006579 | NM_007898 |
| Refseq (Protein) | NP_006570 | NP_031924 |
| Genlocus | Chr X: 48.52 – 48.53 Mb | Chr X: 8.19 – 8.19 Mb |
| PubMed-Suche | 10682 | 13595 |
Die Sterol-Δ8/7-Isomerase (auch: Emopamil-bindendes Protein (EBP)) ist das Enzym, das innerhalb von Sterolderivaten die Umlagerung der in der 8-Position befindlichen Doppelbindung in die 7-Position katalysiert. Diese Reaktion findet in allen Eukaryoten im Rahmen der Cholesterinbiosynthese statt. Es handelt sich um ein Transmembranprotein, das am endoplasmatischen Reticulum lokalisiert ist. Mutationen im EBP-Gen des Menschen sind die Ursache für einen Typ der Chondrodysplasia punctata, dem so genannten Conradi-Hünermann-Syndrom.[2]
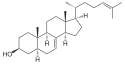
Katalysierte Reaktion
Zymosterin wird zu 5α-Cholesta-7,24-dien-3β-ol umgelagert.
Siehe auch
- MEND-Syndrom[3]
Weblinks
- D’Eustachio / reactome: Zymosterol is isomerized to cholesta-7,24-dien-3beta-ol
- Eintrag zu Chondrodysplasia punctata, X-chromosomal-dominante. In: Orphanet (Datenbank für seltene Krankheiten)
Einzelnachweise
- ↑ Homologe bei inParanoid
- ↑ UniProt Q15125
- ↑ Eintrag zu MEND-Syndrom. In: Orphanet (Datenbank für seltene Krankheiten)
Auf dieser Seite verwendete Medien
Struktur von 5alpha-Cholesta-7,24-dien-3beta-ol
Struktur von Zymosterin