Silbernitrit
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Silbernitrit | |||||||||||||||
| Andere Namen | Salpetrigsaures Silber | |||||||||||||||
| Summenformel | AgNO2 | |||||||||||||||
| Kurzbeschreibung | weißes Pulver oder gelbe Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 153,87 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | thermische Zersetzung[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
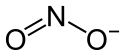
Silbernitrit (nicht zu verwechseln mit Silbernitrat) ist das Silbersalz der Salpetrigen Säure. Es ist zusammengesetzt aus dem Kation Ag+ und dem Nitritanion NO2−.
Gewinnung und Darstellung
Die Herstellung kann durch Reaktion einer Lösung von Silbernitrat mit Kaliumnitrit erfolgen. Dabei fällt ein flockiger Niederschlag von Silbernitrit aus:[3]
Eigenschaften
Silbernitrit, AgNO2, bildet ein farbloses bis gelbliches Pulver oder gelbe Kristallnadeln. Es ist in kaltem Wasser schwer löslich, in warmem Wasser ist die Löslichkeit größer, weshalb es leicht umkristallisiert werden kann. Silbernitrit zersetzt sich ab 140 °C unter Abscheidung von metallischem Silber und Abgabe nitroser Gase. Aufgrund der leichten Oxidierbarkeit durch Luftsauerstoff muss es gut verschlossen gelagert werden. Unter Lichteinfluss tritt allmähliche Zersetzung zu Silber und Stickstoffdioxid ein.[2]

Verwendung
Gefälltes und gewaschenes Silbernitrit kann durch Umsetzung mit Alkali- oder Erdalkalichloriden zur Darstellung der reinen entsprechenden Alkali- bzw. Erdalkalinitrite verwendet werden, z. B.:
Einzelnachweise
- ↑ Wilhelm Segerblom: Tables of Properties of Over Fifteen Hundred Common Inorganic Substances., S. 86. (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ a b c d Mary Eagleson: Concise encyclopedia chemistry, S. 988., (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ a b c H.J.M. Creighton & W.H. Ward: Determination of the solubility of silver nitrite and its degree of dissociation in a saturated solution, J. Am. Chem. Soc., 37, 1915, 2333–2338.
- ↑ a b Datenblatt Silver nitrite, 99.98% trace metals basis bei Sigma-Aldrich, abgerufen am 13. November 2020 (PDF).
Auf dieser Seite verwendete Medien
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Autor/Urheber: Heiko4, Lizenz: CC BY-SA 4.0
Silbernitrit, gefällt aus Silbernitrat-Lösung mit einem Körnchen Natriumnitrit, mikroskopisch, polarisiertes Licht, etwa 160fach vergrößert
Struktur des Ag+-Ions
Struktur des Nitrit-Ions
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances