Silber(I)-oxid
| Kristallstruktur | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| _ Ag+ _ O2− | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Silber(I)-oxid | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Verhältnisformel | Ag2O | |||||||||||||||||||||
| Kurzbeschreibung | schweres, fast schwarzes, samtartiges Pulver[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 231,74 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest[2] | |||||||||||||||||||||
| Dichte | 7,2 g·cm−3 (20 °C)[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | praktisch unlöslich in Wasser[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | 0,01 mg·m−3[3] | |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 | −31,1 kJ/mol[4] | |||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Silber(I)-oxid (Ag2O) ist eine chemische Verbindung aus der Gruppe der Oxide.
Gewinnung und Darstellung
Silber(I)-oxid ist das Reaktionsprodukt aus der Reaktion zwischen dem Edelmetall Silber mit Sauerstoff.
Auch kann Silber(I)-oxid gewonnen werden, indem Silbernitrat-Lösung zu Natronlauge oder Kalilauge hinzugefügt wird. Silber(I)-oxid fällt dann im Alkalischen als brauner Niederschlag aus.
Eigenschaften
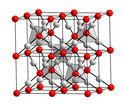
Silber(I)-oxid ist ein braunes Pulver, das bei Einwirkung von Sonnenlicht nachdunkelt. Feuchtes Silber(I)-oxid ist sehr wenig lichtempfindlich und zersetzt sich beim Trocknen etwas. Es besitzt eine Kristallstruktur vom Cu2O-Typ mit der Raumgruppe Pn3m (Raumgruppen-Nr. 224) (a = 475,2 pm) und eine Bildungsenthalpie von −30,5 kJ/mol.[5] Aufschlämmungen von Silberoxid in Wasser reagieren deutlich alkalisch, da dabei die Umkehrung der obigen Reaktion geschieht und Silber- und Hydroxidionen gebildet werden.[6]
In Umkehrung der Synthesereaktion wird Silber(I)-oxid beim Erhitzen wieder in die Elemente Silber und Sauerstoff zersetzt (Thermolyse).
An der Luft reagiert Silber(I)-oxid mit Kohlenstoffdioxid zu Silbercarbonat.
Verwendung
In der präparativen organischen Chemie wird Silber(I)-oxid in einer Variante der Williamson-Ethersynthese verwendet.[7]

Silber(I)-oxid ist in Wärmeleitpaste zur Weiterleitung der Prozessorwärme an den Kühlkörpern im Computer enthalten, da es eine hohe Wärmeleitfähigkeit besitzt.
Silber(I)-oxid ist Bestandteil der Silberoxid-Zink-Batterie, die in Armbanduhren und anderen Kleingeräten eingesetzt wird.
Einzelnachweise
- ↑ Eintrag zu SILVER OXIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 4. Mai 2020.
- ↑ a b Eintrag zu Silberoxide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. September 2014.
- ↑ a b c d e f g Eintrag zu Silber(I)-oxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-4.
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 998.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- ↑ Masato Tanabe and Richard H. Peters: (R,S)-Mevalonolactone-2-13C In: Organic Syntheses. 60, 1981, S. 92, doi:10.15227/orgsyn.060.0092; Coll. Vol. 7, 1990, S. 386 (PDF).
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Autor/Urheber: Orci, Lizenz: CC BY-SA 3.0
Kristallstruktur von de:Kupfer(I)-oxid
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Williamson Ethersynthese mit Silberoxid