Phloem

Das Phloem [] (von altgriechisch φλοῦς < φλό-οςphlóos, deutsch ‚Bast, Rinde‘) oder der Siebteil ist derjenige Teil eines Leitbündels bei Gefäßpflanzen, der die Siebelemente, das heißt die assimilatleitenden Zellen, und die sie begleitenden Parenchym- und Festigungszellen umfasst.[1] Bei Bäumen wird das aktive Phloem häufig als Bast bezeichnet.
Die wichtigsten transportierten Stoffe sind Zucker (vorwiegend Saccharose) und Aminosäuren. Sie werden von den Orten ihrer Produktion (source, vorwiegend die Laubblätter, aber auch Speicherorgane bei der Mobilisierung der Nährstoffe) zu den Orten des Verbrauchs (sinks, Speicherorgane, wachsende Organe) transportiert. Die Leitbündel und damit auch das Phloem durchziehen alle Organe der Pflanzen. Der Transport erfolgt in speziellen Zellen innerhalb des Phloems: den Siebröhrengliedern bei Bedecktsamern, bzw. den Siebzellen bei den übrigen Gefäßpflanzen. Die Siebröhrenglieder bilden mit den Geleitzellen eine funktionelle Einheit, wobei in den Siebröhren der Transport stattfindet und die Geleitzellen für den Stoffwechsel zuständig sind.
Entsprechend seiner Hauptfunktion wird das Phloem in drei Abschnitte geteilt: im Sammelphloem, zumeist in den kleinen Leitbündeln der photosynthetisch aktiven Blätter, erfolgt die Phloembeladung. Im Transportphloem erfolgt der Langstreckentransport. Im Abgabephloem werden die transportierten Substanzen an die umgebenden Zellen abgegeben.
Vorkommen
Ein Phloem im eigentlichen Sinne kommt nur bei den Gefäßpflanzen vor. Es ist Teil des Leitbündels, das neben dem Phloem auch das Xylem enthält. Bei Moosen besitzen die haploiden Moospflanzen vieler Laubmoose langgestreckte Zellen, die der Assimilatleitung dienen und als Leptoiden bezeichnet werden.
Zelltypen
Bei den Gefäßpflanzen treten im Phloem eine Reihe von Zelltypen auf, die sich in Gestalt und Funktion unterscheiden.
Siebelemente
Die Siebelemente sind die eigentlichen Leitelemente, in denen der Transport stattfindet. Es sind spezialisierte Zellen. Bei den Farnen und den Nacktsamern sind dies Siebzellen, bei den Bedecktsamern aus mehreren Gliedern zusammengesetzte Siebröhren.
Siebröhren

si = Querwände der jungen Siebröhren
pp = Phloemparenchym
cc = Cambium

q = Querwände
si = junge Siebplatte
x und l = Orte, an denen Siebplatten entstehen
z = parenchymatische Zellen zwischen Siebröhren
(Der Schleim sl und ps ist ein Artefakt, das durch die Verletzung entsteht)
Die Siebröhren der Bedecktsamer bestehen aus einzelnen Zellen, den Siebröhrengliedern. Zusammen mit den Geleitzellen bilden sie die funktionelle Einheit des Siebröhren/Geleitzellenkomplexes. Funktionsfähige Siebröhrenglieder sind im Gegensatz zu den wasserleitenden Gefäßen im Xylem zwar lebende Zellen, unterscheiden sich aber wesentlich von einer durchschnittlichen Pflanzenzelle: Sie zeichnen sich durch das Fehlen eines Zellkerns aus. Eine Vakuole fehlt ebenfalls, auch Ribosomen, Cytoskelett und Golgi-Apparat sind in reifen, funktionsfähigen Siebröhrengliedern nicht vorhanden. Plastiden sind vorhanden, Mitochondrien sind wenige vorhanden und wahrscheinlich nicht funktionsfähig. Die Siebröhrenglieder sind aufgrund ihrer unvollständigen Ausstattung auf die Unterstützung durch die Geleitzellen angewiesen.[2]
Im Zuge der Zellreifung stirbt der ursprünglich vorhandene Zellkern ab und löst sich auf. Bei einigen Arten bleibt das Chromatin als amorphe Masse erhalten. Auch der Tonoplast, der die Vakuole umgibt, löst sich auf. Die Zellmembran bleibt jedoch intakt. Van Bel hat diesen Vorgang als „Programmierten Zell-Halbtod“[3] beschrieben. Das Endoplasmatische Reticulum (ER) und die Proteine verbleiben wandständig und werden nicht vom Transportstrom erfasst. Es wurden sieben Nanometer lange Ankermoleküle entdeckt, die ER, Mitochondrien, Plastiden untereinander und an der Zellmembran verankern.[4] Das ER ist im Vergleich zu den anderen Organellen gut entwickelt und liegt netz- oder stapelförmig vor und wird Siebelement-ER (SER) genannt. Möglicherweise dient das ER auch zum Transport von Proteinen von den Geleitzellen in die Siebröhren.[5] Der zentrale Bereich der Zellen, in dem der Transport stattfindet, wird Lumen genannt. Die Siebröhren stehen aufgrund der hohen Saccharosekonzentration unter einem hohen Turgor, der bis 1,5 MPa (15 bar) erreichen kann.[6]
Siebröhren sind vielfach kurzlebig, können jedoch in Palmen 30 Jahre lang funktionsfähig bleiben.[3] Die Länge von Siebröhrengliedern beträgt in sekundärem Phloem bei Zweikeimblättrigen zwischen 100 und 500 Mikrometer bei einem Durchmesser von 10 bis 70 Mikrometer. Bei Einkeimblättrigen sind die Siebröhrenglieder bei Yams (Dioscorea) 100 Mikrometer lang und 5 bis 10 Mikrometer breit, bei manchen Palmen 5000 Mikrometer (5 mm) lang und 400 Mikrometer breit.[7] Die Querwände der Siebröhrenglieder sind je nach Art unterschiedlich stark schräggestellt und siebartig durchbrochen. Aus den Plasmodesmen der jungen Zellen entwickeln sich Siebporen mit wesentlich größerem Durchmesser (ein bis 14 Mikrometer). In jungen Siebröhren sind die Poren häufig von Callose umgeben, die sich später großteils auflöst. Die Siebporen stehen in Siebfeldern oder, wenn mehrere Siebfelder auf einer Querwand stehen, in Siebplatten. Durch die Poren hindurch führt das Plasmalemma der Zellen, nicht jedoch das Endoplasmatische Reticulum.
In Siebröhrenexsudaten sind bis jetzt 150 bis 200 lösliche Proteine nachgewiesen worden.[8] Dazu zählen alle Enzyme der Glykolyse, Proteine des Proteinabbaus (Ubiquitin), Sauerstoff-Radikal-Fänger (Glutaredoxin, Glutathion-Reduktase), verschiedene Proteinase-Inhibitoren (als Abwehr gegen Herbivoren). Ein Großteil der Proteine scheint mit Stress- und Abwehrreaktionen verbunden zu sein.[9] Charakteristisch für Siebröhren sind die sogenannten P-Proteine (P für Phloem). Diese sind bei jungen Siebröhren als Proteinkörper ausgebildet. Bei den meisten Arten lösen sich diese Proteinkörper bei Reife auf, die Proteine verbleiben im randständigen Plasma. Bei rund 10 Prozent der untersuchten Arten bleiben die Proteinkörper als solche erhalten. Bei Schmetterlingsblütlern sind diese spindelförmig, kristallin und lösen sich bei Verletzung oder rascher Turgoränderung der Siebröhre – generell Signale zum Verschluss der Siebplatten, um den Verlust von Phloemsaft zu verhindern – auf, wobei diese Auflösung reversibel ist. Auch in anderen Arten lösen sich die P-Proteine bei Verletzung von der Wand und verschließen die Siebporen. Andere Möglichkeiten des Verschlusses der Siebporen sind das „Explodieren“ der Plastiden und die Bildung von Callose, wobei die Bildung von Callose eher als die dauerhafte und langsam gebildete Verschlussmöglichkeit angesehen wird.
Siebröhrenplastiden
Die Plastiden der Siebröhren werden in zwei Gruppen eingeteilt: P-Typ-Plastiden enthalten Proteinkörper, S-Typ-Plastiden fehlen diese. Bei den Nacktsamern besitzen die Kieferngewächse (Pinaceae) als einzige P-Plastiden, alle übrigen Familien den S-Typ. Von 382 untersuchten Zweikeimblättrigen-Familien haben 320 ausnahmslos den S-Typ, nur 48 den P-Typ, 14 Familien hatten sowohl Arten mit S- als auch mit P-Typ.[2] Bei den Nelkenartigen (Caryophyllales) herrschen Plastiden vom P-Typ mit fädigen Proteineinschlüssen vor, bei den Einkeimblättrigen der P-Typ mit kristalloiden Proteineinschlüssen.[10] Die Funktion der Siebröhrenplastiden generell wie auch die Bedeutung der einzelnen Typen ist ungeklärt, diskutiert wird eine Rolle in der Wundreaktion und als Speicherorganell.[2]
Siebzellen
Siebzellen kommen bei den Nacktsamern vor. Zumindest bei den Kiefernartigen ist in den Siebzellen ein Kern-Rest vorhanden. Die Siebröhrenplastiden gehören zum P- oder S-Typ, eine Vakuole fehlt ebenso wie Ribosomen, ein Cytoskelett oder Golgi-Apparat. Das Endoplasmatische Reticulum gleicht dem der Bedecktsamer. Bei Gefäßsporenpflanzen sind normale Plastiden vorhanden, die Mitochondrien sind funktionell.[2] Die Länge der Siebzellen beträgt bei Kiefernartigen zwischen 1400 und 4850 Mikrometer. Die Querwände zwischen den Siebzellen sind geneigt und wie die Längswände fein perforiert in sogenannten Siebfeldern. Bei rezenten wie auch fossilen Nacktsamern sind die Siebzellen recht einheitlich aufgebaut.[11]
Siebelemente der Gefäßsporenpflanzen
Bei den Gefäßsporenpflanzen (Bärlapppflanzen und Farne) sind die Siebelemente ähnlich länglichen Parenchymzellen. Der Durchmesser beträgt um 10 Mikrometer, selten mehr als 40 Mikrometer. Die Länge bleibt unter 600 Mikrometer. Die Zellwand zwischen den Siebelementen steht senkrecht oder leicht schräg, die Siebflächen sind klein und variabel, die Siebporen haben einen Durchmesser von rund einem Mikrometer. Der Aufbau der Siebelemente ist bei allen Vertretern, rezenten wie fossilen, recht einheitlich.[11]
Geleitzellen
Die Geleitzellen sind kleine parenchymatische Zellen und treten nur bei den Bedecktsamern auf. Sie enthalten einen Zellkern und zahlreiche Mitochondrien. Sie sind durch zahlreiche Plasmodesmen mit den Siebröhren verbunden. Diese Plasmodesmen sind spezielle Verbindungen und werden PPUs (pore-plasmodems unit, etwa Poren-Plasmodesmen-Einheit) genannt: Sie sind verzweigt und besitzen an der Geleitzellen-Seite bis zu 100 Zweige, die sich in der Mitte zu einer zentralen Höhle vereinigen und auf der Siebröhrenseite einen etwas weiteren Kanal bilden. Durch die PPUs hindurch zieht sich Endoplasmatisches Reticulum. Viele, wenn nicht alle der Siebröhren-Proteine werden in den Geleitzellen synthetisiert und über die PPUs in die Siebröhren transportiert. Proteine bis zu 100 kDa können passieren, wahrscheinlich aufgrund spezieller Proteine, die die Passage großer Moleküle erlauben.[3]
Es gibt verschiedene Formen der Geleitzellen, die mit der Art der Phloembeladung in Zusammenhang stehen. Nach der Anzahl der Plasmodesmen zwischen dem umgebenden Parenchym und den Geleitzellen werden nach Yuri Gamalei drei Typen unterschieden, der rund 1000 Arten derart einteilte. Diese sind meist familienspezifisch:[3][12]
- Typ 1 besitzt viele Plasmodesmen (10 bis 60 pro µm2 Zelloberfläche). Dieser Typ kommt vor allem in basalen Vertretern der Bedecktsamer vor und daher als ursprünglich angesehen.[12] Er tritt vorwiegend bei Holzpflanzen auf.
- Typ 1–2a besitzt relativ viele Plasmodesmen (10 bis 0,1 pro µm2). Dieser Typ kommt weit verstreut im Stammbaum der Bedecktsamer vor.
- Typ 2 besitzt wenige Plasmodesmen (unter 0,1 pro µm2). Typ 2a, die gewöhnlichen Geleitzellen, kommen weit verbreitet vor, besonders bei Einkeimblättrigen (nicht bei Palmen, die haben Typ 1–2a) und vielen Nutzpflanzen. Typ 2b sind die im nächsten Absatz beschriebenen Transferzellen.
Nach der Morphologie der Geleitzellen werden folgende Typen unterschieden:[3]
- Übergangszellen (intermediary cells) besitzen kleine Vakuolen und rudimentäre Plastiden ohne Thylakoide oder Stärke.[5] Sie entsprechen vielfach dem Typ 1. Die zahlreichen Plasmodesmen werden in Blättern durch bereits bestehende Zellwände hindurch gebildet, kurz bevor das Blatt zum Kohlenhydrat-Exporteur wird.[5] Alle Vertreter mit Übergangszellen bilden Kohlenhydrate der Raffinose-Familie als Transportsubstanzen. Diese kommen im umgebenden Mesophyll nicht vor, diffundieren also nicht durch die Plasmodesmen und ermöglichen so im Siebröhren-Geleitzellen-Komplex eine höhere Kohlenhydratkonzentration als in der Umgebung. Vertreter sind etwa die Kürbisgewächse, Ölbäume (Olea) und Königskerzen (Verbascum), Spindelsträucher (Euonymus), und Hortensien (Hydrangea).[12]
- Glatte Zellen bilden keine Vakuolen und keine Zellwandeinstülpungen aus. Sie entsprechen meist dem Typ 1–2a und beinhalten Saccharose und teilweise Zuckeralkohole als Transportkohlenhydrate.
- Transferzellen besitzen an der Innenseite Zellwandeinstülpungen, die zu einer Vergrößerung der Zelloberfläche führen. Sie entsprechen dem Typ 2b. Transferzellen zeichnen sich durch eine wesentlich höhere Saccharose-Konzentration aus als die benachbarten Parenchymzellen. Geleitzellen dieses Typs werden als Transferzellen vom A-Typ bezeichnet, während der B-Typ Parenchymzellen gleichen Baus sind, deren Funktion möglicherweise in der Abgabe von Saccharose in den Apoplasten dient.[12]
Ontogenetisch entstehen Siebröhren und Geleitzellen als gemeinsamer Komplex aus gemeinsamen Mutterzellen, die sich jeweils durch ungleiche Teilung in das größere Siebröhrenglied und die kleinere Geleitzelle teilen.
Bei Farnen und Nacktsamern gibt es ebenfalls parenchymatische Zellen, die eng mit den Siebzellen verbunden sind, jedoch nicht aus derselben Mutterzelle hervorgehen. Diese Zellen werden als Eiweiß- oder Strasburger-Zellen bezeichnet. Die Strasburger-Zellen sind mit vielen Plasmodesmen mit den übrigen Parenchymzellen verbunden.
Sklerenchymzellen

v = Siebröhre, v* = Siebplatte in einer Röhre
c = Geleitzelle, p = Bastparenchym, k = kristallführende Zelle
l = Bastfasern, r = Markstrahl
Sklerenchymfasern kommen häufig in primärem und sekundärem Phloem vor. Im primären Phloem (vor dem sekundären Dickenwachstum) treten sie meist ganz außen auf, im sekundären Phloem (nach dem sekundären Dickenwachstum) sind sie verschieden verteilt. Die Fasern können in Längsrichtung in mehrere Zellen unterteilt (septiert) sein oder nicht, und sie können im ausdifferenzierten Zustand lebend oder tot sein.
Oft sind auch Sklereiden anzutreffen. Sie treten allein oder zusammen mit den Fasern auf. Sie können axial oder radial orientiert sein. Sie entstehen in älteren Phloemteilen durch Sklerifizierung von Parenchymzellen. Dabei können sich die Sklereiden verlängern und verzweigen.
Parenchym
Die Parenchymzellen speichern verschiedene Substanzen, darunter Stärke, Tannine und Kristalle. Im sekundären Phloem unterscheidet man zwischen axialem Parenchym und Strahlenparenchym. Kristallzellen besitzen verdickte Zellwände.
Ontogenie
Im Verlauf der Ontogenie erfolgt im Embryo die Differenzierung in die verschiedenen Gewebe etwa gleichzeitig mit der Ausbildung der Keimblätter, wobei die Leitbündel aus dem Prokambium (plasmareiche Zellen mit kleiner Vakuole) in den Keimblättern und der Hypokotyl-Wurzel-Achse entstehen. Das Gefäßsystem des Keimlings entsteht daraus durch Vergrößerung und Ausdifferenzierung.
Primäres Phloem
Das primäre Phloem ist das Phloem vor dem sekundären Dickenwachstum. Es besteht aus Protophloem und Metaphloem. Das Protophloem wird in den noch in Längsstreckung befindlichen jüngsten Pflanzenteilen gebildet: in der Streckungszone der Sprossachse und der Wurzel. Das Protophloem wird dabei meist früher als das Protoxylem gebildet. Die Siebelemente des Protophloems bestehen bei Bedecktsamern bereits aus kernlosen Zellen, die jedoch eng und unauffällig sind. Geleitzellen können fehlen. Beim weiteren Wachstum werden die Zellen des Protophloems gedehnt und verlieren ihre Funktionalität. Häufig befinden sich im Protophloem längliche Parenchymzellen, die sich mit dem Längenwachstum mitstrecken und nach dem Verlust der Siebelemente im Protophloem zu Faserzellen ausdifferenzieren. Diese Fasern am Rand des Phloems werden als perizyklische Fasern bezeichnet.
Das Metaphloem differenziert sich nach dem Ende des Streckungswachstums und bildet in Pflanzen ohne sekundärem Dickenwachstum, etwa bei krautigen Pflanzen, das einzige vorhandene Phloem.
Bei den Gefäßsporenpflanzen ist das Phloem wesentlich einfacher aufgebaut und besteht nur aus Siebelementen und Parenchymzellen.[11]
Sekundäres Phloem

Das sekundäre Phloem wird im Rahmen des sekundären Dickenwachstums von Sprossachsen und Wurzeln gebildet. Es umfasst das gesamte vom Kambium nach außen abgegebene Gewebe und wird als Bast bezeichnet. Im Allgemeinen ist es im Vergleich zum Holz- = Xylemteil wesentlich weniger ausgeprägt. Das alte Phloem, das ganz außen liegt, wird im Verlauf des Dickenwachstums immer mehr zusammengedrückt. Häufig wird das nicht mehr funktionsfähige Phloem durch ein Periderm von der Achse abgetrennt.
Funktionell ist nur der innerste, beim Kambium befindliche Teil des sekundären Phloems.
Transportierte Substanzen
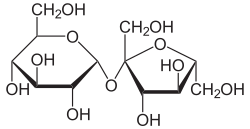

Der Inhalt der Siebröhren ist eine 0,5- bis 1-molare wässrige Lösung, in der die Kohlenhydrate überwiegen. Das Hauptkohlenhydrat ist Saccharose (100 bis 300 g L−1).[6] Reduzierende Kohlenhydrate fehlen.
Pflanzensippen, die Kohlenhydrate ausschließlich oder fast ausschließlich in Form von Saccharose transportieren, sind die Farne, die Nacktsamer, die Einkeimblättrigen sowie die Schmetterlingsblütler.[13]
Etliche Sippen transportieren neben Saccharose bedeutende Mengen an Vertretern der Raffinose-Familie (Raffinose, Stachyose und Verbascose, selten auch Ajugose), so in Kürbisgewächsen (Cucurbitaceae), den Linden (Tilia), den Haseln (Corylus), Ulmen (Ulmus) und Ölbäumen (Olea).[14] Weiters in den Familien Trompetenbaumgewächse (Bignoniaceae), Spindelbaumgewächse (Celastraceae), Scheinellergewächse (Clethraceae), Flügelsamengewächse (Combretaceae), Lippenblütler (Lamiaceae), Myrtengewächse (Myrtaceae), Nachtkerzengewächse (Onagraceae), Rautengewächse (Rutaceae) und Eisenkrautgewächse (Verbenaceae).[13]
Andere Sippen transportieren Zuckeralkohole. Eschen (Fraxinus) und Flieder (Syringa) beispielsweise enthalten D-Mannitol. Die Unterfamilien Spiroideae, Maloideae und Prunoideae innerhalb der Rosengewächse etwa enthalten Sorbitol. Der dritte Zuckeralkohol ist Dulcitol, der z. B. in Celastraceae vorkommt.[13] Über die Physiologie der Zuckeralkohole im Phloem ist relativ wenig bekannt.[15]
Als Transportmolekül für Schwefel dient reduziertes Glutathion. Der pH-Wert ist mit 7,4 bis 8,7 recht hoch. Stickstoff-haltige organische Verbindungen sind Aminosäuren und Amide, vor allem Glutamat/Glutamin und Aspartat/Asparagin. Nitrat und Ammonium fehlen im Phloem. Daneben werden auch Proteine und Hormone über das Phloem transportiert.[6]
Im Phloem werden auch etliche mineralische Nährstoffe transportiert, diese sind jedoch unterschiedlich phloemmobil. Neben den bereits erwähnten Schwefel und Stickstoff sind Kalium und Magnesium in hohem Maße im Phloem vorhanden, daneben sind Phosphor und Chlor gut phloemmobil. Eingeschränkt phloemmobil sind Eisen, Zink, Kupfer, Bor und Molybdän. Kaum phloemmobil sind Kalzium und Mangan. Alle Elemente außer diesen beiden werden etwa vor dem herbstlichen Laubfall mobilisiert und über das Phloem aus dem Blatt transportiert. Der Phloemtransport von anorganischen Ionen ist für die Versorgung von kaum transpirierenden, wachsenden Organen wie Früchten und Wurzelspitzen wichtig. Für Kalzium bildet die Weiße Lupine eine Ausnahme, die aufgrund hoher Konzentration von organischen Säuren (v. a. Succinat) auch hohe Kalziumkonzentrationen im Phloem aufweist.[16]
Die Siebröhren haben eine auffallend hohe Konzentration von ATP. Sie transportieren Vitamine, die auch in Pflanzen nur von photosynthetisch aktiven Zellen hergestellt werden können und in die heterotrophen Organe transportiert werden müssen, wie Thiamine, Niacin und Pantothensäure. Pflanzenhormone wie Indolessigsäure, Gibberelline und Cytokinine werden ebenfalls über das Phloem transportiert und wirken als Fernsignale. Als Fernsignale werden manche Proteine sowie ebenfalls transportierte mRNA angesehen.[3][13]
An Fremdsubstanzen werden im Phloem Insektizide und Herbizide transportiert,[17] ebenso Parasiten wie manche Viren.[3]
Phloembeladung
Um an die Orte des Verbrauchs (sinks) transportiert werden zu können, müssen die Kohlenhydrate und Aminosäuren von den Organen ihrer Bildung (sources) in die Siebröhren gelangen. Die Aufnahme erfolgt hauptsächlich in den feinsten Leitbündeln der photosynthetisch aktiven Blätter, diese Bereiche werden als Sammelphloem bezeichnet. Am besten untersucht ist die Phloembeladung der Saccharose. Im Bereich des Sammelphloems ist der Querschnitt der Geleitzellen wesentlich größer als der der Siebröhren. Es gibt prinzipiell zwei Wege, wie die Transportsubstanzen von den Mesophyllzellen, wo sie produziert werden, in die Siebröhren gelangen können: über den symplastischen und den apoplastischen Weg:
Apoplastische Phloembeladung
Bei Arten mit apoplastischer Phloembeladung bestehen meist keine oder kaum Plasmodesmen zwischen dem Parenchym und den Geleitzellen (Typ 2). Die Geleitzellen sind meist als Transferzellen ausgebildet. Die Saccharose wird von den Parenchymzellen in den Zwischenzellbereich (Apoplasten) abgegeben und von den Geleitzellen aktiv aufgenommen. Zur Vergrößerung der Oberfläche ist die Zellwand und damit auch das Plasmalemma der Geleitzellen stark eingewölbt. Die Aufnahme der Saccharose erfolgt durch Saccharose-H+-Symporter entgegen dem Konzentrationsgefälle. Die dazu nötige Energie wird durch nach außen gerichtete H+-ATPasen bereitgestellt, die unter Energieaufwand einen Protonengradienten aufbauen. Die Protonen fließen in Richtung des Protonengradienten zusammen mit der Saccharose (diese gegen ihren Gradienten) durch den Saccharose-H+-Symporter in die Transferzelle. Die ATPasen sind überwiegend in den Geleitzellen lokalisiert. Der dadurch erreichte Saccharosegradient ist wesentlich stärker als der Zuckergradient bei der symplastischen Beladung. Der für den Massentransport nötige Einstrom von Wasser in den Siebröhren/Geleitzellen-Komplex wird durch Aquaporine erleichtert.
Symplastische Phloembeladung
Hier erfolgt der Transport der Saccharose zwischen den Zellen über die Verbindungskanäle, die Plasmodesmen. Die Saccharose verlässt also den Symplasten nie. Sie gelangt von den Mesophyllzellen über die Geleitzellen in die Siebröhren. Zwischen Geleitzellen und den umgebenden Parenchymzellen gibt es sehr viele Plasmodesmen. Die Annahme, dass alle Arten mit vielen Plasmodesmen, also mit Typ 1, Arten mit symplastischer Phloembeladung sind, hat sich als falsch herausgestellt.[18]
Eindeutig symplastische Phloembelader sind Arten, die Kohlenhydrate der Raffinose-Familie transportieren. Bei ihnen gelangt Saccharose durch die Plasmodesmen in die Geleitzellen, die hier Übergangszellen sind. In den Geleitzellen wird die Saccharose in Raffinose und die weiteren Vertreter der Familie umgebaut. Diese höhermolekularen Zucker können nicht mehr durch die Plasmodesmen zurück in das Parenchym gelangen (sogenannte polymer trap = Polymer-Falle). Sie gelangen durch die größeren Plasmodesmen in die Siebröhren. Dadurch wird der Aufbau einer höheren Kohlenhydratkonzentration im Siebröhren/Geleitzellen-Komplex als im umgebenden Parenchym ermöglicht.
Bei einigen Arten, die aufgrund ihrer zahlreichen Plasmodesmen Typ 1 als symplastische Phloembelader galten, konnte eine vorwiegend apoplastische Beladung nachgewiesen werden. Diese Arten transportieren fast nur Saccharose. Die wenigen untersuchten Arten weisen im gesamten Blatt-Mesophyll hohe Plasmodesmen-Dichten auf, die Plasmodesmen der Geleitzellen haben wahrscheinlich keinen Zusammenhang mit der Phloembeladung. Das Zurückströmen der Saccharose aus den Geleitzellen ins Parenchym wird möglicherweise durch ein zeitweiliges Verschließen der Plasmodesmen erreicht. Möglicherweise sind alle oder viele Arten des Typs 1, die keine Raffinose transportieren, apoplastische Belader.[18]
Ansonsten besteht bei Arten mit symplastischer Beladung, die aber nur Saccharose transportieren, das Problem, wie die Saccharose in die Geleitzellen gelangt. Aktive Transportvorgänge für kleine Moleküle wie Saccharose sind für Plasmodesmen nicht bekannt. Eine Möglichkeit für die Funktionalität ist ein genereller Saccharosegradient vom Mesophyll bis zu den Siebröhren.[3]
Bei den glattwandigen Geleitzellen fehlt ein Konzentrationsgradient zwischen Parenchym und Geleitzellen. Näher untersucht wurde diese Art der Geleitzellen lediglich bei der Trauerweide (Salix babylonica)[19]: Hier dürfte es keine aktive Beladung des Phloems geben. Ausschlaggebend für den Transport scheint einzig der Konzentrationsgradient zwischen dem Mesophyll und dem Transportphloem zu sein.[3]
Phloementladung
Die Phloementladung findet an den Orten des Verbrauchs statt. In diesem Phloembereich sind die Geleitzellen sehr klein oder fehlen ganz. Die Entladung dürfte aufgrund des stets hohen Konzentrationsgradienten zwischen Siebröhre und Parenchym überwiegend symplastisch erfolgen, jedoch wurden beide Transportwege beobachtet. Bei Kartoffeln erfolgt in den Stolonen während des Längenwachstums die Entladung apoplastisch, bei Beginn des Knollenwachstums erfolgt die Umstellung auf symplastische Entladung. In den Wurzelspitzen und in jungen Blättern dürfte die Entladung rein symplastisch erfolgen.[20]
Transportmechanismen
Das Transportphloem umfasst den größten Teil des gesamten Phloems. Im Transportphloem ist die Querschnittsfläche der Siebröhren gegenüber den Geleitzellen wesentlich größer, entsprechend der vorherrschenden Funktion des Transports. In diesem Bereich kommen H+-ATPasen und Saccharose-Transporter sowohl in Geleitzellen wie in Siebröhren vor. Die Siebröhren des Transportphloems sind keine absolut dichten Röhren. Sie verlieren einen nicht unbedeutenden Teil der transportierten Saccharose (bei Phaseolus vulgaris rund sechs Prozent pro Zentimeter Sprossachse), von dem ein Großteil wieder in die Siebröhren aufgenommen wird. Der Rest dient der Versorgung der Gewebe im Stamm. Im Transportphloem dürften die Siebröhren/Geleitzellen-Komplexe weitgehend symplastisch isoliert sein.
Von mehreren diskutierten Transportmechanismen sind zwei übriggeblieben, die sich jedoch nicht gegenseitig ausschließen, sondern eher die Extrempunkte einer Übergangsreihe darstellen. Allerdings wird der Druckstromtheorie die größere Bedeutung beigemessen.[21]
Die Druckstromtheorie, von Ernst Münch 1930 erstmals detailliert ausformuliert, wird heute überwiegend akzeptiert.[3][22] Sie besagt, dass der Fluss durch das Phloem auf der Differenz im osmotischen Druck zwischen den Enden des Phloems beruht. Durch den osmotischen Druck kommt es zu einem Einströmen von Wasser im Sammelphloem und somit zu einem hydrostatischen Druckgradienten. Dieser treibt einen Massenstrom durch die Siebröhre entsprechend dem Gesetz von Hagen-Poiseuille an. Im Entladephloem kommt es zusammen mit dem Entladen der Saccharose zu einem Ausströmen von Wasser. Dieses Wasser wird entweder für das Wachstum (Wurzelspitzen, Früchte) verwendet oder über das Xylem zurücktransportiert. Gemäß der Druckstromtheorie ist also die Saccharose zugleich Triebmittel wie auch transportierte Substanz. Die in geringer Konzentration vorhandenen Substanzen werden demnach passiv im Massenstrom mittransportiert. Massenstrom wurde mithilfe von thermoelektrischen Messungen und Konfokalem Laser-Rastermikroskop nachgewiesen. Die ursprüngliche Theorie von Münch wurde bereits mehrfach adaptiert, so ist das Transportphloem nicht undurchlässig, wie von Münch angenommen.
Der Massenfluss ist dabei das Produkt aus Volumenfluss , der Querschnittsfläche der Siebröhren und der Konzentration der transportierten Assimilate :[23]
Der Volumenfluss ist wiederum das Produkt aus der hydraulischen Leitfähigkeit des Phloems und der Differenz des hydrostatischen Drucks zwischen Ort der Beladung (source) und Ort der Entladung (sink) :[23]
Der hydraulische Leitwert gilt als nicht transportlimitierend, somit wird der Massenstrom durch die hydrostatische Druckdifferenz und die Assimilatkonzentration bestimmt. Damit sind Phloembeladung und -entladung entscheidend für den Transport.[23][24]
Die zweite Theorie ist die Volumenstromtheorie, die von Walter Eschrich 1972 aufgestellt wurde. Sie geht davon aus, dass sich osmotische Prozesse nicht nur am Anfang und Ende des Phloems abspielen, sondern entlang der gesamten Strecke. Saccharose kann demnach an jeder beliebigen Stelle des Phloems be- und entladen werden. Gestützt wird dies durch das Vorhandensein von Saccharosetransportern in den Siebröhren des Transportphloems zumindest einiger Arten. Durch den jeweils folgenden Nachstrom von Wasser kommt es zu lokalen Volumenzunahmen im Phloem und damit zu einer Bewegung der Saccharosemoleküle weg von dieser Stelle. Die Wassermoleküle wandern jedoch in Summe nicht mit, es gibt also keinen Massenstrom von Wasser plus Saccharose. Der Transport erfolgt also aufgrund vieler kleiner seitlicher osmotischer Gradienten, nicht wie bei der Druckstromtheorie aufgrund eines großen längsgerichteten Druckgradienten.
Evolution
Die den Siebelementen gleichenden Strukturen bei manchen makrophytischen Braunalgen (etwa Microcystis) sind unabhängig vom Phloem der Landpflanzen entstanden.
Für die Land- und Gefäßpflanzen fehlen jedoch aufgrund des weichen Gewebes ausreichende Fossilfunde, um die Evolution der Siebelemente und der Typen der Geleitzellen nachvollziehen zu können.[3] Für die Zeit vor dem Karbon gibt es sehr wenige Angaben über Phloem-Anatomie. Dünnwandige Zellen in Rhynia und Trimerophyton aus dem Devon befinden sich am Ort des Phloems und werden daher als solche interpretiert, auch haben sie leicht schräggestellte Endwände. Im Karbon sind die Siebelemente der Gefäßsporenpflanzen und der Gymnospermen bereits ähnlich den heutigen Formen, es sind keinerlei Übergangsformen zwischen den beiden bekannt. Über das Phloem fossiler Bedecktsamer ist überhaupt wenig bekannt.[11]
Ein Vergleich zwischen den einzelnen Gruppen der Landpflanzen ergibt folgende Trends: Die Porosität der Querwände der Siebelemente wird erhöht, indem die symplastischen Fenster vergrößert werden. Die Siebelemente werden länger und entwickeln dickere Zellwände, möglicherweise, um dem höheren Turgordruck widerstehen zu können. Die Organellen im Cytoplasma der Siebelemente werden stark reduziert, um den Widerstand gegen den Massenfluss zu verringern.[3]
Ein Vergleich mit der Ontogenie des Phloems lässt einige Rückschlüsse auf die Phylogenie zu: Im Protophloem der wenigen untersuchten Bedecktsamer-Arten fehlen die Geleitzellen, es gibt nur Siebelemente. Dies entspricht dem Zustand bei den Farnen und Moosen.[3]
Die Evolution der Geleitzellen-Typen bei den Bedecktsamern ist unklar. Generell angenommen wird, dass die apoplastische Phloembeladung ein abgeleitetes Merkmal ist. Symplastische Beladung kommt besonders bei basalen Gruppen der Bedecktsamer vor, besonders bei tropischen Bäumen. Apoplastische Beladung kommt gehäuft in krautigen Vertretern vor. Bei den einzelnen Typen ist außer einer generellen Tendenz zur Abnahme der Plasmodesmenzahl keine Struktur erkennbar, die einzelnen Typen mit wenigen Plasmodesmen dürften mehrfach unabhängig entstanden sein.[12]
Nutzung
Die Fasern im Phloem einiger Arten werden kommerziell zur Fasergewinnung genutzt, am bedeutendsten sind dabei Lein (Linum usitatissimum) und Hanf (Cannabis sativa).
Von einigen Pflanzenarten wird der Phloemsaft durch den Menschen genutzt. Einige Einkeimblättrige produzieren nach Verletzung große Mengen von Phloemsaft. Dieser wird zu Produktion von Zucker und von alkoholischen Getränken verwendet. Es sind dies überwiegend Palmen: in Asien die Gattungen Arenga, Borassus, Caryota, Cocos, Corypha, Nypa und Phoenix, in Afrika Elaeis und Raphia, in Südamerika Copernicia, Jubaea und Mauritia. Heute hat diese Zuckergewinnung keine große wirtschaftliche Bedeutung, zu Beginn des 20. Jahrhunderts wurden jedoch allein in Indien jährlich 500.000 Tonnen Zucker aus Palmen gewonnen. Die aus einer Pflanze gewonnenen Mengen können sehr groß sein: Corypha elata liefert bis zu 45 Liter pro Tag bzw. 2700 Liter in etwas über vier Monaten. Phoenix liefert bis zu 19 Liter pro Tag.[25]
Außer Palmen wird noch die Gattung Agave genutzt. In Mexiko werden bereits seit vorkolumbischer Zeit Agaven angezapft und der Phloemsaft, aquamiel genannt, zu Pulque vergoren. Dazu wird vorwiegend Agave salmiana verwendet. Zu Beginn der spanischen Kolonisation wurde Pulque destilliert, heute werden Mezcal und Tequila direkt aus den Stämmen gewonnen und nicht aus abgezapftem Phloemsaft. Während einer Saison, die drei Monate pro Jahr dauert, können aus einer Pflanze bis zu 200 Liter aquamiel gewonnen werden.[25] Auch der Latex, der aus dem Kautschukbaum (Hevea brasiliensis) gewonnen wird, befindet sich in Milchröhren im lebenden Phloem des Baumes.
Forschungsgeschichte

Der Begriff Phloem in seiner heutigen Bedeutung geht auf Carl Wilhelm von Nägeli zurück, der ihn zusammen mit dem Gegenstück Xylem 1858 in seiner Arbeit Das Wachsthum des Stammes und der Wurzel bei den Gefäßpflanzen und die Anordnung der Gefäßstränge im Stengel definierte. Seine Bezeichnung Phloem leitet sich vom Griechischen phloios ab, das von Theophrast im Sinne von Rinde, Bast, Borke verwendet wurde. Die Bezeichnung Siebteil wurde erstmals von Anton de Bary 1877 verwendet.[1]
Im frühen 19. Jahrhundert erkannten Heinrich Cotta, Augustin-Pyrame de Candolle und Thomas Andrew Knight, dass Kohlenhydrate von den Blättern in die Stämme und Wurzeln transportiert werden. 1837 entdeckte Theodor Hartig die Siebröhren. Die Zweiteilung des Transportes in Xylem und Phloem sowie die darin transportierten Substanzen waren Mitte des 19. Jahrhunderts erkannt. Die Frage des Transportmechanismus blieb lange offen und wurde durch die dogmatische Ansicht Julius Sachs’, der Transport erfolge ausschließlich durch Diffusion, lange behindert. Dixon und seine Schüler konnten Anfang des 20. Jahrhunderts eindeutig zeigen, dass die Transportraten weit jenseits des durch Diffusion möglichen liegen. Der entscheidende Impuls für die Aufklärung des Transportmechanismus waren die Arbeiten von Ernst Münch, der die Druckstromtheorie aufstellte (Die Stoffbewegungen in der Pflanze, Gustav Fischer, Jena 1930).[26]
Mit Aufkommen der Elektronenmikroskopie wuchs der Widerstand gegen die Druckstromtheorie: in den Aufnahmen zeigte sich, dass die Siebporen meist durch massive Ablagerungen von Callose verdeckt waren. Als Alternativen wurden etwa die Elektro-osmotische Theorie aufgestellt oder die beobachteten Proteinstränge als Ursache des Transports angesehen. Die physiologischen Befunde sprachen jedoch immer stärker für die Druckstromtheorie. Die Verstopfung der Siebporen stellte sich Mitte der 1970er Jahre als Artefakt heraus. Bei sorgfältiger Präparation waren die Siebplatten frei. Sichtbarer Beleg für den Massenfluss waren in den 1990er Jahren auch Aufnahmen von intaktem Phloem mittels Konfokalem Laser-Rastermikroskop, die den Transport von Fluoreszenzfarbstoffen in den Siebröhren von Vicia faba zeigten.[2] Eine weitere wichtige Methode für die Phloemforschung ist die Gewinnung des Phloemsafts mit Hilfe von Stechrüsseln von Blattläusen, wobei der Stechrüssel nach dem Einstechen von der Blattlaus abgetrennt wird.[27] Fragen der Phloembeladung und -entladung wurden wesentlich mit Hilfe der Identifizierung der involvierten Transportmoleküle und deren Klonierung, wie auch der Manipulierung des normalen Ladevorgangs durch Einbau fremder Enzyme bzw. Ausschaltung einzelner Enzyme geklärt.
Belege
Einzelnachweise
Die Informationen dieses Artikels entstammen zum größten Teil den unter Literatur angegebenen Quellen, darüber hinaus werden folgende Quellen zitiert:
- ↑ a b Gerhard Wagenitz: Wörterbuch der Botanik. Die Termini in ihrem historischen Zusammenhang. 2., erweiterte Auflage. Spektrum Akademischer Verlag, Heidelberg/Berlin 2003, ISBN 3-8274-1398-2, S. 241 f.
- ↑ a b c d e A.J.E. van Bel, M. Knoblauch: Sieve element and companion cell: the story of the comatose patient and the hyperactive nurse. Australian Journal of Plant Physiology, Band 27, 2000, S. 477–487. doi:10.1071/PP99172
- ↑ a b c d e f g h i j k l m van Bel: The phloem, a miracle of ingenuity, 2003.
- ↑ K. Ehlers, M. Knoblauch, A. J. E. van Bel: Ultrastructural features of well-preserved and injured sieve elements: Minute clamps keep the phloem transport conduits free for mass flow. Protoplasma, Band 214, 2000, S. 80–92. doi:10.1007/BF02524265
- ↑ a b c Karl J. Oparka, Robert Turgeon: Sieve Element and Companion Cells – Traffic Control Centers of the Phloem. The Plant Cell, Band 11, April 1999, S. 739–750. ISSN 1040-4651 (Volltext HTML)
- ↑ a b c Schopfer, Brennicke: Pflanzenphysiologie, S. 337f.
- ↑ Zahlenwerte nach M.V. Rarthasarathy: Sieve-Element Structure. In: M. H. Zimmermann, J. A. Milburn (Hrsg.): Transport in Plants I. Phloem Transport. (= Encyclopedia of Plant Physiology New Series, Volume 1). Springer Berlin 1975, S. 3–38. ISBN 3-540-07314-0
- ↑ Hiroaki Hayashi, Akari Fukuda, Nobuo Suzuki, Shu Fujimaki: Proteins in the sieve element-companion cell complexes: their detection, localization and possible functions. Australian Journal of Plant Physiology, Band 27, 2000, S. 489–496. doi:10.1071/PP99184
- ↑ Christina Walz, Patrick Giavalisco, Martina Schad, Melanie Juenger, Joachim Klose, Julia Kehr: Proteomics of curcurbit phloem exudate reveals a network of defence proteins. Phytochemistry, Band 65, 2004, S. 1795–1804. doi:10.1016/j.phytochem.2004.04.006
- ↑ Dietrich Frohne, Uwe Jensen: Systematik des Pflanzenreichs unter besonderer Berücksichtigung chemischer Merkmale und pflanzlicher Drogen. 4. neubearbeitete Auflage. Gustav Fischer, Stuttgart / Jena / New York 1992, ISBN 3-437-20486-6, S. 101.
- ↑ a b c d Edith L. Taylor: Phloem Evolution: An Appraisal Based on the Fossil Record. In: H.-D. Behnke, R. D. Sjolund: Sieve Elements. Comparative Structure, Induction and Development. Springer, Berlin, Heidelberg 1990, S. 285–298. ISBN 3-540-50783-3
- ↑ a b c d e Robert Turgeon, Richard Medville, Kevin C. Nixon: The Evolution of minor vein phloem and phloem loading. American Journal of Botany, Band 88, 2001, S. 1331–1339. ISSN 0002-9122 (Abstract und Volltext)
- ↑ a b c d Hubert Ziegler: Nature of Transported Substances. In: M. H. Zimmermann, J. A. Milburn (Hrsg.): Transport in Plants I. Phloem Transport. (= Encyclopedia of Plant Physiology New Series, Volume 1). Springer Berlin 1975, S. 59–100. ISBN 3-540-07314-0
- ↑ Hans-Walter Heldt, Fiona Heldt: Pflanzenbiochemie. Spektrum Akademischer Verlag, Heidelberg 1996, ISBN 3-8274-0103-8, S. 263.
- ↑ Robert Turgeon: Plasmodesmata and solute exchange in the phloem. Australian Journal of Plant Physiology, Band 27, 2000, S. 521–529. doi:10.1071/PP99163
- ↑ Horst Marschner: Mineral Nutrition of Higher Plants. Zweite Auflage, Academic Press, London 1995, S. 92–115. ISBN 0-12-473543-6
- ↑ Van Bel: The phloem: a miracle of ingenuity, 2003; Frank Lichtner: Phloem mobility of crop protection products. Australian Journal of Plant Physiology, Band 27, 2000, S. 609–617. doi:10.1071/PP99185
- ↑ a b Robert Turgeon, Richard Medville: Phloem Loading. A Reevaluation of the Relationship between Plasmodesmatal Frequencies and Loading Strategies. Plant Physiology, Band 136, 2004, S. 3795–3803. doi:10.1104/pp.104.042036
- ↑ Robert Turgeon, Richard Medville: The absence of phloem loading in willow leaves. Proceedings of the National Acadademy of Sciences USA, Band 95, S. 12055–12060, September 1998. ISSN 0027-8424 (Abstract und Volltext)
- ↑ Schopfer, Brennicke: Pflanzenphysiologie, S. 342f.
- ↑ vgl. P. Sitte, E. W. Weiler, J. W. Kadereit, A. Bresinsky, C. Körner: Strasburger – Lehrbuch der Botanik für Hochschulen. 35. Auflage, Spektrum Akademischer Verlag, Heidelberg 2002, S. 312f. ISBN 3-8274-1010-X; van Bel: The phloem, a miracle of ingenuity, 2003; Hans Werner Heldt: Pflanzenbiochemie. Spektrum Akademischer Verlag, Heidelberg 1996, S. 339. ISBN 3-8274-0103-8
- ↑ Schopfer, Brennicke: Pflanzenphysiologie, S. 343f.
- ↑ a b c S. Lalonde, M. Tegeder, M. Throne-Holst, W.B. Frommer, J.W. Patrick: Phloem loading and unloading of sugars and amino acids. Plant, Cell and Environment, Band 26, 2003, S. 37–56. doi:10.1046/j.1365-3040.2003.00847.x
- ↑ für ausführlichere Betrachtung vgl. auch: M.T. Tyree, J. Dainty: Theoretical Considerations. In: M. H. Zimmermann, J. A. Milburn (Hrsg.): Transport in Plants I. Phloem Transport. (Encyclopedia of Plant Physiology New Series, Volume 1) Springer Berlin 1975, S. 367–392. ISBN 3-540-07314-0
- ↑ a b J. Van Die, P.M.L. Tammes: Phloem Exudation from Monocotyledonous Axes. In: M. H. Zimmermann, J. A. Milburn (Hrsg.): Transport in Plants I. Phloem Transport. (= Encyclopedia of Plant Physiology New Series, Volume 1). Springer Berlin 1975, S. 196–222. ISBN 3-540-07314-0
- ↑ M. H. Zimmermann, J. A. Milburn: Introduction. In: dieselben (Hrsg.): Transport in Plants I. Phloem Transport. (= Encyclopedia of Plant Physiology New Series, Volume 1). Springer Berlin 1975, S. VII–IX. ISBN 3-540-07314-0
- ↑ Überblick bei: A. J. Peel: Investigations with Aphid Stylets into the Physiology of the Sieve Tube. In: M. H. Zimmermann, J. A. Milburn (Hrsg.): Transport in Plants I. Phloem Transport. (= Encyclopedia of Plant Physiology New Series, Volume 1). Springer Berlin 1975, S. 171–195. ISBN 3-540-07314-0
Literatur
- Aart J. E. van Bel: The phloem, a miracle of ingenuity. In: Plant, Cell and Environment. Band 26, 2003, S. 125–149, doi:10.1046/j.1365-3040.2003.00963.x.
- Katherine Esau: Anatomy of Seed Plants. John Wiley, 1960, S. 122–141. (Zelltypen)
- Peter Schopfer, Axel Brennicke: Pflanzenphysiologie. Begründet von Hans Mohr. 6. Auflage. Elsevier, Spektrum, München / Heidelberg 2006, ISBN 3-8274-1561-6, S. 333–346 (eingeschränkte Vorschau in der Google-Buchsuche).
Weblinks
Auf dieser Seite verwendete Medien
Strukturformel von Raffinose; Melitose; Melitriose; Gossypose
Autor/Urheber: Thomas Steiner, Lizenz: CC BY-SA 3.0
Querschnitt durch einen 5 jährigen Kiefernstamm.
Struktur von Saccharose (Sucrose)
Querschnitt durch den Phloemteil im Stamm von Cucurbita pepo. si = Querwände der jungen Siebröhren, pp = Phloemparenchym, cc = Cambium.
Querschnitt durch Bast von Tilia cordata. v = Siebröhre, v* = Siebplatte in einer Röhre, c = Geleitzelle, p = Bastparenchym, k = kristallführende Zelle, l = Bastfasern, r = Markstrahl.
Längsschnitt durch das Phloem von Cucurbita pepo. drei Siebröhren. q = Querwände, der Schleim sl und ps ist ein Artefakt, das durch die Verletzung entsteht. si = junge Siebplatte, x und l = Orte, an denen Siebplatten entstehen. z = parenchymatische Zellen zwischen Siebröhren.







