Sepiapterin
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Sepiapterin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C9H11N5O3 | ||||||||||||
| Kurzbeschreibung | |||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 237,09 g·mol−1 | ||||||||||||
| Aggregatzustand | fest | ||||||||||||
| Löslichkeit | löslich in Wasser, unlöslich in Aceton und den meisten organischen Lösungsmitteln[3] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Sepiapterin ist ein chiraler heterocyclischer Naturstoff aus der Klasse der Pterine bzw. Pteridine.
Entdeckung
In den Augen der Fruchtfliege Drosophila kommen gelbe und rote Pigmente vor, die zum Teil fluoreszieren.[5] Ein gelbes Pigment wurde in Drosophila melanogaster (Wildtyp), in erhöhter Konzentration in der Mutante Sepia entdeckt und in den 1950er Jahren von Forrest und Mitchell am California Institute of Technology (Pasadena) in Form gelber Kristalle isoliert.[3] Viscontini und Möhlmann fanden neben Sepiapterin ein Isomer, welches Isosepiapterin genannt wurde.[6] Die Strukturformel des Sepiapterins konnte erst 1978/1979 durch Max Viscontini und Mitarbeiter (Zürich) sowie Wolfgang Pfleiderer (Konstanz) ermittelt werden.[2][1] Es handelt sich um ein 7,8-Dihydropterin, das mit dem Biopterin verwandt ist, aber in Position 6 eine C3-Kette mit einer Carbonylgruppe trägt. Die Seitenkette hat die Struktur der Milchsäure (Lactoyl-Rest) und besitzt die (S)-Konfiguration.
Weitere Vorkommen
Die Verbindung wurde auch in der Epidermis des Seidenspinners (Bombyx mori, Mutante lem) sowie in der Haut von Amphibien und Fischen gefunden.[7] Das spurenweise Vorkommen im Harn von Säugetieren und Menschen deutet darauf hin, dass Sepiapterin ein Zwischenprodukt (Intermediat) im Stoffwechsel vieler Organismen ist.
Biochemie
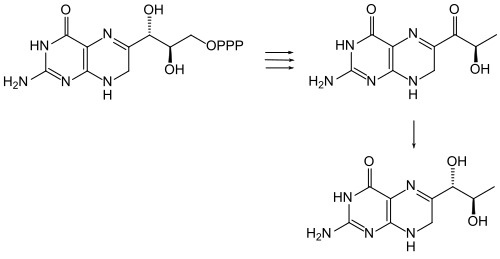
Eine enzymatische Synthese von Sepiapterin aus D-erythro-Dihydroneopterin-triphosphat durch Extrakte aus den Nieren von Hühnerküken wurde beschrieben.[8]
Das Enzym Sepiapterin-Reduktase katalysiert die Hydrierung der Carbonylgruppe an C-1‘ durch NADPH, wodurch Dihydrobiopterin gebildet wird.[9] Zum Schluss wird dieses zu Tetrahydrobiopterin (BH4) reduziert.
Enzymatische Bildung von Sepiapterin aus D-erythro-Dihydroneopterin-triphosphat und Hydrierung zu Dihydrobiopterin.
Einzelnachweise
- ↑ a b W. Pfleiderer, Chem. Ber., 112, S. 2750–2755 (1979).
- ↑ a b B. Schircks, H. J. Bieri, M. Viscontini, Helv. Chim. Acta, 61, S. 2731–2738 (1978).
- ↑ a b H. S. Forrest, H. K. Mitchell, J. Am. Chem. Soc., 76, S. 5656 (1954).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ E. Hadorn, K. H. Mitchell, Proc. Natl. Acad. Sci. USA, 37, S. 650 (1951).
- ↑ M. Viscontini, E. Möhlmann, Helv. Chim. Acta, 42, S. 836–841 (1959).
- ↑ Wolfgang Pfleiderer: Neuere Entwicklungen in der Pteridin-Chemie, Angew. Chem., 75, S. 993–1014 (1963), doi:10.1002/ange.19630752102.
- ↑ K. Tanaka, M. Akino, Y. Hagi, M. Doi, and T. Shiota, The enzymatic synthesis of sepiapterin by chicken kidney preparations. J. Biol. Chem., 256, S. 2963–2972 (1981).
- ↑ Masako Matsubara, Setsuko Katoh, Miki Akino, Seymour Kaufman: Sepiapterin reductase. In: Biochimica et Biophysica Acta - Enzymology and Biological Oxidation, 122(2), S. 202–212 (1966); ISSN 0926-6593, doi:10.1016/0926-6593(66)90062-2.
Auf dieser Seite verwendete Medien
Autor/Urheber: Durfo, Lizenz: CC BY-SA 3.0
Bildung und Umwandlung von Sepiapterin