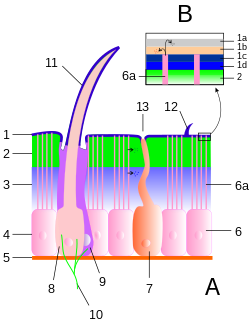
Sensillum

1 Epicuticula
2 Exocuticula, 3 Endocuticula
2 + 3 Procuticula
4 Epithelschicht, 5 Basalmembran
6 Epithelzelle, 6a Porenkanäle
7 Drüsenzelle
8 Cuticulagrube (Bothrion)
9 Wärmerezeptive Zellen
10 Nervenendigungen
11 Trichobothrium
12 Sensillum
13 Drüsenöffnungen
Ein Sensillum (von lateinisch sensus ‚Empfindung, Gefühl, Sinn‘; Plural: Sensilla), auch Sensille (Plural: Sensillen), ist in der Physiologie ein außenliegendes haarähnliches Sinnesorgan zur Wahrnehmung von Umweltreizen. Bei Gliederfüßern werden Sensilla als Teil des Exoskeletts aus einem Borstenhaar oder Poren und zwei Sinneszellen (Rezeptor) durch die Cuticula ausgebildet. Bei einigen Reptilien befinden sich Sensilla als haarähnliche Beschuppung, überwiegend am Schwanz. Die Weiterleitung der chemischen, thermischen, optischen oder mechanischen Reize erfolgt über multiterminale ganglionale Rezeptorzellen.
Gliederfüßer
Aufbau und Funktion
Da Gliederfüßer ein starres Exoskelett (Außenskelett) besitzen, müssen äußere mechanische Reize anders als beispielsweise bei Wirbeltieren an eine erregbare Membran geführt werden. Dazu bilden Epithelzellen einen dünnen Chitinfaden, in dessen Basis mindestens ein Dendrit einwächst. Dieser Chitinfaden überträgt den mechanischen Reiz mit einem Sternit der Cuticula am Gelenk auf die erregbare Membran. Der adäquate Reiz ist ein transversaler Druck auf die Dendritenmembran.
Je nach Reizart kann die Form des Reizüberträgers in vielfältiger Weise abgewandelt werden: zu Stiften, Platten, Kappen etc. (siehe Abbildung).
Arten von Sensilla
Mechanosensilla
Haarsensilla
Typische Mechanorezeptoren werden durch die Haarsensilla repräsentiert.[1][2] Sie bedecken den ganzen Körper, vornehmlich aber die Beine. Es sind zumeist einfache Tasthaare und spezialisierte Trichobothrien, die auf Luftbewegungen und auch auf Schalldruckwellen reagieren.
Ein Haarsensillum ähnelt in der Funktion einer Haarzelle:
- Das Außenglied des Dendriten gleicht einem starren Zilium und ist dicht mit Mikrotubuli versehen. Wo es zur Kraftübertragung in Chitinstrukturen des Gelenks eingezwängt ist, bildet es einen sogenannten Tubularkörper (besteht aus besonders vielen Mikrotubuli). Die Außengliedmembran wird mit dem darunter liegenden Mikrotubuli-Mantel durch Molekülzapfen (Konen) und nach außen mit der Dendritenscheide durch Brücken mechanisch verbunden. Die Chitinstrukturen des Gelenks, die die Hebelkraft auf die Dendritenmembran übertragen, liegen unmittelbar auf der Dendritenscheide. In der Dendritenmembran liegen mechanosensitive Ionenkanäle, die in ihrer Funktion bislang aber noch nicht erforscht sind.
- Es reagiert richtungsspezifisch, da transversaler Druck zu einer Depolarisation und transversaler Zug zu einer Hyperpolarisation führt.
- Für das reizspezifische Außenglied entsteht durch ionendichte Verbindungen mit benachbarten Epithelzellen ein abgetrennter Rezeptorlymphraum, dessen Ionen anders zusammengesetzt sind als in der Hämolymphe, die den proximalen (körpernahen) Teil der Sinneszelle umspült. So entsteht über dem Sensillum ein Gleichspannungpotential, das durch den Rezeptorstrom moduliert wird.
- Sensilla reagieren schon auf kleinste Krafteinwirkungen. An den Beinen von Insekten antworten sie schon auf Vibrationsamplituden von wenigen Nanometern. Die elektrische Arbeit an der Erregungsschwelle beträgt etwa 10 bis 16 Ws. Ähnlich für die Auslenkung der Haarsensilla reizen Partikelbewegungen durch Luft oder Wasser, die durch Reibung (visköse Kopplung) die Haare bewegen.
- Haarsensilla haben eine bestimmte Masse und Steife, somit eine bestimmte mechanische Resonanzfrequenz, die von der Art des Hebelgelenks und den eigenen dynamischen Eigenschaften beeinflusst wird. Typisch liegt diese Frequenz im Bereich von 100 bis 200 Hz und ergibt sich aus:
- der von der Auslenkung abhängigen Steife (10 bis 12 N/rad),
- der von der Geschwindigkeit der Haarbewegung abhängigen Reibung,
- der von der Beschleunigung abhängigen Massenwirkung (9 bis 10 mg pro Sensillum).
Es gibt zwei Typen:
- Fadenhaare: Aktivierung durch Druck oder Zug, daher richtungssensitiv
- Borsten: reiner Berührungsrezeptor
Borstenfelder haben die Funktion, die Gelenkstellungen zu übermitteln. An vielen Gelenken stehen ganze Felder solcher Borsten, die je nach Gelenkstellung mehr oder weniger abgebogen werden.
Kuppel- oder Campanisensilla
Sensilla in Kuppel- oder Campaniformen messen über Mechanosensoren die Verformung der Cuticula und registrieren so selbst geringe mechanische Reize.[3] Sie sind durch Querkompression (Belastung oder Muskelkraft) aktivierbar.
Scolopidialsensilla
Scolopidialsensilla enden unter dem Epithel und reagieren im Körperinneren auf Druck oder Zug.[3][4]
Spaltsensilla
Spalt- oder Lyriforme Sensilla haben dieselben Aufgaben wie Kuppelsensilla, jedoch sind sie auf den Vibrationssinn besonders bei Spinnentieren spezialisiert.[5][6] Sie werden durch zahlreiche parallele Spalten in der Exocuticula (äußerst liegende Cuticulaschicht) gebildet. Im Zentrum eines jeden Spaltes befindet sich ein sogenannter Kopplungszylinder, eine zylinderförmige Vertiefung, an der der Dendrit (Cytoplasmafortsatz einer Nervenzelle) der zugehörigen Sinneszelle angreift. Spaltsensilla dienen zur Wahrnehmung von Boden- und bei Spinnen von Netzvibrationen, reagieren aber auch auf Luftschall im Frequenzbereich zwischen 100 und 2500 Hz (optimal zwischen 300 und 700 Hz).
Chemosensillum
Ein Geruchssensillum ist ein Sensillum zur Wahrnehmung chemischer Reize geringer Konzentration auf den Antennen von Insekten.[7] Es handelt sich dabei um cuticuläre Sinnesorgane. Die Riechstoffe gelangen über Poren (150 bis 50.000 pro Sensillum) zu den 1 bis 45 Sinneszellen. Ein Geschmackssensillum ist ein Sensillum zur Wahrnehmung chemischer Reize höherer Konzentration. Sie befinden sich
- auf dem Labellum (Spitze der Unterlippe),
- auf dem Tarsus (Fuß),[8]
- auf den Labial- und Maxillarpalpen (Mundwerkzeuge an Lippen und Oberkiefer)
- auf der Rüsselspitze,
- auf den Antennen sowie
- im Bereich der Hypo- und Epipharynx (Anhänge der Kopfkapsel, unechte Mundwerkzeuge).
Chemosensilla auf ihren Antennen ermöglichen Ameisen (Camponotus japonicus) die Unterscheidung von Individuen des eigenen Baues von fremden.[9]
Hygro- und Thermosensillum
Einige Sansilla sind feuchte- und temperaturempfindlich.[10][11]
Tubularsensillum
Die Funktion der Tubularsensilla ist ungeklärt.[12]
Reptilien
Bei vielen Geckos, einigen Agamen und Leguanen finden sich haarähnliche Rezeptoren der Beschuppung, besonders am Schwanz.[13] Es handelt sich dabei um Mechano- oder Thermorezeptoren, einige werden auch mit Geräuschentwicklungen in Verbindung gebracht.[14][15] Ihnen wird häufig die Funktion zugesprochen, die Stelle zum Abwurf des Schwanzes im Gefahrfall zu determinieren und die zuckenden Bewegungen des Schwanzteiles zu initiieren.[16][17] Sie haben sich entwickelt aus feinen Ausläufern der Schuppen, die durch einen Lotuseffekt die Benetzungsfähigkeit mit Wasser vermindern.
Einzelnachweise
- ↑ H. I. Runion, P. N. R. Usherwood: Tarsal receptors and leg reflexes in the locust and grasshopper. In: Journal of Experimental Biology 49, Nr. 2, 1968, S. 421–436.
- ↑ Rainer F. Foelix, I-Wu Chu-Wang: The morphology of spider sensilla I. Mechanoreceptors. In: Tissue and Cell 5, Nr. 3, 1973, S. 451–460, doi:10.1016/S0040-8166(73)80037-0.
- ↑ a b A. K. Bromley, J. A. Dunn, M. Anderson: Ultrastructure of the antennal sensilla of aphids. In: Cell and Tissue Research. 205, 1980, S. , doi:10.1007/BF00232289.
- ↑ Eric Hallberg, Bill S. Hansson: Arthropod sensilla: Morphology and phylogenetic considerations. In: Microscopy Research and Technique. 47, 1999, S. 428–439, doi:10.1002/(SICI)1097-0029(19991215)47:6<428::AID-JEMT6>3.0.CO;2-P.
- ↑ Andrew S. French, Päivi H. Torkkeli: Mechanotransduction in spider slit sensilla. In: Canadian Journal of Physiology and Pharmacology 82, Nr. 8–9, 2004, S. 541–548, doi:10.1139/y04-031.
- ↑ Friedrich G. Barth: Ein einzelnes Spaltsinnesorgan auf dem Spinnentarsus: seine Erregung in Abhängigkeit von den Parametern des Luftschallreizes. In: Zeitschrift für Vergleichende Physiologie. 55, 1967, S. 407–449, doi:10.1007/BF00302624.
- ↑ Ulla Klein: Sensillum-lymph proteins from antennal olfactory hairs of the moth Antheraea polyphemus(Saturniidae). In: Insect Biochemistry 17, Nr. 8, 1987, S. 1193–1204, doi:10.1016/0020-1790(87)90093-X.
- ↑ Tamara Elmore, Rickard Ignell, John R. Carlson, Dean P. Smith: Targeted mutation of a Drosophila odor receptor defines receptor requirement in a novel class of sensillum. In: The Journal of Neuroscience 23, Nr. 30, 2003, S. 9906–9912.
- ↑ Mamiko Ozaki et al.: Ant nestmate and non-nestmate discrimination by a chemosensory sensillum. In: Science 309, Nr. 5732, 2005, S. 311–314, doi:10.1126/science.1105244.
- ↑ F. Yokohari: The sensillum capitulum, an antennal hygro-and thermoreceptive sensillum of the cockroach, Periplaneta americana L. In: Cell and Tissue Research 216, Nr. 3, 1981, S. 525–543.
- ↑ Volker Hartenstein, James W. Posakony: A dual function of the Notch gene in Drosophila sensillum development. In: Developmental Biology 142. Nr. 1, 1990, S. 13–30, doi:10.1016/0012-1606(90)90147-B.
- ↑ Volker Storch, Robert P. Higgins, M. Patricia Morse: Ultrastructure of the body wall of Meiopriapulus fijiensis (Priapulida). In: Transactions of the American Microscopical Society 1989, S. 319–331.
- ↑ Uwe Hiller: Morphology and electrophysiological properties of cutaneous sensilla in agamid lizards. In: Pflügers Archiv 377, Nr. 2, 1978, S. 189–191, doi:10.1007/BF00582851.
- ↑ Natalia G. Nikitina, Natalia B. Ananjeva: The skin sense organs of lizards of Teratoscincus Genus (Squamata: Sauria: Gekkonidae). (PDF) In: Herpatologia Petropolitana 2003, S. 291–295.
- ↑ A. P. Russell, A. M. Bauer: Caudal morphology of the knob-tailed geckos, genus Nephrurus (Reptilia, Gekkonidae), with special reference to the tail tip. In: Australian Journal of Zoology 35, Nr. 6, 1987, S. 541–551, doi:10.1071/ZO9870541.
- ↑ Anthony P. Russell, Erica K. Lai, G. Lawrence Powell, Timothy E. Higham: Density and distribution of cutaneous sensilla on tails of leopard geckos (Eublepharis macularius) in relation to caudal autotomy. In: J. Morphol. 2014, doi:10.1002/jmor.20269
- ↑ Aaron M. Bauer, Anthony P. Russell: Morphology of gekkonid cutaneous sensilla, with comments on function and phylogeny in the Carphodactylini (Reptilia: Gekkonidae). In: Canadian Journal of Zoology 66, Nr. 7, 1988, S. 1583–1588, doi:10.1139/z88-231.
Auf dieser Seite verwendete Medien
Sensillae of insects
Autor/Urheber: Xvazquez, Lizenz: CC BY-SA 4.0
Arthropod cuticle structure. Legend:
- A: Cuticle and epidermis
- B: Epicuticle detail
- 1: Epicuticle
- 1a: Cement layer
- 1b: Wax layer
- 1c: Outer epicuticle
- 1d: Inner epicuticle
- 2: Exocuticle
- 3: Endocuticle
- 2+3: Procuticle
- 4: Epidermis
- 5: Basement membrane
- 6: Epidermal cell
- 6a: Pore canal
- 7: Glandular cell
- 8: Trichogen cell
- 9: Tormogen cell
- 10: Nerve
- 11: Sensilia
- 12: Hair
- 13: Gland opening