Selenole

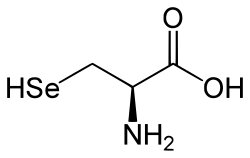
Selenole sind kohlenstoffhaltige (organische) Selenverbindungen, genauer die Selenanaloga von Thiolen (R-S-H) und Alkoholen (R-O-H). Sie haben die allgemeine Formel R-Se-H. Man kann die Selenole auch als Monosubstitutionsprodukte des Selenwasserstoffs (H2Se) betrachten. Selenocystein ist eine Aminosäure, die der Stoffklasse der Selenole zugehört.
Synthese
Alkylselenole werden meist hergestellt durch die Umsetzung von Alkalihydrogenseleniden mit Alkylhalogeniden, durch Reduktion von Diseleniden oder von Alkylselenocyanaten.[1] Die flüchtigen Alkylselenole besitzen einen schauderhaften Geruch und sind giftig. Selenophenol lässt sich aus metallorganischen Verbindungen und elementarem Selen herstellen, z. B. aus Grignard-Verbindungen nach der folgenden Reaktionssequenz:

Dabei entsteht im ersten Reaktionsschritt durch eine Insertionsreaktion eine Verbindung des Typs PhSeMgBr.[1] Selenophenol wurde erstmals durch die Reaktion von Benzol mit Selentetrachlorid (SeCl4) in Gegenwart von Aluminiumtrichlorid (AlCl3) hergestellt.[2]
Reaktivität
Selenole bilden, wie die Thiole (Mercaptane), Metallselenolate (Selenomercaptide). Die Schwermetallselenolate sind meist viel beständiger als die Selenole und werden daher oft zu weiteren Umsetzungen benutzt. Natrium- und Kaliumselenolate bilden sich beim Erhitzen der Selenole mit dem Alkalimetall in Benzol, Toluol oder Xylol. Selenole werden durch Luftsauerstoff zu Diseleniden oxidiert:

Setzt man ein Selenol mit einem Natriumalkoholat und anschließend mit einem Halogenalkan um, entsteht in einer der Williamsonschen Ethersynthese analogen chemischen Reaktion ein Dialkylselenid, R-Se-R'.
Einzelnachweise
- ↑ a b Heinrich Rheinboldt in Houben-Weyl Methoden der Organischen Chemie, herausgegeben von Eugen Müller, Otto Bayer, Hans Meerwein und Karl Ziegler, Band 9, Schwefel-, Selen und Tellur-Verbindungen, Thieme Verlag, Stuttgart, 1955, dort 952–969.
- ↑ Chabrié, M. Camille: Premiers essays de synthèse de composés organiques séléniés dans la série aromatique, Bull. Soc. Chim. Fr., 50, 133 (1888); Ann. chim. phys., (6) 20, 229 (1890).
Auf dieser Seite verwendete Medien
Autor/Urheber: Jü, Lizenz: CC BY-SA 4.0
Oxidation eines Selenols zum Diselenid
L-Selenocystein