Selegilin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
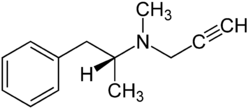
| Freiname | Selegilin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C13H17N | |||||||||||||||||||||
| Kurzbeschreibung | Weißes bis fast weißes, kristallines Pulver (Hydrochlorid)[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | N04BD01 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 187,28 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||
| Schmelzpunkt | 141–142 °C (Hydrochlorid)[1] | |||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Löslichkeit | Leicht löslich in Wasser, Chloroform und Methanol, schwer löslich in Aceton (Hydrochlorid)[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Selegilin ist ein Arzneistoff, der in Deutschland vorrangig zur symptomatischen Behandlung der Parkinson-Krankheit eingesetzt wird, im Ausland aber auch als Antidepressivum Verwendung findet. Seine Wirkung vermittelt diese Substanz über eine irreversible Hemmung des Enzyms Monoaminooxidase B (MAO-B-Hemmer) und damit einer Hemmung des Dopamin-Abbaus im Gehirn. Selegilin wird in Deutschland unter den Markennamen Movergan, Antiparkin und Xilopar sowie unter generischer Bezeichnung vertrieben. Selegilin unterliegt der ärztlichen Verschreibungspflicht.
Selegilin wurde von József Knoll entdeckt.
Stereoisomerie
N-Methyl-N-(1-methyl-2-phenylethyl)prop-2-in-1-amin hat ein Stereozentrum und ist folglich eine chirale Verbindung, von der es zwei Isomere gibt. Als Selegilin bezeichnet man die (R)-Form (auch L-Selegilin oder (−)-Selegilin). Pharmazeutisch eingesetzt wird auch das Hydrochlorid.[4]
Das Racemat, ein 1:1-Gemisch aus (R)- und (S)-Form, wird auch als Deprenyl[5] bezeichnet. Auch hier kommt das Hydrochlorid[6] zur Verwendung.
(+)- bzw. (S)-Selegilin[7] hat dagegen keine Bedeutung.
Pharmakologie
Anwendungsgebiete
In Kombination mit Levodopa wird Selegilin zur symptomatischen Behandlung der Parkinson-Krankheit eingesetzt. In erster Linie findet Selegilin dabei Einsatz bei Patienten mit einem fluktuierenden Krankheitsbild (Dyskinesien, End-of-Dose-Fluktuationen, On-off-Phänomene). Darüber hinaus ist Selegilin als Monotherapeutikum zur Behandlung früher Stadien der Parkinson-Krankheit zugelassen.
In den USA wird Selegilin unter dem Handelsnamen Emsam zur Behandlung von Depressionen eingesetzt. Es wird dabei transdermal durch ein Pflaster verwendet. In Deutschland besteht jedoch keine Zulassung für dieses Anwendungsgebiet. Auch sind Emsam Patches vergleichsweise hochpreisig.
Eine diskutierte mögliche Wirksamkeit von Selegilin zur Verbesserung der Symptome der Alzheimer-Krankheit wurde nach einer Metaanalyse von Patientendaten negativ beurteilt.[8]
Auch ist der experimentelle Gebrauch von Selegilin in der Nootropicszene relativ verbreitet, wobei es hier meistens in geringdosierter Tropfenform Anwendung findet, und ähnlich zu Piracetam und seinen Derivaten die Hirnleistung steigern soll. Auch wurden Studien zu einem möglichen Anti-Aging Effekt publiziert, da Selegilin nachgewiesene neuroprotektive Potenziale aufweist.[9][10]
In der Tiermedizin wird Selegilin zur Behandlung von Verhaltensstörungen emotionalen oder geriatrischen Ursprungs bei Hunden verwendet.[11]
Wirkmechanismus
Als MAO-B-Hemmer ist Selegilin ein Hemmstoff des Enzyms Monoaminooxidase B. Die Hemmung dieses Enzyms führt zu einer Hemmung des Abbaus von Dopamin und somit zu einer Erhöhung der pathologisch erniedrigten Dopaminkonzentration im Gehirn.
Nebenwirkungen
Unter der Anwendung von Selegilin sind insbesondere folgende Nebenwirkungen beschrieben worden: Mundtrockenheit, Appetitverlust, Schwindel, Schlafstörungen, Verwirrtheit, Angst, Halluzinationen, Transaminasenanstieg, orthostatische Hypotonie und Herzrhythmusstörungen.
Wechselwirkungen
Der Abbau von Arzneistoffen, der über die Monoaminooxidasen abläuft, kann durch Selegilin verlangsamt werden. Keine unerwünschten Wirkungen sind hingegen durch die kombinierte Einnahme von Selegilin (max. 10 mg/Tag) mit tyraminhaltigen Nahrungsmitteln zu erwarten, da durch die MAO-B-Selektivität noch die Monoaminooxidase A für den Abbau von Tyramin zur Verfügung steht.[12]
Selegilin kann die Wirkungen und Nebenwirkungen von Sympathomimetika, Psychostimulanzien, Nasentropfen, Antihypotonika, Antihypertonika, Sedativa und Ethanol verstärken.
Die gleichzeitige Einnahme von Selegilin und Antidepressiva (insbesondere SSRI) kann zu schwerwiegenden Reaktionen, wie z. B. Flush, Hyperthermie, Krampfanfällen, Herz-Kreislauf-Störungen, psychischen Störungen (Verwirrtheit, Halluzinationen) bis hin zum Koma führen.
Selegilin verstärkt darüber hinaus die MAO-hemmenden Nebenwirkungen von Linezolid.
Herstellung
Eine mehrstufige Synthese für Selegilin, ausgehend von (RS)-Methamphetamin, ist in der Literatur beschrieben.[13]
Handelsnamen
Monopräparate
Amboneural (A), Antiparkin (D), Cognitiv (A), Jumex (A), Jutagilin (D), Movergan (D), Selepark (D), Xilopar (D, A), zahlreiche Generika (D, A)
Tiermedizin
Selgian
Weblinks
Einzelnachweise
- ↑ a b c Europäische Arzneibuch-Kommission (Hrsg.): Europäische Pharmakopöe 5. Band 5.0 - 5.7, 2006.
- ↑ a b c Eintrag zu Selegilin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. Mai 2014.
- ↑ a b Datenblatt R-(−)-Deprenyl hydrochloride bei Sigma-Aldrich, abgerufen am 4. Januar 2012 (PDF).
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu (−)-Selegilin-Hydrochlorid: CAS-Nr.: 14611-52-0, EG-Nr.: 604-508-9, ECHA-InfoCard: 100.109.608, PubChem: 26758, ChemSpider: 24931, Wikidata: Q27108267.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Deprenyl: CAS-Nr.: 2323-36-6, PubChem: 5195, ChemSpider: 5007, Wikidata: Q402633.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Deprenyl-Hydrochlorid: CAS-Nr.: 2079-54-1, EG-Nr.: 643-087-6, ECHA-InfoCard: 100.171.140, PubChem: 92913, ChemSpider: 83874, Wikidata: Q27263610.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu (+)-Selegilin: CAS-Nr.: 4528-51-2, PubChem: 199605, ChemSpider: 172774, Wikidata: Q5203251.
- ↑ J. Birks, L. Flicker: Selegiline for Alzheimer’s disease. In: Cochrane Database Syst. Rev. 2003, S. CD000442, PMID 12535396.
- ↑ Theodore Lidsky, Jay Schneider: Brain Candy: Boost Your Brain Power with Vitamins, Supplements, Drugs, and Other Substance. Simon and Schuster, 2010, ISBN 978-0-7432-1843-6 (google.com [abgerufen am 23. Januar 2023]).
- ↑ Maija Haavisto: Reviving the Broken Marionette: Treatments for CFS/ME and Fibromyalgia. Lulu.com, 2008, ISBN 978-1-4092-0335-3 (google.com [abgerufen am 23. Januar 2023]).
- ↑ Eintrag zu Selegilin bei Vetpharm, abgerufen am 7. November 2019.
- ↑ Tyramin und MAO-Hemmer. Pharmama
- ↑ Axel Kleemann, Jürgen Engel, Bernd Kutscher, Dietmar Reichert: Pharmaceutical Substances. 4. Auflage. Thieme-Verlag, Stuttgart 2000, ISBN 1-58890-031-2.
Auf dieser Seite verwendete Medien
Selegilin-Structural_Formulae
