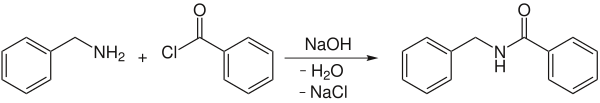Schotten-Baumann-Methode
Die Schotten-Baumann-Methode ist eine Namensreaktion aus dem Bereich der Organischen Chemie, die 1883 erstmals von den deutschen Chemikern Carl Schotten (1853–1910) und Eugen Baumann (1846–1896) publiziert wurde. Sie umfasst die Umsetzung von Aminen, Alkoholen oder Phenolen mit Carbonsäurehalogeniden – meist Carbonsäurechloriden – in Gegenwart mindestens stöchiometrischer Mengen wässriger Alkalihydroxid-Lösungen zu den entsprechenden Amiden bzw. Estern.[1]
Übersicht
Ein Carbonsäurehalogenid, hier Carbonsäurechlorid, wird mit einem Alkohol zu einem Ester umgesetzt:[2]
Die Reaktion verläuft nur durch Zugabe von wässriger Alkalihydroxid-Lösung, hier wässrige Natronlauge.[2]
Alternativ kann ein Carbonsäurehalogenid, hier Carbonsäurechlorid, durch Reaktion mit einem primären oder sekundären Amin zu einem Amid umgesetzt werden.[2]
Die Reaktion verläuft nur durch Zugabe von wässriger Alkalihydroxid-Lösung, hier wässrige Natronlauge.[2]
Reaktionsmechanismus
Der nachfolgende Vorschlag für den Reaktionsmechanismus erfolgt am Beispiel der Umsetzung von einem Carbonsäurechlorid mit einem primären Alkohol. Der Reaktionsverlauf für alle weiteren im Abschnitt Übersicht angesprochenen Varianten verläuft analog: [3]

Der primäre Alkohol wird an das Carbonsäurechlorid 1 addiert. Nach anschließendem Protonentransfer entsteht das Halbacetal 2. Durch eine Deprotonierung der Hydroxidgruppe und der Abspaltung des Chloratoms als Chloridion entsteht der Ester 3.[3]
Anwendungsbeispiele
Ein Anwendungsbeispiel ist die Umsetzung von Benzylamin mit Benzoylchlorid zu N-Benzylbenzoesäureamid:[2]
Nach dem Prinzip der Schotten-Baumann-Reaktion lässt sich ebenfalls der dreiwertige Alkohol Glycerin durch Umsetzung mit Benzoylchlorid in Gegenwart von Natronlauge gezielt zum Diester umsetzen, wobei die beiden primären Hydroxygruppen verestert werden, die sekundäre Hydroxygruppe jedoch nicht reagiert.[2]
Einhorn-Variante
Bei dieser Variante der Schotten-Baumann-Reaktion dient Pyridin als Base und oft zugleich als Lösungsmittel. Es reagiert zunächst mit den Säurechloriden zu hochreaktiven Pyridiniumverbindungen. Diese werden dann von Alkohol oder Aminen unter Bildung von Estern bzw. Amiden nukleophil angegriffen. Der gebildete Chlorwasserstoff wird als Pyridin-Hydrochlorid gebunden.[4] Im Gegensatz zur Schotten-Baumann-Reaktion wird hier die Verseifung des Esters vermieden, wenn man mit trockenem Alkohol arbeitet. Pyridin wirkt dabei als säurebindendes Mittel.[5]
Die Variante ist nach ihrem Entdecker Alfred Einhorn benannt.
Einzelnachweise
- ↑ Eintrag zu Schotten-Baumann-Reaktion. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juni 2014.
- ↑ a b c d e f g h i László Kürti und Barbara Czakó.: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms, Elsevier Academic Press, 2005, S. 398–399, ISBN 978-0-12-429785-2.
- ↑ a b M. B. Smith, J. March: March's Advanced Chemistry, 5. Auflage, John Wiley and Sons, New York, 2001, S. 482–506.
- ↑ H. Hauptmann, Universität Regensburg: Übungen zur Vorlesung Organische Chemie II für Studierende des Lehramtes und der Biologie (PDF; 26 kB).
- ↑ Klaus Schwetlick: Organikum, 23. vollständig überarbeitete und aktualisierte Auflage, Wiley-VCH, Weinheim 2009, ISBN 978-3-527-32292-3.
Auf dieser Seite verwendete Medien
Schotten-Baumann method
Autor/Urheber: Werderkli, Lizenz: CC BY-SA 3.0
Schotten Baumann reaction mechanism
Autor/Urheber: Werderkli, Lizenz: CC BY-SA 3.0
Schotten Baumann reaction overview2
Autor/Urheber: Werderkli, Lizenz: CC BY-SA 3.0
Schotten Baumann reaction overview1