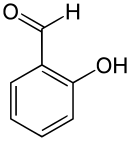
Salicylaldehyd
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Salicylaldehyd | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C7H6O2 | ||||||||||||||||||
| Kurzbeschreibung | farblose bis gelbliche Flüssigkeit mit bittermandelartigem Geruch und brennendem Geschmack[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 122,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | 197 °C[3] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert | 6,79[4] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex | 1,5734[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Salicylaldehyd ist eine natürlich in einigen Pflanzen und Insekten vorkommende chemische Verbindung, die heute vielfach als Duftstoff und in der pharmazeutischen und chemischen Industrie Verwendung findet. Es leitet sich sowohl vom Benzaldehyd als auch vom Phenol ab. Die Struktur besteht aus einem Benzolring mit angefügter Aldehyd- (–CHO) und Hydroxygruppe (–OH) als Substituenten. Salicylaldehyd gehört zur Gruppe der Hydroxybenzaldehyde.
Geschichte
Ungefähr um 1838 gelang es dem Schweizer Apotheker und Pharmazeuten Johann Pagenstecher, aus den Blüten von Mädesüß Salicylaldehyd zu gewinnen.
Vorkommen

Salicylaldehyd kommt in Rooibos, Tee, Echtem Buchweizen, Echtem Mädesüß, Tomaten, Polei-Minzen, Virginischem Tabak und Tagetes minuta vor.[5] Insekten (Blattkäfer) produzieren diese Verbindung in speziellen Drüsen gegen Fraßfeinde aus dem Salicin ihrer Wirtspflanzen.
Gewinnung und Darstellung
Früher wurde Salicylaldehyd durch die Reimer-Tiemann-Reaktion (1876, frühe Carbenchemie) gewonnen.[6] Dabei werden Chloroform, Kaliumhydroxid und Phenol als Ausgangsstoffe benutzt. Heute wird als Verbesserung eine Phasentransferkatalyse verwendet.

Eigenschaften
Salicylaldehyd besitzt gegenüber dem Phenol (9,99[4]) einen deutlich niedrigeren pKs-Wert von 6,79; die elektronenziehende Aldehydgruppe (−M-Effekt) erhöht die Acidität; die phenolische OH-Bindung wird zunehmend polarisiert. Der Flammpunkt liegt bei 78 °C.[3]
Verwendung
Salicylaldehyd dient als Zwischenprodukt in der Farbstoff- und Arzneimittelindustrie sowie in 10%iger alkoholischer Lösung zum Nachweis von Ketonen (z. B. Aceton im Harn) und von Fuselölen im Alkohol. Außerdem wird er zur Herstellung von Schiffschen Basen, z. B. dem Komplexbildner N,N′-Bis(salicyliden)ethylendiamin (Abkürzung: salen), dessen Cobalt(II)-komplex (Salcomin) reversibel Sauerstoff binden kann, benutzt. Weiterhin wird es als Duftstoff in Parfüms eingesetzt.
Oxidation mit Wasserstoffperoxid ergibt Brenzcatechin (Dakin-Reaktion).[7]

Cumarin wird mit der Perkinschen Synthese aus Salicylaldehyd und Essigsäureanhydrid hergestellt.[8]

Literatur
- Edwin A. Robinson: The reaction of dichloromethylene with water and with phenoxide ions (Reimer-Tiemann reaction). In: J. Chem. Soc., 1961, S. 1663–1671; doi:10.1039/JR9610001663.
- Karl Winterfeld: Praktikum der organisch-präparativen Pharmazeutischen Chemie. 6. Auflage. Steinkopff.
Siehe auch
- Salicylalkohol
- Salicylsäure
Einzelnachweise
- ↑ Eintrag zu SALICYLALDEHYDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. Januar 2022.
- ↑ a b c Eintrag zu Salicylaldehyd. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. April 2014.
- ↑ a b c d e f g h i j k l Eintrag zu Salicylaldehyd in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ a b CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ SALICYLALDEHYDE (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 20. August 2023.
- ↑ P. Rademacher: Organische Chemie IV. (PDF; 203 kB)
- ↑ H. D. Dakin: Catechol In: Organic Syntheses. 3, 1923, S. 28, doi:10.15227/orgsyn.003.0028; Coll. Vol. 1, 1941, S. 159 (PDF).
- ↑ Erich Koepp, Fritz Vögtle: Perkin-Synthese mit Cäsiumacetat. In: Synthesis. Band 1987, Nr. 2, Januar 1987, doi:10.1055/s-1987-27880.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Synthese von Cumarin nach aus Salicylaldehyd und Essigsäureanhydrid
Autor/Urheber: www.Pixel.la Free Stock Photos, Lizenz: CC0
food-wood-tomatoes
2-Hydroxybenzaldehyd; o-Hydroxybenzaldehyd; 2-Formylphenol; Salicylaldehyd
Reimer-Tiemann-Reaktion, allgemeines schema
Oxidation of Salicylaldehyde to Pyrocatechol







