Säure-Basen-Haushalt
Der Begriff Säure-Basen-Haushalt fasst die physiologischen Regelmechanismen zusammen, die der Konstanthaltung (Homöostase) der Protonenkonzentration und damit des pH-Werts dienen. Im arteriellen Blut sollte dieser 7,40 ± 0,05 (entsprechend einer H⁺-Konzentration um 40 nmol/l) betragen, Abweichungen davon heißen Azidose (Übersäuerung, d. h. zu hohe H⁺-Konzentration/zu niedriger pH-Wert) bzw. Alkalose (Untersäuerung, d. h. zu niedrige H⁺-Konzentration/zu hoher pH-Wert). Die zulässigen Schwankungen des pH-Werts sind sehr gering, weil sich Änderungen auf den Protonierungsgrad der Proteine auswirken, dadurch deren Konformation verändern und somit fast sämtliche Funktionen im Körper beeinträchtigen können.
Die strenge Konstanthaltung der Protonenkonzentration im nanomolaren Bereich erscheint äußerst schwierig, wenn man bedenkt, dass im Stoffwechsel entstehende Säuren leicht millimolare Konzentrationen erreichen. Tatsächlich wird ein H⁺-Überschuss oder -mangel rasch und völlig automatisch durch die Puffereigenschaften des Blutes und der Gewebe kompensiert. Störungen des Säure-Basen-Haushalts können kurzfristig über den Atemantrieb ausgeglichen werden, da vertiefte Atmung den CO2-Partialdruck und damit die Kohlensäurekonzentration im Blut senkt. Langfristig müssen jedoch alle Protonen, die im Stoffwechsel effektiv entstehen, über die Niere ausgeschieden werden.
Stoffwechselvorgänge
Kohlendioxid (CO2) als Endprodukt der Zellatmung fällt insbesondere bei körperlicher Arbeit in großen Mengen an. Im Blut reagiert es mit Wasser (H2O) unter Bildung von Kohlensäure (H2CO3), welche im Organismus sofort zu Hydrogencarbonat (HCO3−) und Protonen (H+) dissoziiert. Die Reaktion wird durch das Enzym Carboanhydratase katalysiert, sodass der größte Teil des CO2 im Blut nicht physikalisch gelöst, sondern als Hydrogencarbonat transportiert wird:
Die auf diese Weise entstehenden Protonen werden weitgehend dadurch abgepuffert, dass desoxygeniertes Hämoglobin (tense Konformation) eine höhere Affinität zu Protonen als oxygeniertes Hämoglobin (relaxed Konformation) hat; anders formuliert steigt der pKS-Wert des Hämoglobins bei Abgabe von Sauerstoff (siehe auch Bohr-Effekt und Haldane-Effekt).
Die durch Kohlensäure entstehenden Protonen müssen nicht renal ausgeschieden werden, da sich die beschriebenen Vorgänge in der Lunge umkehren, wo das gesamte im Stoffwechsel gebildete CO2 wieder abgeatmet wird. Effektiv fällt H⁺ vor allem beim Abbau schwefelhaltiger Aminosäuren zu Schwefelsäure an, täglich entstehen so bis zu 100 mmol harnpflichtiger Protonen.[1] Kohlenhydrate, Fettsäuren und Aminosäuren können ansonsten vollständig zu Wasser, CO2 und Harnstoff abgebaut werden. Dabei entstehen in der Gesamtbilanz keine Protonen. In manchen Stoffwechselsituationen treten allerdings vermehrt organische Säuren als Zwischenprodukte des Energiestoffwechsels auf, etwa Milchsäure bei Sauerstoffmangel oder 3-Hydroxybutansäure und Acetessigsäure im Hungerstoffwechsel.
Puffersysteme
Eine Mischung aus Säure und korrespondierender Base in etwa gleicher Konzentration bildet einen Puffer, da die Zugabe oder der Entzug von Protonen in einem solchen System fast ausschließlich die Umwandlung von Säure und Base ineinander bewirkt und kaum die Protonenkonzentration beeinflusst. Derjenige pH-Wert, bei dem ein gegebenes Säure/Basen-Paar in exakt gleichen Konzentrationen vorliegt und damit optimal puffert, heißt pKS-Wert. Die Henderson-Hasselbalch-Gleichung
stellt den Zusammenhang zwischen aktuellem pH-Wert und aktuellem Säure/Basen-Konzentrationsverhältnis her; es handelt sich dabei schlicht um eine logarithmierte und umgestellte Variante des Massenwirkungsgesetzes der Deprotonierung.
Für den Blutpuffer werden also Säure/Basen-Paare mit einem pKS-Wert nahe 7,4 benötigt. Für eine große Pufferkapazität müssen diese außerdem in großen Konzentrationen vorliegen.
Proteinpuffer
Der Proteinpuffer wird vom Hämoglobin in den Erythrozyten und den Plasmaproteinen gebildet. Er macht etwa 24 % der Pufferwirkung des Blutes aus. Dabei spielen vor allem Histidinreste der Proteine eine Rolle, deren pKS-Wert bei etwa 6,0 liegt.
Kohlensäure/Hydrogencarbonat-Puffer
Der Kohlensäure/Hydrogencarbonat-Puffer macht 75 % der Gesamtpufferkapazität des Blutes aus. Dadurch, dass das CO2 in der Lunge frei zwischen Blut und Luft wechseln kann, handelt es sich um ein offenes Puffersystem. Daraus ergibt sich ein Vorteil, der die große Bedeutung dieses Puffers trotz des suboptimalen pKS-Werts von 6,1 erklärt: Der CO2-Partialdruck kann durch vertiefte Atmung schnell gesenkt und in begrenztem Maße durch verminderte Atmung auch erhöht werden. Die Atemtiefe ist dabei über den pH-Wert reguliert: Ein Abfall stellt einen starken Atemreiz dar, wodurch die Atmung vertieft und damit CO2-Partialdruck und Kohlensäurekonzentration gesenkt werden. Wie an der Henderson-Hasselbalch-Gleichung nachvollzogen werden kann, erhöht die Senkung der im Nenner stehenden Kohlensäurekonzentration den pH-Wert, sodass sich ein negativ rückgekoppelter Regelkreis ergibt. Bei normaler Hydrogencarbonatkonzentration stellt sich ein arterieller CO2-Partialdruck von 40 mmHg ein, was einer Kohlensäurekonzentration von 1,2 mmol/l entspricht.
Die Zellen des proximalen Tubulus in der Niere geben für jedes H⁺, das sie in den Harn sezernieren, ein Molekül Hydrogencarbonat ins Blut ab. In der Henderson-Hasselbalch-Gleichung steht Hydrogencarbonat im Zähler, eine Konzentrationserhöhung erhöht also den pH-Wert. Auch die renale H⁺-Sekretion ist vom pH-Wert abhängig, kurzfristige Effekte lassen sich aber nicht erzielen. Bei normalem CO2-Partialdruck stellt sich eine Konzentration von 24 mmol/l ein.
Die bisher als getrennt dargestellten Regulationen von CO2-Partialdruck und Hydrogencarbonatkonzentration sind in Wahrheit nicht unabhängig voneinander möglich, da es sich um Gleichgewichtsreaktionen – auch mit anderen Puffern – handelt. Zur Erhöhung der Hydrogencarbonatkonzentration um 1 mmol/l genügt es beispielsweise nicht, dass die Niere ein Millimol Hydrogencarbonat an jeden Liter Blut abgibt: Jede Zugabe von Hydrogencarbonat treibt die Reaktion von Hydrogencarbonat mit H⁺ zu Wasser und CO2 an, sodass ein Teil des Hydrogencarbonats sogleich zur Neutralisierung von Protonen aufgebraucht und als CO2 abgeatmet wird. In gleicher Weise kann der CO2-Partialdruck nicht erhöht werden, ohne zugleich die Hydrogencarbonatkonzentration zu erhöhen.
Weitere Puffer
Die anderen Teil-Puffersysteme werden wegen ihrer geringeren Bedeutung oft als Nicht-Bicarbonat-Puffer, NBP, zusammengefasst. Es sind geschlossene Systeme, die Gesamtkonzentration der Puffersubstanzen kann sich nicht schnell ändern:
Beide Puffersysteme spielen vor allem im Urin eine Rolle; sie sorgen dafür, dass dessen pH-Wert auch bei Ausscheidung großer Mengen an Protonen nicht allzu niedrig wird. Die Menge der ausgeschiedenen Protonen hängt stark von der Ernährung ab; ein saurer Urin ist bei entsprechenden Stoffwechselbedingungen Ausdruck einer intakten Nierenfunktion und bedeutet keine Übersäuerung des Körpers, wie es in der Alternativmedizin oft behauptet wird.
Azidose hemmt die Harnstoffsynthese in der Leber, die den auszuscheidenden Stickstoff stattdessen in Form von Glutamin zur Niere schickt. Die Zellen des proximalen Tubulus desaminieren das Glutamin und nutzen das Kohlenstoffgerüst zur Gluconeogenese, während das freiwerdende Ammoniak über die apikale Membran in den Urin diffundiert, dort ein Proton bindet und dabei zugleich im Lumen fixiert wird, da Ammonium die Membran nicht überqueren kann.
Störungen

- Eine Azidose liegt bei einem Blut-pH-Wert < 7,35 vor.
- Eine Alkalose liegt bei einem Blut-pH-Wert > 7,45 vor.
Abhängig davon, ob die Ursache einer Azidose oder Alkalose bei der Atmung (= Respiration). zu suchen ist, spricht man von
- einer respiratorischen oder
- einer nichtrespiratorischen (synonym: metabolischen) Störung.
Respiratorisch
An der oben angegebenen Reaktionsgleichung kann man erkennen, dass ein Anstieg der Konzentration (des Partialdrucks) von CO2 auf der linken Seite zum Anstieg der Konzentrationen von Hydrogenkarbonat (HCO3−) und H+ auf der rechten Seite führt (Azidose, beispielsweise aufgrund einer ventilatorischen Störung). „Verstärktes“ Abatmen von CO2 (präziser: Abatmen der gleichen Menge bei verringertem Partialdruck im Blut) verringert andersherum die Konzentrationen von Hydrogenkarbonat (HCO3−) und H+ (Alkalose, beispielsweise bei Mehratmung aufgrund einer Gasaustauschstörung oder inadäquat als Hyperventilation).
Der respiratorischen Höhenalkalose liegt keine organische Störung zugrunde. Besteigt man einen Berg, sinkt der Luftdruck: Die Luft wird „dünner“ (siehe Barometerformel), insbesondere sinken die Partialdrücke von Sauerstoff und CO2. Damit trotzdem genug Sauerstoff über die Alveolarmembran gelangt, müssen Atemfrequenz und Atemtiefe gesteigert werden. Dabei nähern sich die Partialdrücke in den Alveolen den Partialdrücken in der Außenluft an, was eine Steigerung des Sauerstoffpartialdrucks und eine Abnahme des CO2-Partialdruckes bedeutet. Somit wird einerseits die Sauerstoffaufnahme verbessert, andererseits stellt sich aber ein problematisch niedriger CO2-Partialdruck im Blut ein.
Nichtrespiratorisch
Nichtrespiratorische Störungen entstehen durch
- gesteigerte oder verminderte Ausscheidung von H⁺ oder Hydrogencarbonat (über die Niere, aber auch durch Erbrechen und Durchfälle),
- übermäßige Aufnahme von Säuren oder Basen,
- vermehrtes Anfallen von Säuren im Stoffwechsel.
Eine metabolische Azidose ohne Krankheitswert tritt bei schwerer körperlicher Arbeit auf, da die Muskulatur bei anaerober Glykolyse Milchsäure (Lactat und Protonen) freisetzt; die erhöhte CO2-Produktion ist dagegen nur lokal von Bedeutung, da bei körperlicher Arbeit auch die Atmung gesteigert wird, sodass das vermehrt anfallende CO2 bei normalem Partialdruck abgeatmet werden kann.
Kompensation
Nichtrespiratorische Störungen werden sofort respiratorisch kompensiert (durch Anpassung des CO2-Partialdrucks), respiratorische Störungen werden langsam renal (durch Anpassung der Hydrogencarbonatkonzentration) kompensiert. Die Kompensation ist normalerweise unvollständig. Mangelnde oder übermäßige Kompensation können auf das Vorliegen einer weiteren Erkrankung hindeuten. Auch Kombinationen aus respiratorischen und nichtrespiratorischen Störungen kommen vor.
Wechselwirkung mit anderen Elektrolyt-Homöostasen
Hydrogencarbonat stellt zusammen mit Chlorid den größten Teil der negativen Ladung im Plasma. Zur Wahrung der Elektroneutralität geht ein Mangel an Hydrogencarbonat daher mit einer Überschuss an Chlorid und umgekehrt einher, wenn nicht zugleich eine Störung aufseiten der positiven Ladung vorliegt. Eine Ausnahme von dieser Regel stellt die metabolische Azidose mit vergrößerter Anionenlücke dar, die durch Anhäufung von Säuren wie Milchsäure, Ketonkörpern und manchen Giftstoffe entsteht, die ihr eigenes Anion in Form des Säurerestes mitbringen.
Im Sammelrohr existieren Schaltzellen, die H⁺ im Austausch mit Kalium sezernieren. Azidose und Hyperkaliämie können sich daher gegenseitig erzeugen, ebenso wie Alkalose und Hypokaliämie (die wiederum Folge eines Natriummangels sein kann). Den Austausch von Kalium gegen Protonen betreiben zudem die meisten Körperzellen mit der extrazellulären Flüssigkeit (mittelbar über Na⁺/H⁺-Austauscher und Na⁺/K⁺-ATPase); dies macht man sich bei der Akuttherapie der Hyperkaliämie durch Gabe von Natriumhydrogencarbonat zunutze.
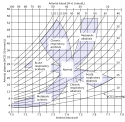
Parameter zur Beurteilung
Folgende Parameter werden in der Klinik herangezogen, um eine Azidose oder Alkalose auf ihren Ursprung hin zu klassifizieren und herauszufinden, inwiefern der Körper diese (teilweise) kompensiert.
Bicarbonat
Klinische Bedeutung Die HCO3 Konzentration ist signifikant bei der Bestimmung der „nicht-respiratorischen Komponenten“ im Falle einer Störung im Säure-Basen Haushalt. Änderungen dieser Konzentration helfen dem Kliniker bei der Erkennung des Ursprungs einer Azidose oder Alkalose. Im Klinik-Alltag kommen zwei Versionen zur Anwendung.
Aktuelles Bicarbonat Über die Henderson-Hasselbalch-Gleichung stehen der pH-Wert, der CO2-Partialdruck und die aktuelle Bicarbonatkonzentration im Blut (bzw. Plasmabicarbonatkonzentration, PBK) im Zusammenhang. Werden pH und pCO2 gemessen, kann das aktuelle Bicarbonat daraus errechnet werden.
- Das aktuelle Bicarbonat zeigt also die HCO3- Konzentration, wie sie bei bekannten pH- und pCO2-Werten tatsächlich vorhanden ist.
- verändert sich bei metabolischen und respiratorischen Störungen
Standard-Bicarbonat Um das HCO3std zu bestimmen, musste ursprünglich das Probenblut bei 37 °C, 100 % Sauerstoffsättigung und einem CO2-Partialdruck von 40 mmHg untersucht werden. Alle modernen Analysatoren sind aber inzwischen in der Lage, diesen Parameter aus dem aktuellen Probenblut zu berechnen. (Van Slyke und Cullen)
- Das HCO3std stellt den Bicarbonat-Gehalt des Plasmas dar, der bei einem pCO2 von 40 mmHg vorhanden wäre
- verändert sich bei nicht-respiratorischen Störungen
- bleibt bei respiratorischen Störungen unverändert
Basenabweichung und Gesamtpufferbasen
Basenabweichung (Base Excess):
- kennzeichnet die Abweichung vom Referenzwert der Gesamtpufferbasen. „+1“ bedeutet also einen Wert der Gesamtpufferbasen in Höhe von 49 mmol/l.
- positive Werte: metabolische Alkalose (oder metabolisch kompensierte respiratorische Azidose)
- negative Werte: metabolische Azidose (oder metabolisch kompensierte respiratorische Alkalose)
Gesamtpufferbasen:
- Summe aus Standard-Bikarbonat und allen weiteren basischen Puffern im Blut. Referenzwert für 100 % mit Sauerstoff gesättigtes Blut: 48 mmol/l
- verändert sich nicht bei respiratorischen, dafür aber bei nicht-respiratorischen Störungen.
Anionenlücke
Die Anionenlücke ist eine rechnerische Größe, die zur Differenzialdiagnose der metabolischen Azidose benutzt wird.
Normalwerte
| pH | 7,35 – 7,45 |
| pCO2 | 35 – 45 mmHg |
| aktuelles HCO3− | 20 – 27 mmol/l |
| Standard HCO3− | 21 – 26 mmol/l |
| Base Excess BE | (−3) – (+3) mmol/l |
| Gesamt Pufferbasen BB | 42 – 54 mmol/l |
| Anionenlücke | 3 – 11 mmol/l |
Siehe auch
Literatur
- S. Silbernagl, A. Despopoulos: Taschenatlas der Physiologie. 7. Auflage. Thieme, 2007, ISBN 978-3-13-567707-1.
- Peter Deetjen, Erwin-Joseph Speckmann, Jürgen Heschler: Physiologie. 4., vollständig überarbeitete Auflage. Urban & Fischer bei Elsevier, 2005, ISBN 3-437-41317-1.
- Friedrich F. Sander: Der Säure-Basenhaushalt des menschlichen Organismus. 3. Auflage. Hippokrates Verlag, Stuttgart 1999, ISBN 3-7773-1428-5.
- K. F. Rothe, Rudolf Schorer: Der Säure-Basen-Haushalt in der Anästhesiologie und operativen Intensivmedizin. Physiologie, Pathophysiologie und Klinik der Azidosen. In: Anästhesie Intensivtherapie Notfallmedizin. Band 20, Nr. 2, April 1985, S. 69–75.
Weblinks
- Bicarbonat- und BE-Rechner (engl.)
- Störungen des Säure-Basen-Haushalts: Rationale Diagnostik und ökonomische Therapie. Dtsch Arztebl 2005; 102: A 1896–1899 (Heft 26)
Einzelnachweise
- ↑ Robert Franz Schmidt, Florian Lang, Manfred Heckmann (Hrsg.): Physiologie des Menschen. 31. Auflage. Springer Medizin Verlag, Heidelberg 2010, ISBN 978-3-642-01650-9, S. 754.
Auf dieser Seite verwendete Medien
A acid-base nomograph of human serum, commonly used in physiology and medicine. Subscripts not quite correct due to my Mac and Inkscape issues.‘’