Täublinge
| Täublinge | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
(c) James Lindsey at Ecology of Commanster, CC BY-SA 3.0 Der Kirschrote Spei-Täubling (Russula emetica) ist die Typart der Gattung Russula. | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Russula | ||||||||||||
| Pers. |
Täublinge (Russula) sind eine sehr umfangreiche Pilzgattung aus der Familie der Täublingsverwandten in der Ordnung der Täublingsartigen. Die Täublinge zählen mit schätzungsweise 750 Arten zu den artenreichsten Pilzgattungen. Es handelt sich zumindest bei den europäischen Arten der weltweit verbreiteten Gattung ausschließlich um Mykorrhiza-Pilze, die für den Bestand unserer Wälder unverzichtbar sind. Die Fruchtkörper sind meist recht groß und häufig auffallend bunt, zudem zählen einige Arten zu den beliebtesten Speisepilzen. So sind die Täublinge gleichermaßen bei Mykologen und Pilzsammlern sehr beliebt. Zu ihren charakteristischsten Merkmalen gehören neben den spröden Lamellen das glatt wie eine Karotte brechende Fleisch. Der Grund hierfür sind die im Pilzfleisch eingelagerten Kugelzellen, die Sphaerozysten. Eine weitere Besonderheit ist das Sporenornament, das sind warzige oder dornige Verzierungen, die die Sporen unter dem Mikroskop fast wie Kieselalgen aussehen lassen. Allerdings wird dieses Ornament erst sichtbar, wenn man die Sporen mit Jodreagenz anfärbt (amyloid). All diese Merkmale teilen sich die Täublinge mit den Milchlingen und der Gattung Lactifluus. Im Gegensatz zu diesen führen die Saftgänge (Laticiferen) der Täublinge keinen Milchsaft. Die Gattung Russula wurde von Christian Hendrik Persoon im Jahre 1796 beschrieben.
Merkmale




Die meisten Täublinge bilden Fruchtkörper mit Hut, Stiel und Lamellen, es gibt jedoch einige Arten mit sequestraten Fruchtkörpern, deren Hymenophor zu einer Gleba umgewandelt wurde oder zumindest aus stark miteinander verwachsenen ehemaligen Lamellen besteht[1]. Der Stiel kann dann sehr stark reduziert sein, was den Fruchtkörpern auch ein trüffel- oder allgemein bauchpilzartiges Aussehen verleihen kann[1]. Es kann auch sein, dass eine Art sowohl sequestrate, als auch normale, lamellate Fruchtkörper ausbilden kann, wie im Fall vom Russula messapica[1], die sich als konspezifisch mit der sequestraten Russula messapicoides (vormals Macowanites messapicoides)[2] herausgestellt hat[1]. Fruchtkörper mit Hut und Stiel sind meist zentral gestielt und zeigen häufig in der Huthaut leuchtende Farben, die je nach Art von blassen oder fast weißen Tönen über gelb, grün, rot, violett bis braun oder fast schwarz reichen können. Das Fleisch, die Lamellen und der Stiel sind dagegen bei den meisten Arten weißlich bis elfenbeinfarben. Die Huthaut ist meist kahl, trocken oder klebrig bis schmierig und in der Regel ungezont, das heißt, nicht in konzentrische Farbabstufungen eingeteilt. Die Haut ist bei vielen Arten zumindest teilweise bis fast vollständig abziehbar. Bei reifen Fruchtkörpern ist der Hut oft abgeflacht bis niedergedrückt (konkav).
Die Lamellen stehen frei oder laufen leicht am Stiel herab, stehen eher weit und sind dicklich. Wie bei den Milchlingen weisen sie eine charakteristische Brüchigkeit auf, die durch das Splittern beim Drüberstreichen feststellbar ist. Eine Ausnahme bilden dabei vor allem der Frauen-Täubling (R. cyanoxantha) sowie in etwas geringerer Ausprägung beispielsweise der Mehlstiel-Täubling (R. farinipes), der Fleischrote Speise-Täubling (R. vesca), der Grüne Speisetäubling (R. heterophylla) und der Wiesel-Täubling (R. mustelina). Weiterhin sind die Lamellen oft, vor allem in Stielnähe gegabelt und bei einigen Arten mit Querverbindungen (Anastomosen) versehen. Kürzere Zwischenlamellen sind meist nicht oder nur in geringer Zahl vorhanden und nur bei den Weiß- und Schwärz-Täublingen sowie der Sektion Archeinae regelmäßig zu finden[3].
Der Stiel ist annähernd walzenförmig, bei europäischen Arten unberingt[A 1] und ohne Scheide. Er ist brüchig-starr bis weich-brüchig und bricht ähnlich wie das Fruchtfleisch von Äpfeln. Dieses für Täublinge und die verwandten Milchlinge charakteristische Bruchverhalten wird durch die heterogene Trama (Fleisch) hervorgerufen, die neben normalen, schmalen, langzelligen Hyphen auch Hyphen aus kugelförmige Zellen (Sphaerocyten) mit 20–50 µm Durchmesser enthält.
Ein Velum universale kann vorhanden sein, ist jedoch meist sehr stark reduziert und an der Stielbasis und teils auch auf der Huthaut vorhanden (z. B. im Subgenus Ingratula sect. Subvelatae nach Sarnari)[3].
Der Geruch ist meist schwach obst- bis nussartig, kann aber auch heringsartig sein. Der Geschmack ist mild bis stark oder sehr scharf, manchmal auch bitter, wobei diese Wirkung teils erst nach bis zu 30 Sekunden Verzögerung eintritt. Wie die Milchlinge besitzen auch die Täublinge im Trama Laticiferen, die hier jedoch keine Milch führen, sondern lediglich in manchen Arten charakteristische Tränen an Lamellen und Stielspitzen erzeugen. Diese Safthyphen lassen sich mit Sulfovanillin anfärben. Häufig sind sie bei den scharfschmeckenden Arten an der Lamellenbasis sowie unter der Oberhaut von Hut und Stiel.
Das Sporenpulver ist weiß bis dunkelockergelb gefärbt. Die Sporen selbst sind kurzellipsoid bis rundlich geformt. Die Oberfläche ist fein- bis grobwarzig und manchmal gratig bis netzartig ornamentiert. Das Ornament ist amyloid. Die Basidien sind keulenförmig und 25 bis 60 Mikrometer lang. An diesen sitzen vier Sporen an vier bis acht Mikrometer langen Sterigmen. Die Gleozystiden sind unterschiedlich geformt. Oft sind sie auffallend an den Lamellenflächen und -schneiden und häufig auch in der Huthaut und der Stieloberfläche vorhanden. Sie färben sich mit Sulfovanillin mehr oder weniger intensiv blau sowie mit Sulfoformol dunkelblau.
Einige Täublinge enthalten große Mengen an Riboflavin. Die oft kräftigen Hutfarben entstehen durch Pteridine. Diese sind bei einigen Arten farblos, können aber durch ihre fluoreszierenden Eigenschaften unter ultraviolettem Licht sichtbar gemacht werden. Sie leuchten dann ebenfalls recht intensiv. Beide Inhaltsstoffe sind von Nukleotiden abgeleitet. Diese befinden sich aufgrund ihrer Wasserlöslichkeit im Zellsaft der Vakuolen.
Makrochemische Merkmale
Bei der Bestimmung von Täublingen werden häufig auch einfache makrochemische Reaktionen eingesetzt, um schwer unterscheidbare Arten sicher abgrenzen zu können. Wichtige makrochemische Reaktionen sind die Guajakreaktion, die Eisensulfatreaktion, die Phenolreaktion, die Sulfovanillin- oder Sulfoformolreaktion.
- Die Eisensulfatreaktion
- Meist verwendet man hierfür eine 10%ige FeSO4-Lösung. Tropft man die Lösung unterhalb der Lamellen auf den Stiel, so verfärbt sich das Stielfleisch gewöhnlich fleischrötlich bis gräulich. Bei älteren Fruchtkörpern kann die Reaktion ins schmutzig olivfarbene übergehen. Von Bedeutung sind Reaktionen, die von dieser Standardreaktion abweichen. So kann sich das Fleisch ohne gräuliche Verfärbung fleisch- oder lachsrosa verfärben oder es färbt sich grün bis olivgrün. Einige Täublinge lassen sich mit Eisensulfat gar nicht oder fast nicht anfärben.
| Farbreaktion | Arten |
|---|---|
| mehr oder weniger stark graulich rötlich | Mehrzahl der Arten |
| fleischrot bis intensiv orangerot | Fleischroter Speise-Täubling, Grüner Speise-Täubling, einige Griseinae und weitere Arten |
| deutlich grünlich bis bläulich grün | Viridantinae (Heringstäublinge) |
| gar nicht | Frauen-Täubling, Enten-Täubling |
- Die Phenolreaktion
- Gewöhnlich verwendet man hierfür eine 2%ige Phenollösung. Das Reagenz färbt alle Täublinge früher oder später schokoladenbraun. Nur die Vertreter der Untersektion Olivaceinae machen hier eine Ausnahme, sie verfärben sich weinrot bis purpurviolett. Eine weitere Ausnahme ist der Samt-Täubling, bei dem sich das Fleisch ebenfalls purpurviolett verfärbt. Daher ist die Phenolreaktion ein wichtiges Merkmal zur Unterscheidung der Arten innerhalb der Untersektion Amoeninae.
- Die Ammoniakreaktion
- Eine 10–30%ige Ammoniaklösung färbt den Zitronenblättrigen Täubling besonders im Hutfleisch und an den Lamellen rot; besonders gut färben sich überreife Exemplare. Damit stellt dies eine gute Nachweisreaktion innerhalb der Untersektion Sanguinae dar. Auch der Hohlstielige Täubling verfärbt sich an den genannten Stellen leuchtend rot. Beim Milden Kamm-Täubling verfärbt sich die Stielbasis mit Ammoniak aber auch mit anderen Basen rötlich.
- Anilinöl oder Anilinwasser färbt das Fleisch bei allen Viridantinae rot. Die Lamellen des Grünen Speisetäublings und des Wiesel-Täublings verfärben sich damit gelb.
- Meist verwendet man eine 30%ige KOH-Lösung, seltener auch NaOH. Die Basen bewirken eine lebhaft gelbe oder chromgelbe Reaktionen auf der Huthaut oder Stielrinde von einigen Vertretern der Foetens-Gruppe. Das reduzierte Velum universale der Stielbasis des Milden Kamm-Täublings und auch des Zitronen-Täublings verfärbt sich damit rot[3][4].
- Formol (Formalin)
- Formalin (eine 40%ige Formaldehydlösung) verfärbt das Stielfleisch von Vertretern der Nigricans-Gruppe innerhalb von 2–3 Minuten orangerot. Auch das Fleisch des Purpurbraunen Leder-Täublings, des Weinroten und Orangeroten Graustiel-Täublings und des Rußgrauen Täublings verfärben sich rötlich. Beim Kiefern-Täubling färbt sich das Fleisch etwas rosa.
- Die Sulfovanillin-Reaktion
- Sulfovanillin wird meist mikroskopisch eingesetzt, um Zystiden anzufärben und nachzuweisen, es kann aber auch makroskopisch angewendet werden. Dazu verwendet man meist getrocknetes Material, da frisches wegen des wechselnden Wassergehaltes keine konstante Färbung erlaubt. Die meisten Arten färben sich mit dem Sulfovanillin-Reagenz mehr oder weniger schmutzig purpurn bis bläulich-(violett) an. Nur die Arten aus der Untersektion Roseinae färben sich schön rosa und lassen sich damit leicht nachweisen.[5][6][7]
Ökologie und Verbreitung
Täublinge sind erdbewohnende Ektomykorrhiza-Pilze[8][A 1], die je nach Art mit verschiedenen Baumarten oder krautigen Pflanzen zusammenleben. Einige Arten sind sehr wirtsspezifisch; eine Übersicht über die mit Täublingen vergesellschafteten Pflanzenarten gibt Beenken (siehe Weblinks). Daher sind sie nur in Wäldern, Mooren, Parks, Gärten oder in mit Zwergsträuchern bewachsenen Tundren zu finden. Einige Arten zeigen eine deutliche Vorliebe für Kalk- oder saure Böden.
Die Gattung ist auf allen Kontinenten verbreitet, wobei das Hauptareal in den gemäßigten Breiten der Holarktis liegt.
Systematik
Morphologisch
Die Gattung der Täublinge umfasst ca. 750 Arten weltweit, ca. 160 davon kommen allein in Mitteleuropa vor. Somit gehören die Täublinge zu einer der artenreichsten Hutpilzgattungen überhaupt. Es lag daher nahe, die Gattung in Subgattungen, Sektionen und Subsektionen zu unterteilen und ein System aufzustellen, das aufgrund von morphologischen, anatomischen und makrochemischen Merkmalen den natürlichen Verwandtschaftsverhältnissen möglichst nahekommt.
So wurden im letzten Jahrhundert eine ganze Reihe von Klassifikations-Systemen aufgestellt, wobei das Erscheinungsbild der Fruchtkörper, die Sporenpulverfarbe, der Geschmack und die Verfärbung des Fleisches meist als entscheidende Merkmale herangezogen wurden. Ergänzend dazu wurden mehr und mehr auch mikroskopische Merkmale berücksichtigt, wie die Ausprägung der Huthaut und die Sporenornamentation. Die vier wichtigsten Klassifikations-Systeme stammen dabei von Rolf Singer (zuletzt 1986), Henri Romagnesi (1967, 1985, 1987), Marcel Bon (1988) und Mauro Sarnari (1998).[8][9]
Das System von Singer war das erste der vier genannten. Singer veröffentlichte es 1932 in seiner Monographie der Gattung Russula. Dieses System wurde von ihm später immer wieder an die neuesten Erkenntnisse der Russula-Forschung angepasst, seine letzte Revision stammt aus dem Jahr 1986. Während die späteren Systematiker ihr System vorwiegend auf europäischen Arten aufbauten, berücksichtigte Singer von Anfang an auch außereuropäische Arten. Singer unterteilt die Gattung Russula auf Sektions- und Subsektionsebene und kommt bei seiner Einteilung ganz ohne Subgattungen aus. Bei seiner Einteilung legte er ein höheres Gewicht auf makroskopische Merkmale. Ein besonders wichtiges Merkmal ist für ihn die Verfärbung des Fleisches an der Luft. Im Unterschied zu späteren Systemen ist bei ihm die Sektion Rigidae eine besonders umfangreiche, die bei ihm die Heterophyllidia und die hellsporige Incrustatula-Arten vereinigt. Seine Sektion Constantes hingegen ist eine ursprünglich große Restegruppe mit Pilzen, deren Fleisch sich nicht verfärbt oder nur gilbt. In späteren Überarbeitungen verkleinerte sich diese Sektion, dadurch, dass er deren Vertreter in andere Sektionen verschob.[10][11] Aufgrund der geringen Beachtung mikroskopischer Merkmale wird Singers System eine relativ geringe Bedeutung zugemessen.[12]
| Ursprüngliche Merkmale | Abgeleitete Merkmale |
|---|---|
| Pigmentierung fehlend oder schmutzig (bräunlich) | Farben lebhaft |
| Sporen weiß oder blass | Sporen gefärbt |
| Huthaut angewachsen oder wenig differenziert, trocken, bereift oder flaumig behaart | Huthaut von Huttrama gut abtrennbar, gelatinös, glatt und glänzend |
| Fruchtkörper kräftig gebaut, festfleischig | Fruchtkörper zierlich und zerbrechlich |
| Fleisch bitter oder scharf | Fleisch mild |
| Lamellen ungleich lang (mit Zwischenlamellen), herablaufend | Lamellen gleich lang, von Hutkante bis Stielansatz verlaufend (ohne Zwischenlamellen) |
| Hutrand scharf, glatt | Hutrand abgerundet, gerieft |
| Stiel ausgefüllt, sich zur Basis hin verjüngend | Stiel hohl, keulenförmig |
| Sporen länglich, mit niederer, schwacher und möglicherweise netziger Ornamentierung | Sporen rundlich, mit kräftiger Ornamentierung, möglicherweise bestehend aus isolierten Warzen oder Stacheln |
| Zystiden in der Huthaut vorhanden | Huthaut mit spezialisierten Elementen oder Primordialhyphen |
Das wahrscheinlich einflussreichste System wurde 1967 von Romagnesi in seinem Standardwerk Les Russules d’Europe et d’Afrique du Nord vorgeschlagen. Letztlich sind alle späteren Systeme nur Modifikationen des romagnesischen Systems oder Erweiterungen, die es um Arten aus Nord- und Südamerika beziehungsweise dem tropischen Afrika ausdehnen. Durch die konsequente Auswertung aller Merkmalskomplexe gelang es ihm, ein natürliches System zu entwickeln, das weitgehend in sich schlüssig ist. Er legte dabei ein besonderes Gewicht auf die mikroskopischen Merkmale der Huthaut.[13] Grundlage zur Erstellung der Systematik bilden dabei theoretisch aufgestellte Evolutionstendenzen, die bereits 1935 von Julius Schäffer aufgestellt wurden.[14]
Das System von Marcel Bon ist ebenfalls eine Überarbeitung des Romagnesischen. Bon unterteilt die Gattung Russula in zwei Untergattungen, die Compacta und die (Eu)Russula. Sein System wird in vielen Punkten durch die Arbeiten von Ludwig Beenken unterstützt. Beekens untersuchte die Mykorrhizen innerhalb der Gattung Russula und fand dabei eine ganze Reihe neuer vom Fruchtkörper unabhängiger Merkmale. Aufgrund des gefundenen Merkmalskomplexes erstellte er ein System, das mit dem Bonschen weitetestgehend übereinstimmt. Auch moderne DNA-Analysen stützen Bons Klassifikations-System in vielen Punkten.
Die Systematiken von Romagnesi und Bon sind auf europäische Arten beschränkt. Sarnari bezieht auch außereuropäische Arten mit ein. Bon und Sarnari bewerten makroskopische Merkmale, wie vor allem makrochenische Farbreaktionen des Fruchtfleisches, geringer als Romagnesi. Dafür wird den mikroskopischen Eigenschaften, wie mikrochemische Reaktionen und Charakteristiken der Basidien, mehr Bedeutung zugemessen. Des Weiteren findet bei Sarnari der Geschmack der Fruchtkörper bedeutend weniger Beachtung.[15]
| Die Täublingssystematik nach M. Bon |
|---|
|
Genetisch
Die Gattung der Täublinge wurde auch phylogenetisch untersucht. Nach der Maximum-Likelihood-Methode lassen sich die Verwandtschaftsverhältnisse wie folgt darstellen.[16] In der Klassifikation wurdenRomagnesi (1967, 1985, 1987) undBon (1988) miteinander verglichen. Untergattungen sind unterstrichen; nicht unterstrichen sind die Sektionen und Subsektionen. Bon unterscheidet nur die beiden Untergattungen Compacta und Russula. Erstere enthält die gleichen Arten wie die Systematik von Romagnesi. Russula umfasst bei Bon deutlich mehr Sektionen als das Romagnesische System Untergattungen enthält. Unterschiede beider Konzepte im Vergleich zur phylogenetischen Systematik sind unten in den Kladogrammen verdeutlicht.
Molekulargenetische Untersuchungen ergaben, dass die Gattung Russula mit hoher Wahrscheinlichkeit paraphyletisch ist. Außerdem wurde festgestellt, dass Russula earlei phylogenetisch sehr ursprüngliche Eigenschaften aufweist. Es stellte sich weiterhin heraus, dass mikroskopische und makroskopische Eigenschaften der Fruchtkörper nur beschränkt für die Klassifikation verwendbar sind; besser geeignet ist der Aufbau der Mykorrhiza (s. Kladogramme). Die Analysen zeigten, dass die Sektionen Plorantinae und Nigricantinae wahrscheinlich keinen gemeinsamen Ursprung haben (nicht monophyletisch). Darüber hinaus sind die Untergattung Heterophyllidae und die Sektion Foetentinae nahe verwandt. Daraus lässt sich schlussfolgern, dass die Untergattung, die die Sektionen Foetentinae und Felleinae enthält, paraphyletisch ist. Durch die genetischen Analysen ließen sich die Untergattungen Insidiosula und Russula als monophyletisch bestätigen, wobei letztere um den Gallen-Täubling (Russula fellea) und den Zitronentäubling (Russula ohroleuca) erweitert sowie um den Harten Zinnober-Täubling (Russula lepida) und den Sonnen-Täubling (Russula solaris) vermindert wird (s. Kladogramme).[17]
Mykorrhiza: pseudoparenchymatische Mykorrhizamäntel Compacta, Heterophyllidia und Foetentinae
|
Mykorrhiza: Mykorrhizen mit Zystiden Typen
Weitere Untergattungen
|
Bedeutung
Als Symbionten
Als wichtige Mykorrhiza-Pilze sind Täublinge von großer ökologischer Bedeutung und, da sie mit wichtigen Nutzholzarten vergesellschaftet sind, auch forstwirtschaftlicher Bedeutung. Viele Täublingsarten sind beliebte und wichtige Speisepilze, die in einigen Ländern auch gehandelt werden.
Als Speise- oder Giftpilze
Zahlreiche Täublinge sind gute Speisepilze. Trotz der teilweise schweren Bestimmung einzelner Arten können sie durch die sogenannte Täublingsregel in essbare und ungenießbare beziehungsweise giftige Arten unterschieden werden, wenn die Gattung sicher erkannt ist. Als essbar gelten in Mitteleuropa die mild bis leicht scharf schmeckenden Arten;[18] schmeckt der Pilz scharf, handelt es sich um eine ungenießbare oder giftige Art. Es kann auch ein bis zwei Minuten dauern, bis sich das Schärfegefühl einstellt. Diese Regel gilt ausschließlich für Täublinge und Milchlinge und darf bei anderen Pilzgattungen nicht angewendet werden. Bei einigen Giftpilzen kann schon das Zerkauen geringer Mengen zu schwerwiegenden Vergiftungen führen. Die meisten scharfen Arten sind ungenießbar. Einige sind nach einer entsprechenden Vorbehandlung verwertbar.
Todesfälle durch Täublinge

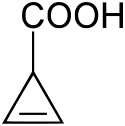
Todesfälle durch Täublinge sind ausschließlich aus Ostasien bekannt. Stark giftige Arten sind kaum vertreten, offenbar nur der Nisekurohatsu (Russula subnigricans), der in Japan, China und in Taiwan vorkommt und als einziger lebensbedrohlich giftiger Täubling identifiziert wurde.[19] Durch die Täublingsregel kann er nicht sicher als giftig erkannt werden. Der Verzehr kann zu einer potenziell tödlichen, durch Cycloprop-2-en-carbonsäure (Bild) verursachten Rhabdomyolyse führen, da seine Giftstoffe von denen der europäischen Täublingsarten verschieden sind.[20]
Bestimmung
Zur Bestimmung der Täublinge ist neben den Farben von Hut, Lamellen und Stiel vor allem die Farbe des Sporenpulvers von Bedeutung. Diese ist, insbesondere zu den genannten äußerlichen Farbeigenschaften des Fruchtkörpers, bei den jeweiligen Arten nur in äußerst geringem Maß variabel. Ausnahmen bilden unter anderen der Buchen-Herings-Täubling (Russula faginea), der Zitronenblättrige Täubling (Russula sardonia), der Jodoform-Täubling (Russula turci) und der Stachelbeer-Täubling (Russula queletii), deren Sporenpulverfarben ein wenig variieren können, sowie der Große und der Kleine Rosa Täubling, deren Sporenstäube leicht nachdunkeln oder der Flammstiel-Täubling (Russula rhodopoda), der allmählich verblassendes Sporenpulver besitzt. Die Sporenpulverfarbe kann mit Hilfe eines Sporenabwurfpräparates und den dabei entstehenden Sporenabdruck ermittelt werden, wobei dieser mit einer Farbtafel verglichen wird.
| Romagnesi | Crawshay | Schäffer | Beispiele nachRomagnesi | Darstellung (CMYK/RGB)[A 2] | |
|---|---|---|---|---|---|
| I a | blanche | A | weiß | Frauen-Täubling (Russula cyanoxantha), Dickblättriger Schwärz-Täubling (Russula nigricans) | 0C,0M,0Y/(255,255,255) |
| I b | blanchâtre | A–B | fast weiß | Kirschroter Spei-Täubling (Russula emetica var. emetica) | 0C,0M,10Y/(255,255,229) |
| II a | crème blanchâtre | B | blass | Harter Zinnober-Täubling (Russula rosea) | 0C,2M,20Y/(255,249,204) |
| II b | crème pâle | C | blass | Violettbrauner Täubling (Russula brunneoviolacea), Camembert-Täubling (Russula amoenolens) | 0C,5M,30Y/(255,242,178) |
| II c | crème moyen | D | blass creme | Tauben-Täubling (Russula grisea) | 0C,5M,40Y/(255,242,153) |
| II d | crème foncé | D–E | creme | Brätlings-Täubling (Russula amoenicolor) | k. A. |
| III a | ocre pâle | E | creme | Blut-Täubling (Russula sanguinaria) | 0C,10M,40Y/(255,229,153) |
| III b | ocre clair | E–F | hellocker | Ziegelroter Täubling (Russula velenovskyi) | |
| III c | ocre foncé | F | hellocker | Roter Herings-Täubling (Russula xerampelina s. str.) | 0C,28M,60Y/(255,183,102) |
| IV a | jaune pâle | F ? | ocker | Buchen-Herings-Täubling (Russula faginea) | |
| IV b | jaune clair | F–G | ocker | Ockerblättriger Zinnober-Täubling (Russula pseudointegra), Purpurfleckiger Täubling (Russula veternosa) | 0C,30M,80Y/(255,178,50) |
| IV c | jaune moyen | G | satt ocker | Brauner Leder-Täubling (Russula integra) | 0C,40M,80Y/(255,153,50) |
| IV d | jaune foncé | G–H | dotter-orange | Weißstieliger Leder-Täubling (Russula romellii) | |
| IV e | jaune vif | H | dottergelb | Weinroter Dotter-Täubling (R. decipiens), Purpurbrauner Dotter-Täubling (Russula cuprea) | |
Ein weiteres bedeutendes Merkmal für die Bestimmung ist der Geschmack beziehungsweise die Schärfe des Fleisches. Allerdings kann auch diese bei einigen Arten variieren. Ebenfalls relevant ist die Ornamentation des Sporenpulvers, welche in Melzers Reagenz unter Ölimmersion betrachtet wird. Wichtig ist auch die Beschaffenheit der Huthaut; Merkmale sind dabei Oberflächeneigenschaften wie Bereifung, Rauheit, Glanz, Klebrigkeit und das Vorhandensein von Schleim sowie die Abziehbarkeit der Huthaut. Weiterhin sind Konsistenz und Verfärbung des Fleisches von Bedeutung. Letzteres kann sich als Röten, Grauen oder Schwärzen äußern. Außerdem dienen chemische Reaktionen in makro- und mikroskopischer Dimension zur Bestimmung. Diese können für Arten oder Artgruppen charakteristisch sein.
Arten (Auswahl)
Die folgende Liste gibt eine Auswahl bekannter und verhältnismäßig häufiger Arten der Täublinge.
| Deutscher Name | Lateinischer Name |
|---|---|
| Amethyst-Täubling | Russula amethystina |
| Apfel-Täubling | Russula paludosa |
| Blaugrüner Reif-Täubling | Russula parazurea |
| Blut-Täubling | Russula sanguinaria syn. Russula sanguinea |
| Brätlings-Täubling | Russula amoenicolor |
| Brauner Leder-Täubling | Russula integra |
| Buchen-Spei-Täubling | Russula nobilis syn. Russula mairei |
| Buckel-Täubling | Russula caerulea syn. Russula amara |
| Camembert-Täubling | Russula amoenolens |
| Dichtblättriger Schwärz-Täubling | Russula densifolia |
| Dickblättriger Schwärz-Täubling | Russula nigricans |
| Fleischroter Speisetäubling | Russula vesca |
| Frauen-Täubling | Russula cyanoxantha |
| Gallen-Täubling | Russula fellea |
| Gelber Graustiel-Täubling | Russula claroflava |
| Gemeiner Weiß-Täubling | Russula delica |
| Gold-Täubling | Russula aurea |
| Grauvioletter Täubling | Russula grisea |
| Grasgrüner Täubling | Russula aeruginea |
| Grüner Speisetäubling | Russula heterophylla |
| Grüngefelderter Täubling | Russula virescens |
| Harter Zinnober-Täubling | Russula rosea syn. Russula lepida |
| Jodoform-Täubling | Russula turci |
| Kirschroter Spei-Täubling | Russula emetica |
| Kratzender Kamm-Täubling | Russula recondita |
| Kurzstieliger Leder-Täubling | Russula curtipes |
| Mehlstiel-Täubling | Russula farinipes |
| Milder Wachstäubling | Russula puellaris |
| Netzflockiger Rosa-Täubling (Morgenrottäubling) | Russula aurea |
| Ockerblättriger Zinnober-Täubling | Russula pseudointegra |
| Orange-Täubling | Russula aurantiaca |
| Orangeroter Graustiel-Täubling | Russula decolorans |
| Purpurschwarzer Täubling | Russula atropurpurea |
| Rauchbrauner Schwärz-Täubling | Russula adusta |
| Roter Herings-Täubling | Russula xerampelina |
| Rotstieliger Leder-Täubling | Russula olivacea |
| Rotstieliger Reif-Täubling | Russula lilacea |
| Rußgrauer Täubling | Russula consobrina |
| Samt-Täubling | Russula amoena |
| Scharfblättriger Schwärz-Täubling | Russula acrifolia |
| Scharfer Honig-Täubling | Russula veternosa |
| Scharfer Zinnober-Täubling | Russula pungens syn. Russula rubra |
| Schmalblättriger Weiß-Täubling | Russula chloroides |
| Stachelbeer-Täubling | Russula queletii |
| Stink-Täubling | Russula foetens |
| Verblassender Täubling | Russula exalbicans |
| Vielfarbiger Täubling | Russula versicolor |
| Violettstieliger Täubling | Russula violeipes |
| Wechselfarbiger Spei-Täubling | Russula fragilis |
| Wechselfarbiger Dotter-Täubling | Russula risigallina |
| Weißblättriger Reif-Täubling | Russula azurea |
| Weicher Dotter-Täubling | Russula intermedia syn. Russula lundellii |
| Wiesel-Täubling | Russula mustelina |
| Zedernholz-Täubling | Russula badia |
| Ziegelroter Täubling | Russula velenovskyi |
| Zinnoberroter Reif-Täubling | Russula emeticicolor |
| Zitronenblättriger Täubling | Russula sardonia |
| Zitronentäubling (Ockertäubling) | Russula ochroleuca |
Siehe auch
Liste der Täublinge
Literatur
- German Josef Krieglsteiner (Hrsg.), Andreas Gminder, Wulfard Winterhoff: Die Großpilze Baden-Württembergs. Band 2: Ständerpilze: Leisten-, Keulen-, Korallen- und Stoppelpilze, Bauchpilze, Röhrlings- und Täublingsartige. Ulmer, Stuttgart 2000, ISBN 3-8001-3531-0.
- Julius Schäffer: Die Pilze Mitteleuropas. Band 3: Russula-Monographie. Verlag Julius Klinkhardt, Bad Heilbrunn Obb. 1952.
- Heinrich Dörfelt, Gottfried Jetschke (Hrsg.): Wörterbuch der Mycologie. 2. Auflage. Spektrum, Akademischer Verlag, Heidelberg u. a. 2001, ISBN 3-8274-0920-9.
- Edmund Michael, Bruno Hennig, Hanns Kreisel: Handbuch für Pilzfreunde. Fünfter Band: Blätterpilze – Milchlinge und Täublinge. 2. Auflage. Fischer, Stuttgart 1983, ISBN 3-437-30350-3.
Anmerkungen
- ↑ a b In den Tropen Afrikas gibt es beringte Arten, die möglicherweise saprophytisch leben; Beispiele hierfür sind R. annulata und R. radicans. Es ist umstritten, ob es sich dabei um ursprüngliche oder abgeleitete Merkmale handelt und ob diese Gruppe in eine eigene Gattung zusammengefasst werden sollte.
(A. Gminder et al.: Die Großpilze Baden-Württembergs. S. 430.
E. Michael et al.: Handbuch für Pilzfreunde. S. 85 f.)
Weiterhin wurden in Europa scheinbar beringte Arten wie R. adelae beschrieben. Dabei handelt es sich jedoch um Exemplare gewöhnlicher Arten (im genannten Beispiel der Zitronentäubling (R. ochroleuca)), die von einem parasitischen Pilz befallen wurden, der unter dem Hut des befallenen Pilzes eine dünne, häutige Struktur besitzt und einen zum Wirt gehörigen Ring vortäuscht.
(E. Michael et al.: Handbuch für Pilzfreunde. S. 86.) - ↑ Die Angaben für das CMYK-Farbmodell stammen aus: Josef Breitenbach, Fred Kränzlin: Pilze der Schweiz. Band 6. Milchlinge und Täublinge. Mycologia, Luzern 2005, ISBN 3-85604-060-9. Da sie unabhängig von der Gesamtklassifikation ermittelt wurden, ergeben sie nicht zwangsläufig eine farbliche Abstufung. Es zeigt sich bereits, dass sich die Angaben bei Farbtönen, für die Romagnesi mehrere Beispiele angegeben hat, teilweise deutlich unterscheiden. In der obigen Darstellung wurde jeweils das erstgenannte Beispiel gewählt. Die Angaben für das CMYK-Modell wurden in das RGB-System umgerechnet. Die farbliche Darstellung erfolgt über die Hexadezimale Farbdefinition.
Einzelnachweise
- ↑ a b c d J.M. Vidal, P. Alvarado, M. Loizides, G. Konstantinidis, P. Chachuła: A phylogenetic and taxonomic revision of sequestrate Russulaceae in Mediterranean and temperate Europe. In: Persoonia – Molecular Phylogeny and Evolution of Fungi. Band 42, Nr. 1, 19. Juli 2019, ISSN 0031-5850, S. 127–185, doi:10.3767/persoonia.2019.42.06 (ingentaconnect.com [abgerufen am 3. April 2020]).
- ↑ Maria P. Martín, Nils Högberg, Jaume Llistosella: Macowanites messapicoides, a hypogeous relative of Russula messapica. In: Mycological Research. Band 103, Nr. 2, Februar 1999, S. 203–208, doi:10.1017/S0953756298007035 (elsevier.com [abgerufen am 3. April 2020]).
- ↑ a b c Mauro Sarnari: Monografia illustrata del Genere Russula in Europa. Tomo primo. AMB, Centro Studi Micologici, Trento 1998, S. 1–800.
- ↑ Fabrizio Boccardo, Mido Traverso, Alfredo Vizzini, Mirca Zotti: Funghi d’Italia. 6. Auflage. Zanichelli, 2013, S. 1–623.
- ↑ Julius Schäffer: Russula-Monographie. In: Annales Mycologici. Band 32, 1934, S. 161 ff. (online [abgerufen am 8. Juli 2011]).
- ↑ Rolf Singer: Monographie der Gattung Russula. In: A. Pascher (Hrsg.): Beihefte zum Botanischen Centralblatt. 1932, S. 227 (online [abgerufen am 8. Juli 2011]).
- ↑ Russulas. (PDF) Micologia.biz Web de micología Europea, S. 19, abgerufen am 8. Juli 2011 (spanisch).
- ↑ a b Ludwig Beenken: Die Gattung Russula: Untersuchungen zu ihrer Systematik anhand von Ektomykorrhizen. Dissertation, LMU München: Fakultät für Biologie (2004) (PDF).
- ↑ Steven L. Miller et al.: Molecular phylogeny of the genus Russula in Europe with a comparison of modern infrageneric classifications (PDF) (Seite nicht mehr abrufbar, festgestellt im Mai 2019. Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Archivierte Kopie (Memento des vom 6. Juni 2011 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Singer „Monographie der Gattung Russula“; erschienen in „Beihefte zum Botanischen Centralblatt“, Herausgeber A. Pascher (1932) S. 205 ff
- ↑ a b Ursula Eberhardt: Molekulare Analysen zur Verwandtschaft der agaricoiden Russulaceen im Vergleich mit Mykorrhiza- und Fruchtkörpermerkmalen. Dissertation. Göttingen 2000, S. 15.
- ↑ Archivierte Kopie (Memento des vom 6. Juni 2011 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ U. Eberhardt: Molekulare Analysen zur Verwandtschaft der agaricoiden Russulaceen im Vergleich mit Mykorrhiza- und Fruchtkörpermerkmalen. S. 13 f.
- ↑ U. Eberhardt: Molekulare Analysen zur Verwandtschaft der agaricoiden Russulaceen im Vergleich mit Mykorrhiza- und Fruchtkörpermerkmalen. S. 14.
- ↑ U. Eberhardt: Molekulare Analysen zur Verwandtschaft der agaricoiden Russulaceen im Vergleich mit Mykorrhiza- und Fruchtkörpermerkmalen. S. 123, 127.
- ↑ U. Eberhardt: Molekulare Analysen zur Verwandtschaft der agaricoiden Russulaceen im Vergleich mit Mykorrhiza- und Fruchtkörpermerkmalen. S. 173 f.
- ↑ E. Michael et al.: Handbuch für Pilzfreunde. S. 86.
- ↑ Linda Gail Price: Milkcaps. California Academy of Sciences, vom 29. Oktober 2014
- ↑ University of Adelaide: Russula subnigricans.
- ↑ E. Michael et al.: Handbuch für Pilzfreunde. S. 87.
Weblinks
Auf dieser Seite verwendete Medien
Autor/Urheber: DiplomBastler alias Torge Anders, Lizenz: CC BY-SA 3.0
Bild zur Prüfung der Farbdarstellung (Gammakorrektur der Farbkanäle) des Anzeigegeräts ("Bildschirm"). Eine Beschreibung, wie man das Bild verwendet, ist Hilfe:Farbdarstellung. Eine Beschreibung der Wirkungsweise des Bildes findet sich hier. Es existiert auch eine vektorisierte Version des Bildes, die jedoch, wie *alle* Vektorformate, *nicht* zur Kalibrierung geeignet ist. Näheres dazu siehe Vorlage_Diskussion:Hinweis_Farbdarstellung#Vektorgrafik_kann_hier_nicht_funktionieren. Bitte daher diese Raster-Version hier nicht durch eine Vektor-Version ersetzen.
(c) James Lindsey at Ecology of Commanster, CC BY-SA 3.0
Russula emetica from Commanster, Belgium.
The determination of the species shown in this picture has been verified.Autor/Urheber: This image was created by user Drew Parker (mycotrope) at Mushroom Observer, a source for mycological images.
You can contact this user here., Lizenz: CC BY-SA 3.0
For more information about this, see the observation page at Mushroom Observer.
Autor/Urheber: This image was created by user Gerhard Koller (Gerhard) at Mushroom Observer, a source for mycological images.
You can contact this user here., Lizenz: CC BY-SA 3.0
For more information about this, see the observation page at Mushroom Observer.
Autor/Urheber: This image was created by user amadej trnkoczy (amadej) at Mushroom Observer, a source for mycological images.
You can contact this user here., Lizenz: CC BY-SA 3.0
For more information about this, see the observation page at Mushroom Observer.
(c) James Lindsey at Ecology of Commanster, CC BY-SA 3.0
Russula emetica and Gymnopus perforans from Commanster, Belgium.
The determination of the species shown in this picture has been verified.Cycloprop-2-ene carboxylic acid
(c) James Lindsey at Ecology of Commanster, CC BY-SA 3.0
Russula puellaris from Commanster, Belgium.
The determination of the species shown in this picture has been verified.Autor/Urheber: This image was created by user Copyright ©2009 clancy at Mushroom Observer, a source for mycological images.
You can contact this user here., Lizenz: CC BY-SA 3.0
Russula foetens Fr.
(c) James Lindsey at Ecology of Commanster, CC BY-SA 3.0
Russula aeruginea from Commanster, Belgium.
The determination of the species shown in this picture has been verified.