Rhenium(VII)-oxid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| _ Re7+ _ O2− | ||||||||||||||||
| Kristallsystem | orthorhombisch | |||||||||||||||
| Raumgruppe | P212121 (Nr. 19) | |||||||||||||||
| Gitterparameter | a = 1250 pm, b = 1520 pm und c = 540 pm[1] | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Rhenium(VII)-oxid | |||||||||||||||
| Andere Namen | Rheniumheptaoxid | |||||||||||||||
| Verhältnisformel | Re2O7 | |||||||||||||||
| Kurzbeschreibung | gelber, fast geruchloser Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 484,40 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | 6 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | 363 °C[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | −1128 kJ·mol−1 [4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Rhenium(VII)-oxid Re2O7 ist eine chemische Verbindung und zählt zu den Oxiden des Rheniums. Es ist ein gelber hygroskopischer Feststoff. Im Vergleich zum instabilen und explosiven Mangan(VII)-oxid ist Rhenium(VII)-oxid deutlich stabiler.
Gewinnung und Darstellung
Rhenium(VII)-oxid entsteht beim Erhitzen von Rhenium oder Rheniumverbindungen an der Luft.[3]
Eigenschaften
Physikalische Eigenschaften
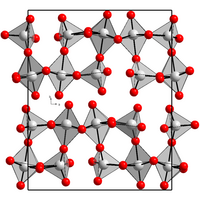
Rhenium(VII)-oxid kristallisiert in einer orthorhombischen Kristallstruktur mit der Raumgruppe P212121 (Raumgruppen-Nr. 19). Die Gitterkonstanten sind a = 1250 pm, b = 1520 pm und c = 540 pm. Im Kristall bildet Rhenium(VII)-oxid ReO4-Tetraeder und ReO6-Oktaeder, die sich einander abwechseln und über die Ecken verknüpft sind.[1]
Chemische Eigenschaften
Rhenium(VII)-oxid ist sehr hygroskopisch und löst sich gut in Wasser. Beim Lösen bildet sich die starke Säure Perrheniumsäure. Rhenium(VII)-oxid wird durch Wasserstoff bei 300 °C zu Rhenium(IV)-oxid reduziert.[3]
Verwendung
Rhenium(VII)-oxid ist ein Zwischenprodukt bei der Gewinnung von elementarem Rhenium. Es entsteht beim Rösten von rheniumhaltigen Manganerzen. Das Rhenium(VII)-oxid wird nach der Abtrennung vom übrigen Flugstaub in Wasser gelöst. Aus der dabei entstandenen Perrheniumsäure wird das Rhenium als Ammoniumperrhenat ausgefällt und mit Wasserstoff zum Element reduziert.
Rhenium(VII)-oxid kann als Katalysator in verschiedenen Reaktionen der organischen Chemie verwendet werden. So können mit Hilfe von Rhenium(VII)-oxid Alkane in Carbonsäuren überführt werden.[5] Weitere durch Rhenium(VII)-oxid katalysierte Reaktionen sind Metathese-Reaktionen von Olefinen.[6] Aus Rhenium(VII)-oxid kann der Katalysator Methyltrioxorhenium (MTO) gewonnen werden.[7]
Einzelnachweise
- ↑ a b B. Krebs, A. Müller und H. Beyer: The Crystal Structure of Rhenium(VII) Oxide. In: Inorg. Chem., 1969, 8, 3, S. 436–443.
- ↑ a b c d e f g Datenblatt Rhenium(VII)-oxid (PDF) bei Merck, abgerufen am 25. Dezember 2019.
- ↑ a b c Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1616.
- ↑ A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 2. Band: Nebengruppenelemente, Lanthanoide, Actinoide, Transactinoide. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049590-4, S. 1921 (Leseprobe: Teil C – Nebengruppenelemente. Google-Buchsuche).
- ↑ M. Kirillova et al.: Group 5–7 transition metal oxides as efficient catalysts for oxidative functionalization of alkanes under mild conditions. In: Journal of Catalysis, 2007, 248, S. 130–136.
- ↑ M. Onaka, T. Oikawa: Olefin Metathesis over Mesoporous Alumina-supported Rhenium Oxide Catalyst. In: Chemistry Letters 2002, 850-851.
- ↑ W. Herrmann et al.: Kostengünstige, effiziente und umweltfreundliche Synthese des vielseitigen Katalysators Methyltrioxorhenium (MTO). In: Angew. Chem., 2007, 119, S. 7440–7442.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1628–1629.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Autor/Urheber: Orci, Lizenz: CC BY-SA 3.0
Kristallstruktur von de:Rhenium(VII)-oxid




