Mikroorganismenkultur


Eine Mikroorganismenkultur entsteht durch die Kultivierung von Mikroorganismen. Dabei wachsen die Organismen durch Zellteilung in einem für sie geeigneten Kulturmedium unter kontrollierten Bedingungen, unter anderem eine bestimmte Temperatur und die Anwesenheit oder das Fehlen von Sauerstoff. Anhand einer Mikroorganismenkultur lässt sich der verwendete Organismustyp näher untersuchen. So kann beispielsweise eine Bakterienkultur aus einer Probe isoliert werden, um die darin enthaltenen Bakterien nachzuweisen. Dies kann sich auf Krankheitserreger beziehen, aber genauso auf Mikroorganismen, die z. B. natürlicherweise in einer Bodenprobe enthalten sind.
Mikroorganismenkulturen werden für viele Zwecke eingesetzt. Sie finden in biotechnologischen Produktionsverfahren Verwendung, um z. B. Enzyme oder Vitamine herzustellen; in der Pharmazeutischen Biotechnologie, um z. B. Antibiotika zu produzieren, oder in der Gentechnik, um gentechnisch veränderte Organismen mit spezifischen Eigenschaften zu erzeugen.
In der Mikrobiologie unterscheidet man verschiedene Kulturtechniken, von denen die Reinkultur, die Anreicherungskultur, die Flüssigkultur und die Kultur auf „festen“ Gel-Nährböden zu den wichtigsten zählen. Weiterhin gibt es den Bereich Zellkultur, dieser beschreibt Kulturen von eukaryotischen Zellen, also tierischen oder pflanzlichen Zellen.
Reinkultur
Ziel einer Reinkultur ist das Wachstum eines Klons von einem bestimmten Organismus unter Ausschluss jeglicher Individuen anderer Arten oder Stämme von Organismen. Eine Reinkultur wird auch als axenische Kultur bezeichnet. Die nicht erwünschten anderen Organismen bezeichnet man als Kontaminanten. Nur in Reinkultur können standardisierte Bedingungen aufrechterhalten und Mikroorganismen hinsichtlich ihrer metabolischen und physiologischen Eigenschaften untersucht werden.[1]
Co-Kultivierung
Viele Mikroorganismen gedeihen wegen gegenseitiger Abhängigkeiten nur vergesellschaftet mit anderen, etwa als Konsortien. Viren lassen sich nur zusammen mit ihren Wirten oder Wirtszellen kultivieren. Die gemeinsame Kultivierung mikrobieller Gemeinschaften bezeichnet man als Co-Kultivierung.[2] Es handelt sich dabei quasi um die mikrobielle Version der Mischkultur.
Anreicherungskultur
Eine Anreicherungskultur bietet Wachstumsbedingungen, die für einen bestimmten Mikroorganismus oder eine bestimmte physiologische Gruppe von Mikroorganismen günstiger sind als für andere Mikroorganismen, mit dem Ziel, diese selektiv anzureichern, während das Wachstum anderer Organismen langsamer ist oder gehemmt wird. Dies wird genutzt, um bestimmte Mikroorganismen zu deren Nachweis anzureichern oder um ihren Stoffwechsel für bestimmte Zwecke zu nutzen. So können zum Beispiel in Bodenproben gezielt anaerobe Mikroorganismen angereichert werden, indem man Kulturtechniken anwendet, die den Zutritt von Sauerstoff ausschließen. Listerien werden zu ihrem Nachweis bei 4 °C über vier bis acht Wochen in einer Nährbouillon angereichert (Kälteanreicherung) bevor das Material auf einem Nährboden ausgestrichen wird. In Belebtschlammbecken einer biologischen Kläranlage werden Bedingungen geschaffen, die das Wachstum bestimmter Mikroorganismen fördern und das anderer Arten unterdrücken um die Stoffumsetzungen der angereicherten Bakterien zu nutzen oder um die Struktur der Mikroorganismenkolonien (Belebtschlammflocken) in gewünschter Weise zu beeinflussen, beispielsweise durch Förderung von Zoogloea sp. Das Prinzip der Anreicherungskultur wurde durch Martinus Willem Beijerinck und Sergei Nikolajewitsch Winogradski unabhängig voneinander entwickelt.[1]
Flüssigkultur
Bei Flüssigkulturen werden Mikroorganismen in flüssigen Nährmedien kultiviert. Für eine wachstumsfördernde Belüftung (Versorgung mit Sauerstoff) werden die Kulturgefäße meist automatisch geschüttelt. Die verwendeten Gefäße, wie z. B. Erlenmeyerkolben, enthalten so genannte Schikanen, nach innen gerichtete Vorsprünge zur Förderung der Durchmischung.[3] Eine Flüssigkultur bietet den Vorteil, dass man davon größere Mengen herstellen kann, um diese beispielsweise bei biotechnologischen Produktionsverfahren in einem Bioreaktor zu verwenden. Aber auch geringe Mengen einer Flüssigkultur werden eingesetzt, meist in Reagenzgläsern – in der Mikrobiologie auch als Kulturröhrchen bezeichnet. Sie dienen zur Quantifizierung von Mikroorganismen nach der Methode der „Wahrscheinlichsten Anzahl“ („Most Probable Number“, siehe MPN-Verfahren)[1] oder zur Prüfung auf bestimmte Stoffwechselleistungen von Mikroorganismen zu deren Identifizierung im Rahmen einer „Bunten Reihe“.[4]
Kultur auf Gel-Nährböden
Ein Gel-Nährboden wird hergestellt, indem einem Kulturmedium eine gelierende („verfestigende“) Substanz zugegeben wird, die dem jeweiligen Organismus nicht als Nahrungsquelle dient. Das am häufigsten verwendete Geliermittel ist Agar (Agar-Agar), andere Verfestiger sind Gelatine, Gelrite und Kieselgel.
Die Organismen können auf der Oberfläche des Gels oder in seinem Inneren zum Wachstum und zur Vermehrung gebracht werden. Der Vorteil einer Kultur auf oder in Gel-Nährböden besteht darin, dass die meisten Mikroorganismen sich darauf bzw. darin nicht fortbewegen können, so dass sie auf oder in Gel-Nährböden Kolonien bilden. Das wird genutzt, um Reinkulturen herzustellen, um kleinere Mengen von Mikroorganismen für Untersuchungen zu gewinnen und um Mikroorganismen zu quantifizieren.[1]
Fraktionierter Verdünnungsausstrich

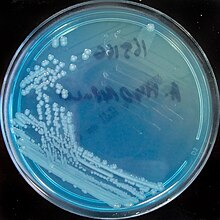
Der Fraktionierte Verdünnungsausstrich ist eine spezielle Technik, mikrobielle Proben auf den gelierten Nährboden aufzutragen, um einzeln stehende Kolonien zu erhalten, die für eine Identifizierung benötigt werden. Hierbei wird slalomartig mit der infizierten Impföse über die Oberfläche des Nährbodens gefahren, ohne sie zu verletzen und jeweils zweimal unterbrochen um die Impföse zu sterilisieren und eine neue Fraktion zu beginnen. Mit der Impföse wird dazu jeweils einmal das Ende der vorangegangenen Fraktion gekreuzt und weiter slalomartig eine neue Fraktion gebildet.
In der Abbildung kann man sowohl die Spur der Impföse noch erkennen, als auch den Effekt des Verdünnungsausstrichs: In der ersten Fraktion unten links ist noch alles von einer großen Kolonie überwuchert; dies allein ist für eine Identifizierung der meisten Mikroorganismen ungeeignet. In der zweiten Fraktion oben links sind bereits Einzelkolonien zu sehen, in der letzten Fraktion auf der rechten Seite sind es nur noch Einzelkolonien. Einzelkolonien entstehen aus einer einzigen Zelle oder aus wenigen gleichartigen Zellen, die sich dort von der Impföse gelöst haben.
Unter bestimmten Umständen, vor allem bei Verwendung spezieller Differentialnährböden, können Einzelkolonien aufgrund von Form, Oberfläche, Randbegrenzung und Farbe eine Identifizierung des Mikroorganismus ermöglichen. Escherichia coli erkennt man z. B. auf Endo-Agar an kugelrunden Einzelkolonien, die dunkelviolettrot sind und metallisch glänzen. Eine genaue Identifizierung ist allerdings nur durch weitere, zum Teil aufwändige Tests und in schwierigen Fällen durch besonders teure und zeitaufwändige DNA-Analysen möglich.
Durch Entnehmen einer Probe von einer Einzelkolonie und weitere Isolierung durch Ausstreichen auf einem Agarnährboden kann man eine Reinkultur eines Mikroorganismus gewinnen und diesen weiter vermehren. Wird dabei durch diese Prozedur von einem Individuum ausgegangen, handelt es sich bei der Reinkultur um einen Klon.
Prokaryotenkultur
In der Mikrobiologie spielt die Kultur von Prokaryoten eine bedeutende Rolle, also die Kultur von Bakterien (Bacteria) und Archaeen (Archaea). Die vorgestellten mikrobiologischen Kulturtechniken lassen sich auf beide Domänen, also Bakterien und Archaeen, anwenden, in der Praxis wird aber häufiger mit Bakterienkulturen gearbeitet, da viele Archaeen zu den Extremophilen gehören, also an extreme Biotope angepasst sind. In der Medizinischen Mikrobiologie ist die diagnostische Bakterienkultur von besonderer Bedeutung, um Krankheitserreger nachzuweisen, zu identifizieren und auf ihre Eigenschaften (beispielsweise Antibiotikaempfindlichkeit) zu untersuchen. Durch einen Surface-viable Count kann die Anzahl an koloniebildenden Einheiten in einer Probe bestimmt werden.
Kultur eukaryotischer Zellen
Unter einer Zellkultur versteht man die Kultivierung tierischer oder pflanzlicher Zellen – also Zellen von Eukaryoten – in einem Nährmedium außerhalb des Organismus.

Obwohl es sich auch um eukaryotische Zellen handelt, erfolgt die Kultivierung von Hefen und Schimmelpilzen anders als bei tierischen oder pflanzlichen Zellen. Sie gehören zu den Untersuchungsobjekten in der Mikrobiologie und ihre Kulturen ähneln denen der Bakterien, d. h. auch sie bilden Kolonien auf festen Nährmedien.[3]
Viruskultur
Viren benötigen eine geeignete Wirtszelle für ihre Vermehrung, somit lassen sie sich nur in einer Kultur der Wirtszellen vermehren. Für Viren verwendet man daher die passenden eukaryotischen Zellen, bei Bakteriophagen entsprechend die passenden Bakterienzellen.[3]
Siehe auch
- Nährmedium (Kulturmedium, Nährboden)
- Flüssige Nährmedien („Bouillon“)
- Feste Nährmedien
- Selektivmedium
- Differentialmedium
- Inokulation (Animpfen, Beimpfen von Nährmedien mit Bakterien u. a. Mikroorganismen)
- Inkubator (Brutschrank)
- Anaerobentechnik
- Bioreaktor (Fermenter)
Quellen
Literatur
- Susan Isaac, David Jennings: Kultur von Mikroorganismen. Spektrum Akad. Verlag, Heidelberg 1996, ISBN 3-8274-0049-X. Übersetzung der englischsprachigen Ausgabe mit dem Titel Microbial culture.
- Eckhard Bast: Mikrobiologische Methoden: Eine Einführung in grundlegende Arbeitstechniken. 2. Auflage. Spektrum Akademischer Verlag GmbH, Heidelberg/Berlin 2001, ISBN 978-3-8274-1072-6.
Einzelnachweise
- ↑ a b c d Eckhard Bast: Mikrobiologische Methoden: Eine Einführung in grundlegende Arbeitstechniken. 2. Auflage. Spektrum Akademischer Verlag GmbH, Heidelberg/Berlin 2001, ISBN 978-3-8274-1072-6.
- ↑ Rebecca D. Prescott, Tatyana Zamkovaya, Stuart P. Donachie, Diana E. Northup, Joseph J. Medley, Natalia Monsalve, Jimmy H. Saw, Alan W. Decho, Patrick S. G. Chain, Penelope J. Boston: Islands Within Islands: Bacterial Phylogenetic Structure and Consortia in Hawaiian Lava Caves and Fumaroles. In: Frontiers in Microbiology, Sektion: Extreme Microbiology. Forschungsthema: Microbial Roles in Caves, 21. Juli 2022; doi:10.3389/fmicb.2022.934708.
- ↑ a b c Hans G. Schlegel, Christiane Zaborosch: Allgemeine Mikrobiologie. 7. Auflage. Thieme Verlag, Stuttgart/New York 1992, ISBN 3-13-444607-3.
- ↑ Roland Süßmuth, Jürgen Eberspächer, Rainer Haag, Wolfgang Springer: Biochemisch-mikrobiologisches Praktikum. 1. Auflage. Thieme Verlag, Stuttgart/New York 1987, ISBN 3-13-685901-4.
Weblinks
Auf dieser Seite verwendete Medien
Autor/Urheber: de:Benutzer:Brudersohn, Lizenz: CC BY-SA 3.0
Kolonien auf Agargel-Nährboden
Autor/Urheber: Nathan Reading from Halesowen, UK, Lizenz: CC BY 2.0
Aeromonas hydrophila isolated from blood culture from a patient with severe diarrhoea
Autor/Urheber: Adrian J. Hunter, Lizenz: CC BY-SA 3.0
Four Aspergillus colonies grown at 37°C for three days on rich media. Clockwise from top-left: an Aspergillus nidulans laboratory strain; a similar strain with a mutation in the yA marker gene involved in green pigmentation; an Aspergillus oryzae strain used in soy fermentation; the Aspergillus oryzae strain that had its genome sequenced, RIB40. Background is black card. Originally scanned 20 Aug 2008.
Escherichia coli on Macconkey Agar Plate
An erlenmeyer containing a bacterial culture.