Alkali-Mangan-Zelle
Die Alkali-Mangan-Zelle, umgangssprachlich auch Alkali-Mangan-Batterie oder Alkaline, manchmal auch genauer als Zink-Manganoxid-Zelle bezeichnet, ist eine galvanische Zelle und zählt zu den wichtigsten elektrochemischen Energiespeichern. Sie zählt zu der Familie der Zink-Braunstein-Zellen und stellt eine Weiterentwicklung der Zink-Kohle-Zelle dar. Die wesentlichen Arbeiten zur Entwicklung der Alkali-Mangan-Zelle wurden Ende der 1950er Jahre bei Union Carbide von Karl Kordesch und anderen durchgeführt und 1960 patentiert.[1] Die Alkali-Mangan-Zelle hat in den Folgejahren aufgrund höherer Kapazität, höherer Sicherheit gegen Auslaufen, besserer Belastbarkeit und längerer Lagerbarkeit die Zink-Kohle-Zelle aus den meisten Anwendungen verdrängt.
Die Alkali-Mangan-Zelle wird zu den Primärelementen, das heißt den nicht-wiederaufladbaren Batterien gezählt, obwohl sie grundsätzlich begrenzt wiederaufladbar ist. Es gibt zur Wiederaufladung vorgesehene Versionen, sogenannte RAM-Zellen (Rechargeable Alkaline Manganese), die zu den Sekundärelementen (Akkumulatoren) gerechnet werden. Ist die Alkali-Mangan-Zelle in Form von Knopfzellen oder Rundzellen verbaut, so tragen diese dann die IEC-Bezeichnung LR.

Allgemeines

Die Alkali-Mangan-Zelle arbeitet mit Kalilauge, der wässrigen Lösung von Kaliumhydroxid, als alkalischem Elektrolyt. Die Kathode (positive Elektrode) liegt außen und ist ein innen mit Mangandioxid beschichteter Metallbecher; die in der Mitte der Zelle liegende Anode (negative Elektrode) besteht aus Zinkpulver.
Prinzipbedingt wird beim Entladen einer Batterie, gleichgültig ob Alkali-Mangan-Zelle oder Zink-Kohle-Zelle, die Anode chemisch zersetzt. Bei der Zink-Kohle-Zelle liegt die Anode (negativer Pol) außen und bildet in Form eines Zinkbechers das Zellengehäuse, das sich beim Entladen auflöst und leicht undicht werden kann; die Batterie läuft dann aus. Bei der Alkali-Mangan-Zelle ist die Anode im Inneren der Zelle angeordnet, und die Kathode (das Metallgehäuse der Batterie) bleibt beim Entladen unversehrt, was das Risiko des Auslaufens verringert.
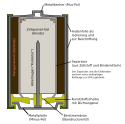
Die verschiedenen Bauformen haben eine Berstmembran als Vorkehrung gegen Zellenüberdruck, der bei elektrischem Kurzschluss oder Überhitzung auftreten kann. Im Inneren bildet gepresstes Mangandioxid (Braunstein), in der Schnittdarstellung als schwarzer Ring innerhalb des Mantels zu erkennen, die Kathode, die mit dem metallischen Zellgehäuse in elektrischem Kontakt steht. Das metallische Zellgehäuse ist nicht an der Zellreaktion beteiligt. Die Anode, zentrisch im Inneren angeordnet, besteht aus einer Paste aus Zinkpulver und Kaliumhydroxid, eingewickelt in ionendurchlässiges Filterpapier. In der Mitte ist ein Metallstift angeordnet, der den elektrischen Kontakt mit der Bodenplatte herstellt und den Minuspol bildet.
Bis in die 1990er Jahre wurden die Zinkelektroden von Alkali-Mangan-Zellen mit bis zu 2 % Quecksilber amalgamiert, um sie haltbar zu machen. Das Quecksilber war nicht direkt am chemischen Prozess der Batterie beteiligt, sondern diente als Schutz vor unerwünschter Korrosion des Zinks, die durch metallische Verunreinigungen wie Kupfer, Nickel, Eisen oder Kobalt in Verbindung mit dem alkalischen Elektrolyt Kaliumhydroxid ausgelöst wird. Durch eine höhere Reinheit der Zinkelektrode, Werte um 99,99 % reines Zink sind üblich, konnte die Zinkkorrosion vermieden und die Lagerbarkeit auch ohne Quecksilber erreicht werden.[2] So werden bei handelsüblichen Alkali-Mangan-Zellen die RoHS-Richtlinien erfüllt.
Die wichtigsten Bauformen der Alkali-Mangan-Zelle sind zylindrische Rundzellen (beispielsweise LR6 = Alkali-Mangan AA oder Mignon) und Knopfzellen (beispielsweise LR44). Mehrere Einzelzellen können auch zu Batterien kombiniert sein (beispielsweise 6LR61 = Alkali-Mangan-9-Volt-Block aus sechs Zellen). In Deutschland wurden 2004 rund 800 Millionen Alkali-Mangan-Rundzellen und rund 400 Millionen Alkali-Mangan-Knopfzellen in Verkehr gebracht.[3]
Elektrochemie

Wie bei der Zink-Kohle-Batterie liefern die Oxidation von Zink und die Reduktion von Mangandioxid die elektrische Energie. Die bei der Oxidation des Zinks freigesetzten Elektronen der Zelle wandern von der Anode, welche in diesem Fall einer Batterie die negative Elektrode ist, durch den äußeren Stromkreis unter Leistungsabgabe zur Kathode, welche in diesem Fall die positive Elektrode ist. Zum Ladungsausgleich wandern in der Zelle OH−-Ionen von der Kathode durch den Elektrolyten zur Anode.
Anodenreaktion
Bei der Entladung wird an der Anode metallisches Zink (Zn) oxidiert. Dabei werden zwei Elektronen abgegeben, die Oxidationszahl von Zink wird von ±0 auf +II erhöht. Das Reaktionsprodukt hängt von den Bedingungen ab, unter denen die Oxidation erfolgt. Zu Beginn der Entladung, das heißt bei hoher OH−-Konzentration, wird über verschiedene Zwischenstufen das gut im alkalischen Elektrolyten lösliche Tetrahydroxozinkat-Ion (Zn(OH)42−), kurz Zinkat, gebildet.
Wenn der Elektrolyt mit Zinkat übersättigt ist, beginnt Zinkoxid (ZnO) auszufallen.
Bei fortschreitender Entladung, das heißt bei niedrigerer OH−-Konzentration, wird dann Zinkhydroxid (Zn(OH)2) gebildet. Aus diesem entsteht unter Abgabe von Wasser langsam wieder Zinkoxid (ZnO).
Kathodenreaktion
Das als Kathodenmaterial verwendete Mangandioxid ist in der Regel ein Elektrolyt-Braunstein (γ-MnO2) mit hoher elektrochemischer Aktivität. Bei der Entladung wird in der Kathode Mangandioxid (MnO2) zunächst zu Manganoxidhydroxid (MnOOH) reduziert. Diese homogene Festphasenreaktion wird als erste Entladestufe bezeichnet.
Bei der Reaktion wird ein Elektron aufgenommen, die Oxidationszahl des Mangans wird von +IV auf +III verringert und ein Proton (H+) wird in das Kristallgitter des Mangandioxids eingebaut. Diese Reaktion ist ungewöhnlich, da das Produkt α-MnOOH (Groutit) die gleiche Kristallstruktur wie der Ausgangsstoff γ-MnO2 hat.
Unter bestimmten Bedingungen kann bei milden Entladungen in einer langsamen Reaktion Manganoxidhydroxid (MnOOH) noch weiter reduziert werden. Diese Reaktion wird als zweite Entladestufe bezeichnet.
Diese Reaktion ist eine heterogene Reaktion, die eigentliche Reduktion erfolgt in Lösung. Die Mn3+-Ionen gehen als Komplex [Mn(OH)4]− in Lösung und werden zu [Mn(OH)4]2− reduziert. Das eigentliche feste Produkt Mn(OH)2 fällt dann aus der gesättigten [Mn(OH)4]2−-Lösung aus.
Redox-Reaktion
Wird nur die erste Entladestufe berücksichtigt, ergibt sich für die Gesamtreaktion in der Alkali-Mangan-Zelle:
Wie aus der Gesamtreaktionsgleichung ersichtlich, wird bei der Entladung Wasser verbraucht, eine verbrauchte Alkali-Mangan-Zelle ist daher „trocken“.
Nebenreaktion
Zink ist in stark alkalischer Lösung thermodynamisch instabil. Wie aus der elektrochemischen Spannungsreihe ersichtlich, wird daher als Nebenreaktion in der Anode Zink (Zn) oxidiert und Wasser (H2O) zu gasförmigem Wasserstoff (H2) reduziert.
Diese als „Gasung“ bezeichnete Reaktion läuft bei der Lagerung von nicht entladenen und teilentladenen Zellen ab. Die Reaktionsgeschwindigkeit ist für hochreines Zink relativ gering. Bereits kleine Mengen von Verunreinigungen (beispielsweise Schwermetalle wie Eisen, Kupfer, Molybdän und Nickel) können die Gasung jedoch drastisch erhöhen.
Eigenschaften
Spannung
Die Nennspannung der Alkali-Mangan-Zelle beträgt 1,5 V. Durch Reihenschaltung mehrerer Zellen können höhere Spannungen erreicht werden. So können bei der Flachbatterie 3LR12 mit drei Zellen 4,5 V, bei der Flatpack 4LR61 mit vier Zellen 6 V und beim E-Block 6LR61 mit sechs Zellen 9 V erreicht werden.
Die tatsächliche Leerlaufspannung einer frischen Alkali-Mangan-Zelle liegt bei 20 °C im Bereich von 1,57 V bis 1,63 V. Sie hängt hauptsächlich von der Aktivität des verwendeten Mangandioxides und dem Zinkoxidgehalt in der Elektrolytlösung ab. Die (mittlere) Lastspannung hängt von der Belastung ab, sie beträgt bei Entladung mit 0,4 C typischerweise 1,15 V bis 1,18 V (NiMH: 1,22 V bis 1,25 V). Als Entladeschlussspannung wird meist 1,0 V verwendet.
Entladung
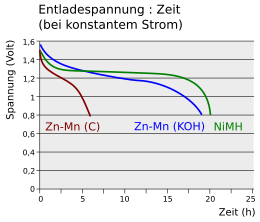
Das Diagramm vergleicht die Belastungskurven bei konstantem Strom einer Zink-Kohle-Zelle (Zn-Mn (C)) und eines NiMH-Akkus mit der einer Alkali-Mangan-Zelle (Zn-Mn (KOH)). Die Spannung der Zink-Kohle-Zelle fällt nach kurzer Zeit unter 0,8 V ab. Ein Akku hält die Spannung von 1,2 V über einen langen Zeitraum. Das Zeitverhalten einer Alkali-Mangan-Zelle liegt zwischen den beiden Kurven, die Spannung nimmt langsam mit der Zeit ab.
Batteriestandsanzeigen in Geräten messen die Änderung der Spannung mit der Zeit. Während sie bei Primärzellen recht zuverlässig funktionieren, versagen sie bei NiMH-Zellen. Hier ist die Spannung über einen langen Zeitraum nahezu konstant und fällt bei Erschöpfung des Akkus schnell ab.
Die Kapazität einer Alkali-Mangan-Zelle ist abhängig von der Belastung. Bei kleiner Last ≪ 0,1 C erreichen AA-Batterien typischerweise Werte von 3000 mAh, siehe linke Grafik. Die zweite Grafik zeigt den Verlauf der Kapazität bei einer Belastung von ca. 0,1 C. Die Batterie ist bereits bei 2/3 der Nennkapazität erschöpft. Im Gegensatz zum Verhalten bei kleiner Last regeneriert sie sich nach kurzer Zeit. Sie ist erneut in der Lage, eine Kapazität von ca. 10 % zur Verfügung zu stellen, siehe untere Kurve in der zweiten Grafik.
 |  |
Praxis: Alkali-Batterien in Hochleistungs-Verbrauchern scheinen nach kurzer Zeit leer zu sein. Nach einer Pause von mehreren Stunden können sie kurzzeitig wieder Leistung abgeben. Eine leicht erhöhte Temperatur beschleunigt diese Regeneration. Daher sprechen manche von einem „Aufladen“ von Batterien auf der Herdplatte oder an der Sonne. Anschließend sind diese Zellen jedoch nicht mehr in der Lage, ihre ursprüngliche Stromstärke zu liefern – zur Verwendung an einem Hochleistungs-Verbraucher sind sie zu erschöpft. Da sie noch eine Restkapazität von 30 % besitzen können, sollten sie nicht sofort entsorgt werden, falls man sie noch für Verbraucher mit geringem Leistungsbedarf nutzen kann. (Beispielsweise in Uhren oder Fernbedienungen.)
Auslaufen
Auch Alkali-Mangan-Zellen können auslaufen. Bei Alkali-Batterien ist die Anode, welche sich während der Entladung chemisch zersetzt, im Inneren der Zelle. Dadurch wird konstruktiv eine Zersetzung der metallischen Außenhülle, welche die Kathode darstellt, bei der Alkali-Batterie verhindert. Aber auch Alkali-Batterien können auslaufen, beispielsweise durch Überdruck im Inneren in Folge eines Kurzschlusses. Dadurch öffnet die Berstmembran im Bereich des negativen Anschlusses, und austretendes Kaliumhydroxid kann metallische Bestandteile wie Kontakte und Leiterbahnen korrodieren. Das Kaliumhydroxid reagiert mit dem Kohlenstoffdioxid (CO2) der Luft zu Kaliumcarbonat (K2CO3) und bildet weiße, kristalline, hygroskopische Ablagerungen.
Vergleich
Folgende Tabelle enthält einen Vergleich zwischen einer Alkali-Mangan- und einer Zink-Kohle-Zelle in der Bauform Mignon:
| Vergleich Baugröße Mignon | Alkali-Mangan | Zink-Kohle |
|---|---|---|
| Energiedichte | 350 Wh/dm³ | 150 Wh/dm³ |
| Kapazität AA-Zelle (Entladung bis 0,8 V) | 2,8 Ah | 1,2 Ah |
| Innenwiderstand | 0,15 Ω | 0,5 Ω |
| Selbstentladung pro Monat bei 20 °C | 0,3 % | 0,6 % |
| Restkapazität nach dreijähriger Lagerung | >90 % | <10 % |
| Minimale Betriebstemperatur | >−20 °C | −10 °C |
| Auslaufsicherheit | hoch | ausreichend bis schlecht |
| Kosten pro entnommener Ladung | 8…45 Cent/Ah | 17…80 Cent/Ah |
Zink-Kohle-Zellen haben eine wesentlich schlechtere Spannungslage als Alkali-Mangan-Zellen, d. h. die Spannung teilentladener Zellen fällt frühzeitig ab (siehe Entladung). Gleiches gilt für die Hochstrombelastbarkeit, wodurch sie für viele moderne Geräte, die kurzzeitig hohe Ströme entnehmen (Digitalkameras, Blitzgeräte, Alarmanlagen), nicht mehr verwendbar sind. Hohe Stromentnahme lässt selbst bei frischen Zink-Kohle-Zellen die Spannung in wenigen Sekunden zu tief fallen, um einen sicheren Betrieb der Geräte zu gewährleisten. Die Selbstentladung von Zink-Kohle-Batteriezellen ist ebenfalls deutlich höher als die von Alkali-Mangan-Zellen, was die Lagerfähigkeit stärker als bei einer Alkali-Mangan-Zelle begrenzt.
Auch in der Wirtschaftlichkeit und Ökobilanz sind die Zink-Kohle-Batterien im Nachteil, vor allem durch die schlechtere Nennkapazität bei gleicher Baugröße bei zusätzlich geringerer nutzbarer Kapazität durch die schlechtere Spannungslage. Dadurch werden für den gleichen Energieumsatz (Betriebsdauer eines Gerätes) deutlich mehr Zellen benötigt.
Darüber hinaus ist die Auslaufsicherheit häufig schlechter. Auslaufende Ammoniumchloridlösung verbrauchter Zellen zerstört die Metallkontakte und Leiterbahnen eines elektronischen Gerätes deutlich stärker als der alkalische Elektrolyt der Alkaline-Zellen.
Diese deutlichen Unterschiede haben dazu geführt, dass Alkali-Mangan-Zellen heute den Markt dominieren und die Zink-Kohle-Zellen verdrängt haben.
Wiederaufladen
Normale Alkali-Mangan-Batterien
Die meisten teilentladenen Alkali-Mangan-Batterien (Primärzellen) lassen sich mit geeigneten Ladegeräten (beispielsweise solchen für RAM-Zellen; dazu der nächste Abschnitt) drei- bis zehnmal auffrischen. Voraussetzung ist, dass die Batterie nicht zu tief entladen wird. Nicht geeignet zum Laden sind Ladegeräte für handelsübliche NiMH-Akkus, da die Ladeschlussspannung und das Ladeverfahren nicht passen.
RAM-Zellen

RAM-Zellen (englisch rechargeable alkali manganese) sind besondere, laut Anbieter etwa 50- bis 500-mal wiederaufladbare Alkali-Mangan-Zellen (Sekundärzellen).[4] Handelsübliche Ladegeräte für RAM-Zellen arbeiten mit konstantem Ladestrom, der jede Sekunde für wenige Millisekunden unterbrochen wird, um stromlos die Zellenspannung zu messen. Wenn diese 1,73 V überschreitet, wird der Ladestrom so lange abgeschaltet, bis die Zellenspannung 1,69 V wieder unterschritten hat. Die Konstantspannungsmethode ist ebenfalls sicher und geeignet, dafür aber langsamer. RAM-Zellen eignen sich nur für Niedrigstrom-Anwendungen wie z. B. Uhren oder Fernbedienungen. Für Hochstromanwendungen wie z. B. Digitalkameras, Akku-Werkzeuge oder als Antriebsbatterien in Modellfahrzeugen sind sie nicht geeignet und können dabei beschädigt werden.
RAM-Zellen dürfen, um ihre Wiederaufladefähigkeit nicht zu verlieren, nicht zu tief entladen werden. Werden RAM-Zellen bis zu einer Entladeschlussspannung je Zelle von nicht unter 1,42 V entladen, beträgt die erreichbare Zyklenanzahl einige 100. Bei einer Entladung bis zu 1,32 V reduziert sich die Zyklenanzahl auf einige 10. Bei einer weiteren Entladung können RAM-Zellen nicht mehr oder nur noch mit einer stark reduzierten Kapazität geladen werden.[5]
Wiederaufladbare RAM-Zellen sind mit Stand Oktober 2012 die einzigen Batterien/Akkus, die mit dem Umweltzeichen Blauer Engel ausgezeichnet wurden (Aufschrift: „weil wiederaufladbar und schadstoffarm“).[6]
Im Jahr 2011 erreichten Nickel-Zink-Akkumulatoren (1,6–1,65 Volt) nach 110 Jahren Entwicklung die Marktreife für den Consumer-Markt und verdrängten seitdem die RAM-Zellen.
Preis und Leistung
Handelsübliche Alkali-Mangan-Batterien werden mit großen Preisunterschieden angeboten. In einem Verbrauchertest ergab sich für eine Markenbatterie, die zum sechsfachen Preis einer preisgünstigen Batterie angeboten wurde, eine 25 % längere Gebrauchsdauer gegenüber dieser.[7]
Entsorgung
Alkali-Mangan-Batterien müssen in der EU im Rahmen der Altbatterierichtlinie (Richtlinie 2006/66/EG) entsprechend entsorgt werden.[8] Diese Richtlinie ist in verschiedenen Ländern unterschiedlich umgesetzt, beispielsweise in Deutschland in Form des Batteriegesetzes und in Österreich in Form der Batterienverordnung (BatterieVO).[9] Zur praktischen Umsetzung stellt der einschlägige Handel Sammelbehälter der Stiftung Gemeinsames Rücknahmesystem Batterien auf.
Literatur
- Lucien F. Trueb, Paul Rüetschi: Batterien und Akkumulatoren – Mobile Energiequellen für heute und morgen. Springer, Berlin 1998, ISBN 3-540-62997-1.
- David Linden, Thomas B. Reddy (Hrsg.): Handbook of Batteries. 3. Auflage. McGraw-Hill, New York 2002, ISBN 0-07-135978-8 (auf Englisch).
- Clive D.S. Tuck (Hrsg.): Modern Battery Technology. Ellis Horwood, New York 1991, ISBN 0-13-590266-5 (auf Englisch).
- Karl V. Kordesch (Hrsg.): Batteries Volume 1 Manganese Dioxide. Marcel Dekker, New York 1974, ISBN 0-8247-6084-0 (auf Englisch).
Weblinks
- Datenblätter einiger Batterien der Fa. Energizer (auf Englisch)
Einzelnachweise
- ↑ Patent US2960558: Dry cell. Angemeldet am 9. Oktober 1957, veröffentlicht am 15. November 1960, Anmelder: Union Carbide Corp, Erfinder: Kordesch Karl, Paul A. Marsal, Lewis F. Urry.
- ↑ Dennis W. McComsey: Handbook Of Batteries. Hrsg.: David Linden, Thomas B. Reddy. 3. Auflage. McGraw-Hill, 2002, ISBN 0-07-135978-8, Kapitel 8.: Zinc-Carbon Batteries – Leclanché and Zinc Chloride Cell Systems.
- ↑ Stiftung Gemeinsames Rücknahmesystem Batterien, Erfolgskontrolle 2004.
- ↑ AccuCell by Müller-Germany: Aufbau, Vergleich, Vorteile RAM-Zellen (PDF; 315 kB); aufgerufen am 8. August 2012
- ↑ David Linden, Thomas Reddy (Hrsg.): Handbook of Batteries. 3. Auflage. McGraw Hill, 2002, ISBN 0-07-135978-8, Kapitel 36: Rechargeable zinc/alkaline/manganese dioxide batteries.
- ↑ Umweltbundesamt (Hrsg.): Ratgeber Batterien und Akkus (PDF; 3,7 MB). Dessau, Oktober 2012, S. 23.
- ↑ Aldi gegen Lidl – Das Duell. ZDF-Dokumentation, Erstausstrahlung am 2. April 2013, 45 Min.
- ↑ Richtlinie 2006/66/EG des Europäischen Parlaments und des Rates vom 6. September 2006 über Batterien und Akkumulatoren sowie Altbatterien und Altakkumulatoren, abgerufen am 23. September 2017.
- ↑ BatterienVO. Archiviert vom (nicht mehr online verfügbar) am 24. September 2017; abgerufen am 23. September 2017.
Auf dieser Seite verwendete Medien
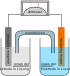
Autor/Urheber: Henry Mühlpfordt / *File:Galvanic Cell.svg: Gringer, Lizenz: CC BY-SA 3.0
Galvanische Zelle
Autor/Urheber:
- Nimhcharakteristikrp.png: Original uploader was Anton at de.wikipedia
- derivative work: Chris828 (talk)
Spannungs/Zeit-Entladekurven einiger Batterien
Urheber der Zeichnung: Anton (rp) 2004
Nutzungsrechte freigegeben: GNU Free Documentation License.
© Túrelio (via Wikimedia-Commons), 2009, CC BY-SA 3.0 de
Auskristallisierter Elektrolyt auf einer ausgelaufenen Alkali-Mangan-Batterie
Autor/Urheber: Der ursprünglich hochladende Benutzer war Anton in der Wikipedia auf Deutsch, Lizenz: CC BY-SA 3.0
Zn-Mn-Alkali Batterie
Urheber des Photos: MiBU (rp) 2004
Nutzungsrechte freigegeben: GNU Free Documentation License.
Aufbau (Schnittbild) einer Alkali-Mangan-Batterie.
Autor/Urheber: Dantor (talk) 11:40, 21 October 2012 (UTC), Lizenz: CC BY-SA 3.0
AA Alkaline battery. Voltage as a function of capacity when delivered power was around 300 mW. After regeneration of few hours the battery delivers power again, around 10% of first run (lower curve).
Compare with file:Aa-alkaline-100 c-v.png
Own measurements.Autor/Urheber: Dantor (talk) 11:40, 21 October 2012 (UTC), Lizenz: CC BY-SA 3.0
AA Alkaline battery. Voltage as a function of capacity when delivered power was around 100 mW.
Compare with file:Aa-alkaline c-v.png
Own measurements.Rechergrable alkaline Manganese (RAM) battery.
Autor/Urheber: Aney, Lizenz: CC BY-SA 3.0
A selection of alkaline batteries in various form factors