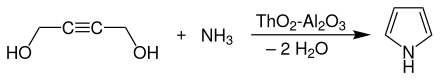Pyrrol
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Pyrrol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H5N | |||||||||||||||
| Kurzbeschreibung | farblose, brennend schmeckende Flüssigkeit mit chloroformähnlichem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 67,09 g·mol−1 | |||||||||||||||
| Aggregatzustand | flüssig | |||||||||||||||
| Dichte | 0,97 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | 131 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| pKS-Wert | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex | 1,5085[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | 63,1 kJ/mol[6] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Pyrrol (systematischer Name nach IUPAC: Azol) ist eine organische Verbindung aus der Stoffgruppe der Heteroaromaten und zugleich die Stammverbindung der Pyrrole (Azole). Pyrrole sind bedeutende Bestandteile vieler Naturstoffe wie beispielsweise die Porphyrine, darunter Porphin, Häm und Chlorophyll, das Vitamin B12 und deren Abbauprodukte, die Gallenfarbstoffe (Bilirubin, Urobilin).
Geschichte
Pyrrol wurde erstmals 1834 von Friedlieb Ferdinand Runge im Steinkohlenteer, in dem es in einer Konzentration von unter 0,01 % vorkommt, gefunden und isoliert.[7][8] 1858 wurde es von Thomas Anderson im Knochenöl bei der trockenen Destillation tierischer Materialien erhalten.[9] 1880 wurde es von Hugo Weidel und Giacomo Luigi Ciamician schließlich auch im Knochenteer nachgewiesen.[10] Der Ursprung des Namens kommt aus dem Griechischen (pyrros = feuerrot), welcher auf die sehr unspezifische Nachweisreaktion, die Rotfärbung eines mit Salzsäure befeuchteten Fichtenholzes, zurückzuführen ist.[5]
Gewinnung und Darstellung
Die industrielle Herstellung von Pyrrol erfolgt vorwiegend aus Furan durch Umsetzung mit Ammoniak bei Temperaturen zwischen 300 und 400 °C an Zeolithen (Alumosilikate) als Katalysatoren:[5][11]
Ebenfalls technisch angewandt wird die katalytische Dehydrierung von Pyrrolidin bei Temperaturen zwischen 200 und 300 °C an geträgerten Palladiumkatalysatoren:[5][12]
Die Umsetzung kann drucklos oder unter Druck sowie diskontinuierlich oder bevorzugt kontinuierlich durchgeführt werden. Als Reaktoren werden Festbett- oder Wirbelschichtreaktoren eingesetzt.[12]
Weiterhin kann es aus einer 50%igen wässrigen Lösung 2-Butin-1,4-diol durch Umsetzung mit Ammoniak an einem Thoriumoxid-Aluminiumoxid-Katalysator gewonnen werden:[5][13]
Substituierte Pyrrole gewinnt man über die Knorrsche Pyrrolsynthese oder über die Paal-Knorr-Synthese aus substituierten 1,4-Diketonen, die z. B. durch oxidative Dimerisierung von β-Ketoestern mit Iod erzeugt werden.
Eigenschaften
Physikalische Eigenschaften
Pyrrol hat eine relative Gasdichte von 2,31 (Dichteverhältnis zu trockener Luft bei gleicher Temperatur und gleichem Druck) und eine relative Dichte des Dampf-Luft-Gemisches von 1,01 (Dichteverhältnis zu trockener Luft bei 20 °C und Normaldruck). Der Dampfdruck bei 20 °C beträgt 8,7 hPa.[2] Die dynamische Viskosität beträgt 1,31 mPa·s bei 20 °C.[5]
Chemische Eigenschaften


In reinem, frisch destilliertem Zustand ist Pyrrol eine farblose Flüssigkeit von chloroformähnlichem Geruch, die sich an der Luft mit der Zeit braun verfärbt und zur Harzbildung neigt.[5] Pyrrol ist eine hygroskopische Verbindung, die löslich in Wasser (60 g/l bei 20 °C) ist und sich mit den meisten organischen Lösungsmitteln mischt.[5][2] Die Flüssigkeit ist luft- und lichtempflindlich, jedoch nur mittel bis schwer flüchtig.[2] Pyrrol reagiert heftig mit Säuren, starken Oxidationsmitteln sowie 2-Nitrobenzaldehyd.[2] Eine wässrige Lösung der Konzentration 10 g/l weist bei einer Temperatur von 20 °C einen pH-Wert von >6 auf.[2]
Pyrrol ist nach der Hückel-Regel mit sechs π-Elektronen ein Aromat, da sich das freie Elektronenpaar des Stickstoffs an der Ausbildung des aromatischen π-Elektronensextetts beteiligt. Die Aromatizität kann durch mesomere Grenzstrukturen verdeutlicht werden.[14]
Aufgrund der Delokalisierung des freien Elektronenpaares des Stickstoff ist Pyrrol im Vergleich zu den übrigen Aminen nur sehr schwach basisch, weil das freie Elektronenpaar weniger gut für die Aufnahme eines Protons zur Verfügung steht. Zudem wird durch die Protonierung die Aromatizität aufgehoben, was thermodynamisch sehr ungünstig ist.[14]
Eine Protonierung findet nicht – wie fälschlicherweise oft angenommen – am Stickstoff-Atom statt, da das entstehende Pyrrolium-Kation nicht durch Mesomerie stabilisiert werden kann.[15]
Dagegen findet die Protonierung des Pyrrols am C2-Atom statt, wodurch sich ein mesomeriestabilisiertes Pyrrolium-Kation ergibt, in dem die positive Ladung über den Stickstoff und zwei Kohlenstoffatome verteilt.[15]
Das Pyrrolium-Kation, welches die konjugierte Säure des Pyrrols darstellt, ist mit einem pKS-Wert von 0,4 eine starke Säure.[3]
Die NH-Gruppe kann hingegen ohne Verlust der Aromatizität deprotoniert werden. Beispielsweise reagiert Pyrrol mit metallischem Kalium unter Wasserstoffentwicklung zu Pyrrolkalium (Kaliumpyrrolid):[8]
Hierbei bildet sich dann das mesomeriestabilisierte Pyrrolid-Anion:
Verwendung
Pyrrol wird vor allem zur Herstellung von Pharmazeutika und Farbstoffen verwendet.[1] Ein Beispiel ist die Herstellung des antirheumatisch wirkenden Tolmetin.[8] Die elektrochemische Polymerisation von Pyrrol ergibt das elektrisch leitfähige Polypyrrol. In der organischen Chemie ist Pyrrol eine sehr vielseitig einsetzbare Verbindung. Elektrophile aromatische Substitutionen wie Friedel-Crafts-Reaktion, Formylierung, Sulfonierung oder Nitrierung ergeben in 2- bzw. 5-Position substituierte Pyrrole. Schließlich eignet sich Pyrrol als Ligand in Metallkomplexen und Organometallverbindungen.[1]
Sicherheitshinweise
Die Dämpfe von Pyrrol können mit Luft beim Erhitzen des Stoffes über den Flammpunkt explosive Gemische bilden. Die entzündbare Flüssigkeit ist feuchtigkeits-, luft- und lichtempfindlich. Pyrrol weist eine untere Explosionsgrenze (UEG) von ca. 3,10 Vol.-% und eine obere Explosionsgrenze (OEG) von ca. 14,8 Vol.-% auf. Die Zündtemperatur beträgt 550 °C. Der Stoff fällt somit in die Temperaturklasse T1. Mit einem Flammpunkt von 39 °C gilt Pyrrol als entflammbar.[2]
Weblinks
Einzelnachweise
- ↑ a b c d e Eintrag zu Pyrrol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. Juni 2023.
- ↑ a b c d e f g h i j k l m Eintrag zu Pyrrol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- ↑ a b Tim Soderberg: Acid-base properties of nitrogen-containing functional groups. In: LibreTexts Chemistry. Abgerufen am 8. Juni 2023.
- ↑ Frederick G. Bordwell, George E. Drucker, Herbert E. Fried: Acidities of carbon and nitrogen acids: the aromaticity of the cyclopentadienyl anion. In: Journal of Organic Chemistry. Band 46, 1981, S. 632–635, doi:10.1021/jo00316a032.
- ↑ a b c d e f g h Albrecht Ludwig Harreus: Pyrrole. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, 15. Juni 2000, doi:10.1002/14356007.a22_453.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- ↑ F. F. Runge: Ueber einige merkwürdige Producte der Steinkohlendestillation (Kyanol, Pyrrol, Leukol, Karbolsäure, Rosolsäure und Brunolsäure). In: Chemisches Zentralblatt. Band 5, 1834, S. 129–136 (Link).
- ↑ a b c Heinz-Gerhard Franck, Jürgen Walter Stadelhofer: Industrielle Aromatenchemie: Rohstoffe · Verfahren · Produkte. Springer-Verlag, Berlin Heidelberg 1987, ISBN 978-3-662-07876-1, S. 403–404.
- ↑ Thomas Anderson: Ueber die Producte der trockenen Destillation thierischer Materien. In: Justus Liebigs Annalen der Chemie. Band 105, 1858, S. 335–359, doi:10.1002/jlac.18581050311.
- ↑ Hugo Weidel, Giacomo Luigi Ciamician: Studien über Verbindungen aus dem animalischen Theer. In: Berichte der deutschen chemischen Gesellschaft. Band 13, 1880, S. 65–85, doi:10.1002/cber.18800130120.
- ↑ Hatada Kou, Shimada Masatoshi, Fujita Katsuhiro, Ono Yoshio, Keii Tominaga: RING TRANSFORMATIONS OF OXYGEN CONTAINING HETEROCYCLES INTO NITROGEN CONTAINING HETEROCYCLES OVER SYNTHETIC ZEOLITES. In: Chemistry Letters. Band 3, 1974, S. 439–442, doi:10.1246/cl.1974.439.
- ↑ a b Patent EP0067360A2: Verfahren zur Herstellung von Pyrrolen. Veröffentlicht am 1. Juni 1982, Anmelder: BASF AG, Erfinder: Norbert Goetz, Leopold Hupfer, Wolfgang Franzischka.
- ↑ Walter Reppe und Mitarbeiter: Äthinylierung V. In: Justus Liebigs Annalen der Chemie. Band 596, 1955, S. 80–158, doi:10.1002/jlac.19555960108.
- ↑ a b Michael B. Smith, Jerry March: March’s Advanced Organic Chemistry: Reactions, Mechanisms, and Structure. 6. Auflage. John Wiley & Sons, Hoboken, New Jersey 2007, ISBN 978-0-471-72091-1, S. 62.
- ↑ a b Kuo Zeng, Ze-Xing Cao: Protonation of Pyrrole and Furan by H3O+ and NH4+ in the Gas Phase: A Density Functional Theory Study. In: Chinese Journal of Chemistry. Band 24, 2006, S. 293–298, doi:10.1002/cjoc.200690056.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Deprotonierung von Pyrrol
Ball-and-stick model of the pyrrole molecule, C4H5N.
Structural information (determined by microwave spectroscopy) from CRC Handbook, 88th edition.
Image generated in Accelrys DS Visualizer.Industrielle Synthese von Pyrrol durch katalytischen Dehydrierung von Pyrrolidin
Die Protonierung von Pyrrol am Stickstoff-Atom findet nicht statt, da das entstehende Pyrrolium-Ion nicht stabilisiert werden kann
Industrielle Synthese von Pyrrol aus 2-Butin-1,4-diol
Resonanzstrukturen von Pyrrol
Mesomere Grenzstrukturen des Pyrrolid-Anions, welches durch Deprotonierung von Pyrrol gebildet wird
Industrielle Synthese von Pyrrol aus Furan mit Zeolithkatalysatoren
Struktur von Pyrrol
Die Protonierung von Pyrrol am C2-Kohlenstoff führt zu drei Resonanzstrukturen zur Stabilisierung der positiven Ladung
Skeletal formula of the pyrrole molecule, a five-membered aromatic heterocycle with four carbons to one nitrogen. The numbering convention for derivatives is shown.