Schuppenflechte
| Klassifikation nach ICD-10 | |
|---|---|
| L40 | Psoriasis |
| L40.0 | Psoriasis vulgaris |
| L40.1 | Generalisierte Psoriasis pustulosa |
| L40.2 | Akrodermatitis continua suppurativa |
| L40.3 | Psoriasis pustulosa palmoplantaris |
| L40.4 | Psoriasis guttata |
| L40.8 | Sonstige Psoriasis |
| L40.9 | Psoriasis, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
| Klassifikation nach ICD-11 | |
|---|---|
| EA90 | Psoriasis |
| EA90.0 | Plaque-Psoriasis |
| EA90.1 | Psoriasis guttata |
| EA90.2 | Instabile Psoriasis |
| EA90.3 | Erythrodermische Psoriasis |
| EA90.4 | Psoriasis pustulosa |
| EA90.40 | Generalisierte Psoriasis pustulosa |
| EA90.41 | Hallopeau-Akrodermatitis |
| EA90.42 | Pustulosis palmoplantaris |
| EA90.5 | Psoriasis näher bezeichneter Lokalisation oder Verbreitung |
| EA90.50 | Psoriasis der Kopfhaut |
| EA90.51 | Psoriasis der Nägel |
| EA90.52 | Psoriasis flexurarum und intertriginöse Psoriasis |
| EA90.53 | Anogenitale Psoriasis |
| EA90.Y | Sonstige näher bezeichnete Arten der Psoriasis |
| EA90.Z | Psoriasis nicht näher bezeichneter Art |
| ICD-11: Englisch • Deutsch (Entwurf) | |
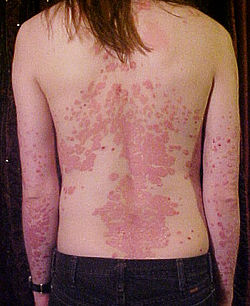

Schuppenflechte oder Psoriasis (altgriechisch ψωρίασις; im Altertum gleichgesetzt mit der ψώραpsóra „Krätze“) ist eine nicht-ansteckende chronische Autoimmunkrankheit, die sich vor allem als entzündliche Hautkrankheit (Dermatose) manifestiert, darüber hinaus als eine nicht selten auch andere Organe betreffende Systemerkrankung, die vor allem die Gelenke und zugehörigen Bänder und angrenzenden Weichteile (siehe Psoriasisarthritis), die Augen (siehe Uveitis), das Gefäßsystem, das Herz sowie die Genitalien betrifft. Darüber hinaus kann sie mit Diabetes mellitus und Schlaganfällen einhergehen;[1] sie zeigt sich im Wesentlichen durch stark schuppende Hautstellen, häufig z. B. an Knien, Ellenbogen und an der Kopfhaut, oft mit starkem Juckreiz sowie Veränderungen an den Nägeln. Die WHO hat sie zur schwerwiegenden, nichtübertragbaren Erkrankung erklärt.
Weltweit leiden über 100 Millionen, in Deutschland etwa zwei Millionen Menschen unter der Krankheit (2013); sie tritt in jedem Lebensalter auf, überwiegend jedoch im zweiten bis dritten Lebensjahrzehnt (Typ I), seltener ab dem fünften Lebensjahrzehnt (Typ II).[2] Die Ursache (Ätiologie) ist vermutlich multifaktoriell (erbliche Disposition, Autoimmunreaktion) und noch nicht abschließend geklärt.
Im Jahre 2004 wurde der 29. Oktober von der International Federation of Psoriasis Associations erstmals als Welt-Psoriasistag ausgerufen.
Geschichte
Eine schuppende Hautkrankheit, bei der es sich wahrscheinlich um Psoriasis handelte, wurde bereits vom griechischen Arzt Hippokrates (ca. 460–370 v. Chr.) beschrieben. Der Ausdruck Psoriasis wurde zum ersten Mal vom Arzt Galenus verwendet, der damit eine Schuppenbildung im Augen- und Hodensackbereich umschrieb. Bei dieser handelte es sich jedoch dem heutigen Forschungsstand nach vermutlich um Ekzeme.
Lange Zeit wurde Psoriasis nicht von der durch Milben verursachten Krätze (Scabies) unterschieden. Vermutlich wurde Psoriasis auch häufig mit Lepra verwechselt; es wird angenommen, dass viele „Aussätzige“ nicht unter Lepra, sondern unter Schuppenflechte und anderen Dermatosen litten. So wird bereits im Alten Testament die „Weiße Lepra“ erwähnt, bei der es sich mutmaßlich um Psoriasis handelte, und daran Erkrankte wurden dort (wie bei Lepra) und bis ins Mittelalter hinein aus der Gemeinschaft ausgeschlossen. Im ausgehenden 16. Jahrhundert wurde die Psoriasis, deren Symptome mit denen von Syphilis und Gonorrhoe verwechselt wurden, auch als Geschlechtskrankheit angesehen.[3]
Im Jahre 1897 wurde Diabetes als erste Komorbidität der Schuppenflechte jenseits der Haut beschrieben.[4]
Epidemiologie
Die Prävalenz der Erkrankung wird in der Literatur je nach Schätzungswert unterschiedlich angegeben, sie liegt in den verschiedenen Ländern zwischen 0,91 und 8,50 %[5] bzw. 0,09–11,43 %[6], weltweit etwa bei zwei bis drei Prozent. Damit betrifft sie mindestens 100 Millionen Personen. Für Deutschland wird diese auf etwa zwei Prozent abgeschätzt. Die für die Berechnung zugrunde liegenden Studien sind methodisch sehr unterschiedlich, was die Vergleichbarkeit herabsetzt und die Schwankungen der Prävalenzraten erklärt – so gibt es erhebliche Unterschiede bei der Definition der Prävalenz, der Falldefinition von Schuppenflechte, der untersuchten Altersstufen der Bevölkerung und der Erhebungsmethode.[6]
In der Altersgruppe von 50–69 Jahren tritt die Erkrankung am häufigsten auf. Andere Studien legen nahe, dass es zwei Altersgipfel bei 16 - 22 und bei 57 - 60 Jahren gibt (bimodale Verteilung).[6] Sie befällt Männer und Frauen gleichermaßen und unabhängig der ethnischen Zugehörigkeit.
Bei Kindern und Jugendlichen wird die Prävalenz mit bis zu 2,1 % angegeben.[5] Aufgrund der begrenzten Datenlage sind genauere Angaben zur Inzidenz oder Prävalenz nicht möglich. Nach Auswertung der Daten etwa 1,3 Millionen Versicherter in Deutschland kann bei unter 18-Jährigen diese auf etwa 0,4 % abgeschätzt werden.
Erscheinungsbild

Manifestation auf der Haut
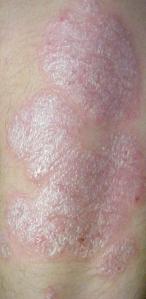

Die Betroffenen haben typischerweise gleichartige, rötliche, meist rundliche, inselförmige, scharf begrenzte und leicht erhabene Herde. Diese Effloreszenzen finden sich bevorzugt an Kopfhaut, Ellbogen, Kniescheiben, um den Bauchnabel, über dem Steißbein und den Fingerknöcheln sowie unter den Ohrläppchen. Allgemein werden vor allem Hautpartien befallen, die oft gedehnt werden (wie über den genannten Gelenken, aber auch z. B. im Wadenbereich) oder sonst mechanisch gestresst werden (z. B. unter dem Gürtel).
Eher uncharakteristisch, weil nicht schuppend, sondern lediglich mit geröteten Hautflecken, tritt Psoriasis auch bei Männern wie bei Frauen im Genitalbereich auf.[7]
Die Oberhaut (Epidermis) eines gesunden Menschen erneuert sich innerhalb von 26 bis 27 Tagen. In dieser Zeit werden neue Hautzellen gebildet und die gealterten (verhornten) Hautzellen (Keratinozyten) vom Körper nahezu unsichtbar abgestoßen. Bei der gesunden Haut dienen die Keratinozyten dem mechanischen, mikrobiellen und chemischen Schutz der Haut. Der Transkriptionsfaktor STAT3 wird normalerweise nur nach Hautdefekt aktiviert und löst dann über eine Vermehrung der Keratinozyten und eine Aktivierung der kutanen T-Zellen den Reparaturvorgang aus.
Bei der Psoriasis dagegen erfolgt die Verhornung an den befallenen Stellen sowohl beschleunigt – die Hautschicht erneuert sich vorzeitig innerhalb von nur drei bis sieben Tagen – als auch vermehrt (hyperkeratotisch) und unter Verlust des Stratum granulosum nach Aufbau und Funktion gestört (parakeratotisch). Gründe sind die erhöhte DNA-Synthese und die gesteigerte mitotische Aktivität der Basalzellen der Epidermis. Es kommt auch ohne Hautdefekt zur Aktivierung des STAT3 und damit fortlaufend zu unangepassten Umbauvorgängen in der Epidermis.[8]
Die gealterten Hautzellen bilden bei der Psoriasis aufgrund der beschleunigten Erneuerung silbrig glänzende grob-lamellöse Schuppen, die eine talgartige Konsistenz haben, welche an Kerzenwachs erinnert (Kerzenwachsphänomen). Das darunter liegende Gewebe, die unterste Zellschicht der Oberhaut, die Grenze zur Lederhaut (Dermis), ist auf Grund des vermehrten Wachstums stark durchblutet und erscheint daher unter den leicht entfernbaren Schuppen als kräftige Rötung. Es lösen sich leicht auch noch tiefere Zelllagen (Phänomen des letzten Häutchens). Kann dieses dünne Häutchen abgelöst werden, gilt dies fast immer als sicheres Zeichen von Schuppenflechte. Nach der Entfernung kommt es zu einer punktförmigen Blutung (Phänomen des blutigen Taus, Auspitz-Phänomen).
Ebenfalls typisch ist die Infiltration von Neutrophilen, was zu Mikroabszessen („Munro-Abszess“) unter der Hornschicht führt.
- Psoriasis vulgaris
- Typ I (60–70 % der Fälle)
- Manifestiert sich vor dem vierzigsten Lebensjahr, weist eine familiäre Häufigkeit auf und ist in seinem Verlauf schwerwiegender einzuordnen als Typ II. Zu 95 % ist diese Form mit dem Histokompatibilitätsantigen HLA-Cw 6 und HLA-Dr 7 sowie mit HLA-B 17 und HLA-B 57 gekoppelt. Alle Gene liegen auf dem kurzen Arm von Chromosom 6.

- Typische Erstmanifestation der Psoriasis vulgaris ist die Psoriasis guttata, die häufig nach Kontakt mit Triggerfaktoren wie Medikamenten (β-Blocker, Lithium, Antimalariamittel etc.) oder einer Streptokokkeninfektion auftritt. Sie kann jedoch wieder abklingen oder in eine Vulgaris übergehen. Lokalisationsstellen der Psoriasis vulgaris sind die Kopfhaut (Psoriasis capilitii), die intertriginösen Räume, die Beugenflächen (psoriasis inversa), die Handinnenflächen und Fußsohlen (psoriasis palmarum et plantarum), die genitale sowie die anale Lokalisation (bei der eine Rhagade in der Analkerbe als typisches Zeichen gilt).
- Typ II (30–40 % der Fälle)

- Spätmanifestation häufig erst nach dem vierzigsten Lebensjahr. Er geht meist mit Nagelpsoriasis oder Gelenkbeschwerden (Psoriasisartrithis) einher. Die HLA-Koppelung ist nur gering, und es gibt keine familiäre Häufung. Es handelt sich überwiegend um leichtere Verläufe.
- Typ Zumbusch (0,5–2,5 % der Fälle)
- Hautbefall mit Pustelbildung und einer erhöhten Koppelung mit HLA-B27, vor allem ab dem 50. Lebensjahr zu beobachten, selten früher.
- Die Ursachen für diese meist generalisiert auftretende Psoriasis-Form sind noch weitestgehend ungeklärt. Man geht davon aus, dass ungewöhnlich große Mengen des neutrophilen-chemotaktischen Interleukin-8 einströmen, wodurch sich die massenhafte Einwanderung neutrophiler Granulozyten in das Stratum corneum erklären ließe. Das Einströmen führt zu sterilen Pusteln. Eine wesentliche Bedeutung kommt neben dem IL-8 dem Tumornekrosefaktor-α (TNF) zu, der zu kutanen Entzündungsreaktionen und der systemischen Symptomatik führt.
- Der klinische Verlauf kennzeichnet sich durch einen akuten Fieberschub. Innerhalb weniger Stunden entwickeln sich zunächst an den Berührstellen der Haut (z. B. unter der Brust) und später generalisiert flächige Erytheme mit Pusteln, die in schweren Fällen konfluieren können.
- Innerhalb von 24 Stunden steigt die Zahl der Leukozyten, der Calciumgehalt sinkt, ebenso der Gehalt an Albumin im Blutplasma. Im weiteren Verlauf kommt es immer wieder zu neuen Fieberschüben und generalisierten Pusteln.
- Psoriasis pustulosa generalisata
- Diese spezielle Form der Psoriasis kann ohne Therapie einschließlich innerlicher Anwendungen (s. u.) tödlich verlaufen und wird auch durch kosmetische Produkte ausgelöst (s. u.).
- Psoriasis pustulosa palmaris et plantaris
- Typ Barber
- Bei gutem Allgemeinbefinden befinden sich die Pusteln nur an Händen und Füßen.
- Akrodermatitis continua suppurativa
- Typ Hallopeau
- Die Pustelbildung befindet sich an den Akren (das sind: Finger, Zehen, Hände, Füße, Nase, Kinn, Augenbrauen- und Jochbögen), besonders an den Fingern. Nagel- und Haarverlust sind möglich.
Genitalien, After
Hier sind in betreffenden Fällen vor allem die Leisten betroffen sowie die Genitalien selbst: bei Männern die Peniswurzel, die Eichel und der Hodensack, bei Frauen der Schamhügel mit den Schamhaaren, also die Vulva mit den Schamlippen; außerdem die Hautpartie zwischen Genitalien und After bzw. um diesen herum. Die Symptome sind für eine Psoriasis eher untypisch, weil ohne charakteristische Schuppung, sondern meist mit roten, scharf abgegrenzten Herden.[7][9]
Kopfhaut
Die Kopfhaut-Psoriasis nimmt eine Sonderstellung ein: Der behaarte Kopf ist sowohl bei juvenilen Formen als auch bei Erwachsenen das am häufigsten befallene Hautareal der Psoriasis. Nach Angaben der Deutschen Dermatologischen Gesellschaft in der Leitlinie zur Psoriasis des behaarten Kopfes schwanken statistische Angaben zur Häufigkeit des Kopfhautbefalls bei Psoriasis zwischen 50 und 80 Prozent.[10] Die Kopfhaut zählt u. a. aufgrund ihrer Sensibilität und der dichten Behaarung zu den schwierig zu behandelnden Arealen.
Manifestation an Hautanhangsgebilden
Bei massivem Befall der Kopfhaut können die Haarfollikel beeinträchtigt werden, was als besondere Form des inselförmigen Haarausfalls eine Alopecia psoriatica zur Folge hat.
Veränderungen an den Nägeln von Zehen und Fingern stellen manchmal das einzige Symptom dar. Es kommt zur Nagelmatrix-Psoriasis (Tüpfel- oder Grübchennägel, „Ölflecken“ bzw. gelblich verfärbte Ölnägel), zur Nagelbett-Psoriasis (distale Onycholyse) und zur subungualen Onychodystrophie (Krümelnagel, Nagelverdickungen: Onychauxis), eventuell auch zu einer Akroosteolyse.
Beteiligung anderer Organe
Mit und ohne (wesentliche) Beteiligung der Haut kann die Psoriasis auch andere Organe betreffen:
Psoriasis arthropathica
Entzündliche Veränderungen an den Gelenken und zugehörigen Bändern und angrenzenden Weichteilen, mit und ohne gleichzeitige Veränderungen der Haut sowie mit und ohne Überschneidung zur Bechterewschen Krankheit mit Nachweis von HLA-B27.
Augen
Entzündungen des Augeninneren (Uveitis) kommen bei Psoriasis gehäuft vor, sind gehäuft mit Entzündungen auch der Netzhaut verbunden und haben weitere Eigentümlichkeiten gegenüber anderen Formen der Uveitis.[11]
Herz-Kreislauf
Die Datenlage für einen Zusammenhang zwischen Psoriasis und Gefäßerkrankungen sowie deren Folgen (Herzinfarkt, Schlaganfall) ist uneinheitlich. Es findet sich zwar auch ein höheres Auftreten klassischer Gefäßrisikofaktoren (Fettleibigkeit, Bluthochdruck, Zucker- und Fettstoffwechselstörungen), man kann aber, mit Blick auf die systemische Entzündung bei der Psoriasis, von einem eigenständigen Risikofaktor für arterielle Erkrankungen des Herz-Kreislauf-Systems ausgehen.[12][13][14][15]
Knochen
Ein Vergleich zwischen Schuppenflechte-Patienten und in Alter und Geschlecht vergleichbaren Gesunden ergab, dass Psoriasis-Patienten eine vermehrte Knochenproliferation bei gleichzeitigem nicht unterschiedlichen Erosionsumfang aufweisen.[16]
Psychische Belastung
Die psychischen Belastungen Psoriasiskranker werden allgemein stark unterschätzt: Nach neueren Studien liegen sie in der Größenordnung der Belastungen von Herzinfarktpatienten. Viele Betroffene erfahren ihre Erkrankung als starke Beeinträchtigung der persönlichen Lebensqualität, sie fühlen sich gesellschaftlich isoliert, leiden unter mangelndem Selbstbewusstsein und häufig auch unter Depressionen.[17]
Dass die Rate an Alkoholmissbrauch bei Psoriasispatienten gegenüber der Allgemeinbevölkerung deutlich erhöht ist, kann sowohl eine Folge als auch einen verschlimmernden unspezifischen Reiz der Hauterkrankung darstellen.
Ursachen

Die Ätiologie der Psoriasis ist vermutlich multifaktoriell; Zusammenhang, Ausmaß und Wirkung von erblicher Disposition und Autoimmunreaktion sowie weiterer möglicher Auslöser sind noch nicht abschließend geklärt.
Erbliche Disposition
Schuppenflechte ist zu einem erheblichen Anteil erblich bedingt, daher wird familiäre Häufung beobachtet, wobei gelegentlich mehrere Generationen übersprungen werden. Bis heute ist allerdings nicht bekannt, ob die Psoriasis dominant oder rezessiv vererbt wird. Man geht davon aus, dass sie durch das Zusammenwirken von Varianten verschiedener Gene und Umwelteinflüssen ausgelöst wird. Das Risiko eines eineiigen Zwillings eines Betroffenen, ebenfalls zu erkranken, liegt bei 65–72 %.[18] Etwa zwei bis drei Prozent der Bevölkerung in Mitteleuropa sind von der Krankheit betroffen, während der Anteil in den USA bei ca. vier bis fünf Prozent liegt. Bei Inuit, indigenen Völkern Amerikas, Menschen afrikanischer Herkunft und Ureinwohnern Australiens kommt die Psoriasis so gut wie nicht vor; in Japan und der Volksrepublik China liegt die Prävalenz zwischen 0,025 und 0,3 %, am häufigsten ist sie unter Kasachen (bis 12 %). Nicht bei allen Erbmalträgern kommt die Schuppenflechte zum Ausbruch; zu der Erbanlage müssen vermutlich noch weitere, noch nicht bekannte Faktoren hinzukommen.
Dass bei Erbkrankheiten über Jahrtausende hinweg eigentlich nachteilige Gene erhalten bleiben, wird durch anderweitige Selektionsvorteile der Betroffenen zu erklären versucht. So wird etwa postuliert, dass zu Psoriasis neigende Personen weniger unter Hautinfektionen leiden, weil sie mehr Defensine (antibakterielle Proteine, enthalten in den Zellen des Stratum corneums der Haut) besäßen.[19]
Fehlfunktion des Immunsystems
Es wird davon ausgegangen, dass es sich um eine autoimmune T-Zell-mediierte Immunreaktion handelt, bei der das Immunsystem körpereigenes Gewebe als körperfremd erkennt und angreift. In den betroffenen Geweben entsteht ein proinflammatorisches Milieu. Bei Psoriasis wird vermehrt das Protein Psoriasin gebildet.
Überraschend fand eine italienische Studie eine Prävalenz von 18 Prozent mit latenter Tuberkuloseinfektion unter gut 400 an Schuppenflechte Erkrankten. Ob dabei die Infektion einen Risikofaktor für Psoriasis darstellt oder ob sowohl Infektion als auch Psoriasis durch den gleichen Defekt im Immunsystem begünstigt werden, muss weiter untersucht werden.[20]
Diagnostik
PASI-Score
Der Schweregrad der Erkrankung wird vor allem für die Bewertung von Therapie-Ergebnissen mit dem PASI-Score ermittelt.
Phänomene
- „Kerzen“-Phänomen: Durch Kratzen z. B. mit einem Holzspatel am Psoriasis-Herd fallen die locker haftenden, silbrig-weißen Schuppen ab, was an das Geschabsel einer Wachskerze erinnert.
- Phänomen des „letzten Häutchens“: Beim Weiter-Kratzen lässt sich ein lamellenartiges dünnes Häutchen entfernen.
- Auspitz-Phänomen/Phänomen des „blutigen Taus“ (= Phänomen der punktförmigen Blutungen): Nach Entfernung des parakeratotischen Materials und des letzten Häutchens treten punktförmige Blutungen auf.[21]
Differentialdiagnosen
Differentialdiagnose
Die Differenzialdiagnose der Schuppenflechte ist von der Manifestationsform abhängig. Hier eine Übersicht in Anlehnung an das Lehrbuch von Fritsch:[22]
| Manifestationen | Differenzialdiagnose | Bemerkungen |
|---|---|---|
| Einzelherd | Ekzemplaque, Dermatomykose, chronisch-diskoider Lupus erythematodes, Morbus Bowen, oberflächliches Basaliom, extramammärer Morbus Paget, pagetoide Retikulose | Einzelherde können mit einem Ekzem, einer Pilzerkrankung oder Vorstufen einer Hautkrebserkrankung verwechselt werden. |
| Psoriasis guttata | seborrhoisches Ekzem, Pityriasis rosea, Pityriasis lichenoides, Lichen ruber planus, subakut-kutaner Lupus erythematodes, Syphilis II | Bei dieser Form bestehen mehrere polyzyklische, zum Teil konfluierende Herde, die mit einem Ekzem verwechselt werden können. Die Pityriasis lichenoides ist eine seltere Autoimmunerkrankung, ebenso wie der häufigere Lupus erythematodes. Die Syphilis kann im Stadium II fast jede Hautkrankheit imitieren. |
| Plaque-Typ-Psoriasis | Nummuläres Ekzem, Parapsoriasis en plaques, Mycosis fungoides, subakut-kutaner Lupus erythematodes | Auch der Plaque-Typ kann mit einem Ekzem und einer Autoimmunerkrankung verwechselt werden. Die Parapsoriasis ist eine schlecht definierte Gruppe von Psoriasis ähnlichen Erkrankungen. Bei der Mycosis fungoides handelt es sich um eine Hautinfiltration mit bösartig entarteten Lymphozyten. |
| erythrodermatische Psoriasis | Ekzematische Erythrodermie, Pityriasis rubra pilaris, kongenitale ichthyosiforme Erythrodermie, Sézary-Syndrom, erythrodermatische Mycosis fungoides | Die Ganzkörperform der Schuppenflechte kann mit ausgedehnten Ekzemen und der Stachelflechte (Pityriasis rubra pilaris) verwechselt werden. Beim Sézary-Syndrom ist die Haut stellenweise von bösartig entarteten Lymphozyten infiltriert. |
| Psoriasis capillitii | Seborrhoisches Kopfekzem, Tinea amiantacea, Mikrosporie | Der Befall der Kopfhaut kann auch durch ein Ekzem oder spezielle Pilzerkrankungen vorgetäuscht werden. |
| intertriginöse Psoriasis | intertriginöses Ekzem, Candidose | Der Befall zwischen den Fingern und Zehen muss gegenüber einem Ekzem oder einer Pilzerkrankung abgegrenzt werden. |
| palmoplantare Psoriasis | chronisches Hand- oder Fußekzem, palmoplantare Mykose, Sézary-Syndrom | Die Manifestation an den Handflächen oder Fußsohlen kann einem Ekzem, einer Pilzerkrankung ähnlich sehen. |
| genitale Psoriasis | Morbus Reiter, Erythroplasie, Syphilis II | Beim Morbus Reiter handelt es sich um eine komplexe Reaktion auf eine Infektion (zum Beispiel Chlamydien). Die Erythroplasie wird durch Papillomaviren ausgelöst und kann bösartig entarten. |
| mit Gelenkmanifestation | Morbus Reiter |
Grundsätzlich sollte die Differenzialdiagnose einem erfahrenen Hautarzt überlassen werden. Bei der Psoriasis guttata mit mehreren polyzyklischen zum Teil konfluierenden Herden besteht die Möglichkeit einer Verwechslung mit einem Ekzem oder der Reiterschen Erkrankung:
Das Vollbild mit der Trias aus Gelenkentzündung (Arthritis), Bindehautentzündung (Konjunktivitis) und Entzündung der Harnröhre (Urethritis) wird vermutlich durch eine Autoimmunreaktion nach bakterieller Infektion ausgelöst, wenn diese auch nicht immer erinnerlich ist. Wenn sich zudem nahe den entzündeten Gelenken sichtbare Hautveränderungen zeigen, die denen der Psoriasis ähneln, ist die Reitersche Erkrankung eine Differentialdiagnose zur Psoriasisarthritis.
Um das Risiko einer Verwechslungsgefahr zu reduzieren, wird in der Regel eine Hautbiopsie entnommen, welche histologisch von einem Pathologen begutachtet wird.
Molekulare Diagnostik (Differentialdiagnose Psoriasis vs. Ekzem)
Die visuelle Beurteilung von Hautläsionen stellt – ebenso wie die histologische Analyse von Hautbiopsien – eine subjektive Diagnosemethode dar, bei der es nicht selten zu Fehleinschätzungen kommt. Zur Verringerung solcher Fehldiagnosen, stehen inzwischen molekulardiagnostische Verfahren zur Verfügung, bei denen Gen-Signaturen aus Hautbiopsien analysiert werden. Ein solcher molekulargenetischer Ansatz zur Unterscheidung zwischen Psoriasis und Ekzem wurde erstmals von N. Garzorz-Stark vorgestellt[23]. Die Methode beruht auf der Bestimmung spezifischer Biomarker – insbesondere NOS2 und CCL27 – die anhand von isolierter mRNA aus Gewebeproben mittels Polymerase-Kettenreaktion (PCR) quantifiziert werden[24]. Dieses Verfahren hat mittlerweile in Form der PsorX-LabDisk[25] Einzug in die Routinediagnostik gehalten[26].
Verlauf, auslösende oder verschlimmernde Faktoren
Bei jedem Patienten verläuft die Krankheit anders: So heilt sie bei einigen scheinbar aus und tritt nur einmal im Leben auf (rund 25 %), bei anderen dagegen wechseln Phasen mit starker und geringer oder fehlender Aktivität der Erkrankung.
Viele Betroffene berichten über schwerwiegende physische oder psychische Belastungssituationen als initialen Auslösefaktor. Beispielsweise kann eine Infektionserkrankung, ausgelöst durch Erreger wie Influenza-Viren, Meningokokken oder Pneumokokken, einen Krankheitsschub auslösen.[27] Andere mögliche Ursachen umfassen Operationen oder auch einschneidende private Erlebnisse, wie den Tod eines nahen Angehörigen. Gerade bei Frauen haben oft auch starke hormonelle Veränderungen, wie sie u. a. bei Schwangerschaften vorkommen, erstmals einen Ausbruch und einen „Psoriasis-Schub“ zur Folge. Dass die Schuppenflechte häufig das erste Mal in der Pubertät ausbricht, könnte auch in diesen Zusammenhang gehören.
Am häufigsten zeigt sich die Erkrankung aber erst zwischen dem 20. und 30. Lebensjahr (Typ I, s. o.). In einzelnen Fällen tritt die Psoriasis bereits im Kindesalter auf und stellt dann eine zusätzliche und meist unterschätzte psychische Belastung für das Kind dar. Vor allem in der Herbst- und Winterzeit kommt es aufgrund der zusätzlichen Hautbelastungen durch trockene Heizungsluft und nasskalte Klimabedingungen und wohl auch wegen geringerer UV-Einstrahlung vermehrt zu Krankheitsschüben.
Außerdem kann die Psoriasis bei bereits bestehender Veranlagung durch zahlreiche Medikamente wie: Betablocker, ACE-Hemmer, Lithium-Salze, Antimalariamittel, Interferone, Tetracycline, Terbinafin, NSAIDs und Folsäure ausgelöst oder auch der Krankheitsverlauf verschlimmert werden.
Risikofaktoren sind auch kosmetische Präparate des täglichen Lebens, insbesondere, wenn sie die Haut austrocknen (beispielsweise alkoholhaltige Lotionen) oder sie chemisch irritieren, wie Rasierschaum, Haarspray und Handwaschpräparate. Selbst kosmetische Produkte, die eigentlich der Linderung psoriatischer Symptome dienen sollen, können zu deren Verschlechterung bis hin zur gefährlichen Psoriasis pustulosa generalisata führen, so die zahlreichen Shampoos, die Zink-Pyrithion enthalten.[28][29]
Als Auslösefaktoren einer Psoriasis werden auch unspezifische Reize, wie Verletzungen, Reibung, Operationen, Sonnenbrände oder Ähnliches beobachtet. Die Psoriasis gehört daher auch zu den Erkrankungen, bei denen das Köbner-Phänomen nachweisbar ist. Übergewicht, Alkoholmissbrauch sowie Stress können eine Psoriasis ebenfalls verschlechtern.
Behandlung
Anlässlich des Welt-Psoriasistags 2013 teilte der Deutsche Psoriasis Bund mit, dass nach Schätzungen von Experten etwa ein Viertel (24 %) der an Psoriasis Leidenden aufgrund von Unzufriedenheiten mit der Behandlung nicht mehr zu einem Arzt gehen. Mangelnde Kenntnisse bei Ärzten und Patienten über Ausmaß und Therapien der Krankheit führten zu verspäteten, falschen oder nicht ausreichenden Behandlungen und seien nicht mehr hinnehmbar.[1]
Ausgehend vom Verständnis der Psoriasis als einer genetisch mitbedingten Erkrankung und der Tatsache, dass eine Gentherapie bisher nicht verfügbar sei, ist durch andere Arten von Behandlung keine Heilung, sondern lediglich eine Linderung der Symptome zu erwarten. Hinzu kommt, dass wie bei allen Erkrankungen mit phasenhaftem Verlauf und spontanen Besserungen die Wirksamkeit von Behandlungsverfahren hinsichtlich dieser Linderung schwer einerseits vom Placebo-Effekt und andererseits von spontaner Besserung (Remission) unterschieden werden kann. Das gilt sowohl für Behandlungen auf medizinischer wie alternativmedizinischer Grundlage. Je nach Schweregrad der Erkrankung und Einbeziehung möglicher Organe wird die Behandlung abgestuft:
Ernährung
In einigen Fällen besteht ein Zusammenhang zwischen Psoriasis und Zöliakie. Der bei Zöliakie ohnehin gebotene Verzicht auf Lebensmittel mit dem Klebereiweiß Gluten kann dann auch die Psoriasis-Symptome lindern.
Psychomentale Ansätze
Da sich die Psoriasis in vielen Fällen durch negative psychische Einflüsse verschlechtert, können Behandlungen, die Stress verhindern und/oder die Einstellung zur Krankheit verändern, positive Wirkungen auf die Psoriasis haben. Selbsthilfegruppen für Menschen mit Psoriasis helfen nicht nur, eine geeignete Behandlungsmethode für die eigene Schuppenflechte zu finden, sie geben dem Betroffenen auch die Gewissheit, mit der Krankheit nicht alleine auf der Welt zu sein. Insgesamt ist Akzeptanz ein wichtiger Faktor im Umgang mit der Psoriasis.
Auf solche psychologischen Faktoren können eventuell auch die oft berichteten Erfolge mit Außenseitermethoden zurückgeführt werden. Patienten, die für solche naturwissenschaftlich nicht anerkannten Methoden empfänglich sind, können durch Unterstützung ihrer Psyche indirekt auch profitieren.
Äußere Anwendungen
Bei klinisch weniger schweren Haut-Erscheinungen beschränkt man sich in der Regel auf äußerliche Anwendungen (topische Therapie). Bei den meisten Behandlungsmethoden muss sich der Patient auf eine längere Dauer von Wochen oder gar Monaten einstellen.
- Harnstoff (Urea pura) – wird für die Pflege und Behandlung in Form von Beigaben in Öl, Creme und Salben verwendet. Es gibt keine größeren randomisierten Studien zu ihrer Wirksamkeit.[30]
- Salizylsäure – im Wesentlichen zum Ablösen der Schuppen verwendet. In der S3-Leitlinie der Deutschen Dermatologischen Gesellschaft zur Psoriasis wird es nicht mehr empfohlen. Stattdessen wechselwirkt es mit Methotrexate und kann dessen Toxizität erhöhen.[31]
- Dithranol (auch als Cignolin bekannt) – bremst die Zellteilung und hat eine gute Wirksamkeit. Diese Methode ist in der Behandlung jedoch extrem aufwändig. Ältere Präparate hatten auch noch andere Nachteile wie die Braunfärbung auch der umgebenden gesunden Haut, aber auch vieler Gegenstände, die mit dem Präparat in Berührung gekommen sind, wie Kleidung, Bettwäsche und Waschbecken. Es sind heute moderne Zubereitungen im Handel, durch die sich die oben beschriebenen Nebenwirkungen deutlich reduzieren lassen. So durch die Minutentherapie, bei der Dithranol nur noch wenige Minuten auf die erkrankten Stellen aufgetragen und anschließend abgewaschen wird.[30]
- Kortikoide – synthetische Wirkstoffe, die dem menschlichen Hormon der Nebennierenrinde nachempfunden sind. Starke Kortikoide wie Clobetasol oder Betamethason reduzieren schnell die entzündlichen Erscheinungen. Wegen der Nebenwirkungen sollte man Kortikoide jedoch nur kurzzeitig und nur auf kleinen Hautpartien einsetzen. Sie eignen sich nicht zur Behandlung großflächiger Hautareale. Am besten geeignet sind Kortikoid-Salben noch für die Kopfhaut. Ein Effekt, der von diesen Präparaten oft verursacht wird, ist die „Hautatrophie“ (Verdünnung der Haut), die Venen schimmern dann durch die Haut durch.
Die Verträglichkeit lässt sich günstig beeinflussen, indem Kortison als fixe Kombination mit Calcipotriol aufgetragen wird. Im Rahmen einer Untersuchung,[32] bei der Patienten mit Kopfhaut-Psoriasis 52 Wochen lang die Fixkombination von Calcipotriol und Betamethason (in Lipo-Gel-Form) angewendet hatten, kam es bei keinem der Patienten zu der gefürchteten Hautatrophie – dem Dünnerwerden der Haut. Aufgrund der guten Verträglichkeit und hohen Wirksamkeit wird diese Fixkombination in der Leitlinie zur ärztlichen Behandlung der Kopfhaut-Psoriasis als Initialtherapie empfohlen. - Berberin – Mahonia-aquifolium-Creme zeigte gute Ergebnisse in einer Studie mit 200 Patienten. Deren Wirkstoff Berberin wird aus der Rinde der Gewöhnlichen Mahonie gewonnen.[33][34]
- Steinkohlenteer – Wird seit langer Zeit zur Behandlung chronischer Hautkrankheiten verwendet. Bremst die Zellteilung und lindert den Juckreiz. Allerdings gelten die hierbei verwendeten Teer-Stoffe inzwischen als krebsfördernd, weswegen sie nur noch sehr eingeschränkt angewendet werden bzw. bekannte Produkte bereits vom Markt genommen wurden. Die berufliche Exposition mit Steinkohlenteer kann die Häufigkeit von Harnblasenkrebs erhöhen.[35] Für dermatologische Anwendungen konnte dies nicht nachgewiesen werden.[36]
- Vitamin-D-Derivate[37] – sind synthetische Stoffe, die einem Hormon nachempfunden sind, welches eine wesentliche Rolle bei der Steuerung der immunologischen und regenerativen Vorgänge der Haut spielt. Sie verringern die Teilungsaktivität der Hautzellen. Das verwendete Calcipotriol oder auch Tacalcitol sind solche Vitamin-D-Derivate, welche die Risiken des Vitamin D (Hyperkalzämie) um ein Vielfaches reduzieren.
Auch diese Medikamente können bei Überdosierung gefährliche Nebenwirkungen haben; im Allgemeinen sind sie aber gut verträglich. In vielen Studien wurden Vitamin-D-Analoga mit großem Erfolg zusammen mit einem Corticoid verabreicht.[38] Eine häufige Behandlungsmethode besteht in der Kombination mit UV-Lichttherapie.
Bade-, Lichttherapien
Eine Lichttherapie kann in der Praxis des Hautarztes oder, wenn man sich die entsprechenden Geräte angeschafft hat, zu Hause durchgeführt werden. Sonnenlicht bewirkt ebenfalls eine Linderung, die Bestrahlung mit künstlichem Licht bestimmter Wellenlänge ist jedoch vorteilhafter.
Es werden verschiedene Formen und Kombinationen angewandt:
Bade-/Fangotherapie
Eine Badetherapie mit schwefelhaltigem Natur-Fango und Vulkanwasser, wie sie in den argentinischen Anden im Thermalbad Copahue angeboten wird, kann Linderung, jedoch keine Heilung bewirken. Positive Erfahrungen gibt es auch mit Badetherapien in der Blauen Lagune (Bláa Lónið) in Island sowie solchen im Toten Meer.
Balneo-/Balneophototherapie
Die Balneophototherapie ist hauptsächlich als „Sole-Photo-Therapie“ bekannt. Diese Methode soll die Bedingungen am Toten Meer simulieren. Zwischen 60 und 90 % der Patienten sprechen auf diese Behandlungsart gut bis sehr gut an. Hierbei badet der Patient zunächst etwa 20–30 Minuten in einer stark solehaltigen Lösung, um im Anschluss – möglichst mit noch nasser Haut – kurzzeitig, d. h. im Bereich von wenigen Minuten, mit einer intensiven UVB-Lichtquelle bestrahlt zu werden. Zur Balneophototherapie wurde am 5. Mai 2020 ein Cochrane Review veröffentlicht.[39] Die Autoren evaluierten die Studiendaten von Patienten mit Psoriasis vulgaris. Dabei zeigte das Salzbad kombiniert mit UVB Vorteile gegenüber der alleinigen UVB-Behandlung (Hauptergebnis). Primärer Endpunkt war eine Reduktion des Psoriasis Area and Severity Index (PASI) um mindestens 75 % (PASI-75). Dieser Endpunkt wurde von lediglich zwei der insgesamt acht eingeschlossenen Studien berichtet. Beide Studien hatten denselben Sponsor, und beide Studien hatten ein hohes Verzerrungspotenzial. Daher wurde die Evidenzsicherheit als niedrig erachtet.
Fischtherapie
Diese wird mit Rötlichen Saugbarben (Garra rufa, auch Kangal- oder Knabberfische) durchgeführt: Die Patienten baden drei Wochen lang etwa zwei Stunden täglich mit ca. 200 Saugbarben in speziellen Therapiewannen. Die Fische (Kangalfische) entfernen dabei die Hautschuppen der betroffenen Patienten. Anschließend erhalten die Patienten eine kurze UV-Bestrahlung im Solarium sowie Hautpflegecremes. Ein bekannter Ort dafür ist die „Kangal-Thermalquelle“ in der Nähe des türkischen Dorfes Kavak. Behandelte Patienten berichten auf der kommerziellen Homepage der Einrichtung über eine deutliche Befundbesserung. Über die Behandlung in dieser heißen Quelle wurde bisher in zwei kleinen klinischen Studien mit positiven Ergebnissen berichtet, ihre Aussagekraft ist jedoch aufgrund des retrospektiven Designs und des Fehlens von Kontrollgruppen eingeschränkt. Seit 2000 sind für diese Therapie die Fische auch bei Züchtern in Deutschland erhältlich.[40][41]
Lasertherapie
Der Excimer-Laser stellt eine der neuesten Entwicklungen in der Lasertherapie dar. Es handelt sich dabei um einen Xenon-Chlorid-Gas-Laser. Er erzeugt monochromatisches Licht der Wellenlänge 308 nm. Der Laser arbeitet im UV-Schmalband-Spektrum. Anders als beim aufgefächerten Lichtkegel von Lichtkabinen erzeugt der Laser einen gebündelten Strahl. Mit dem kleinen optischen Fenster des Laser-Kopfes ist es möglich, innerhalb kurzer Zeit eine therapeutisch hohe Strahlendosis gezielt auf erkrankte Hautgebiete anzuwenden, ohne die umliegende gesunde Haut der Strahlung auszusetzen. Der Laser bietet sich besonders zur Behandlung von kleinen, hartnäckigen Entzündungsherden auf der Haut an. Der Laser hat sich bei der Behandlung von verschiedenen Erkrankungen bewährt, die auf eine UV-Therapie ansprechen. Zum Einsatz kommt er vor allem bei der Psoriasis und der Vitiligo. Die benötigte Therapiezeit ist durch die hohe Bestrahlungsstärke des Lasers gegenüber konventionellen Lichtkabinen deutlich geringer. Schwer erreichbare Regionen der Haut, etwa Hautfalten oder Gelenkbeugen, können einfacher erreicht werden als bei einer Therapie in Lichtkabinen. Je nach Empfindlichkeit des erkrankten Haut-Areals kann die therapeutisch notwendige Dosis gezielt angepasst werden.
PUVA
Diese schon länger bekannte[42] Methode (Psoralen + UVA) gibt es in drei Formen zur äußerlichen (als Creme oder Bad) und innerlichen Anwendung (mittels Tabletten). Die Wirkstoffe sind Psoralene (z. B. Methoxsalen), die in Präparaten wie Psoralen oder Meladinine enthalten sind. Diese steigern die Lichtempfindlichkeit der Haut und erhöhen so die Wirksamkeit der UVA-Strahlen. Durch die PUVA-Therapie kommt es vermutlich zu einer Photoinaktivierung der hyperreaktiven T-Zellen, da Psoralen, ein Furocumarin, molekulare Bindungsreaktionen an Nukleinsäuren und Proteinstrukturen eingeht. Die langfristige Anwendung von PUVA kann irreguläre Pigmentierungen, eine lichttypische Alterung der Haut mit Teleangiektasien (feine Äderchen in der Haut) und nachlassender Elastizität bewirken.[43] Bei jungen Patienten muss auch die Möglichkeit von späteren Hautkrebserkrankungen berücksichtigt werden.[44] Unter Abwägung von Erfolgen und Risiken wird die PUVA in der Leitlinie „Therapie der Psoriasis vulgaris“ empfohlen.[31] Bei Patienten, die unter Ciclosporin längere Zeit hohe kumulative Dosen an PUVA (> 1000 J/cm²) erhielten, zeigte sich ein erhöhtes Risiko für Plattenepithelkarzinome der Haut.[31]
Schmalspektrum-Ultraviolettstrahlung
Die Schmalspektrum-UVB-Therapie ist nach den Bestrahlungsgeräten mit 311 nm Licht-Wellenlänge benannt. Die Psoriasis reagiert am empfindlichsten im Bereich zwischen 310 und 313 nm, daher ist die 311 nm Bestrahlung heute das Mittel der Wahl für Ganz- und Teilkörperbestrahlungen, z. B. mit einem Lichtkamm. Durch die geringere Erythemwirkung ist die Verträglichkeit besser als bei Breitband-UVB- und SUP-Strahlern. Diese Therapie wird oft kombiniert mit topischen Behandlungen, zur weiteren Steigerung der Wirksamkeit.
Selektive Ultraviolett-Phototherapie (SUP)
Eine Kombination von UVA und UVB. Sie wirkt rasch und intensiv, muss aber optimal an die Hautverhältnisse der Personen angepasst werden, um Sonnenbrände zu vermeiden. Dies gilt allerdings für alle Bestrahlungstherapien.
Elektrotherapie
Die Elektrotherapie mit Interferenzstrom zur Behandlung wurde am Forschungszentrum Karlsruhe weiterentwickelt, wo man in einer kleineren Studie Behandlungserfolge nachweisen konnte.[45][46] Die Behandlung sei praktikabel und gut verträglich. Zur Behandlung müssen die psoriatischen Areale mit Elektroden abgedeckt werden. Hände, Füße oder Ellbogen können auch in Wannen behandelt werden, die mit Leitungswasser gefüllt sind. Die Behandlungen müssen regelmäßig zweimal täglich fünf Minuten lang durchgeführt werden, bis der Befall abgeheilt oder deutlich gebessert ist. Je nach dessen Schwere dauert dies bis zu zwölf Wochen. Da die Behandlungen regelmäßig erfolgen müssen, werden sie in der Regel vom Patienten selbst durchgeführt. Die Behandlung erfordert spezielle Therapiegeräte, die gekauft oder geliehen werden können. Zurzeit laufen mehrere Studien.[47] Bei der Psoriasisarthritis sind zwar analgetische Effekte beschrieben, ein Einfluss auf den Krankheitsverlauf ist jedoch nicht beobachtet worden.[48]
Systemische Therapien
Medikamente zur innerlichen Anwendung (systemische Therapie) sind bei mittelschweren bis schweren Fällen der Haut und bei Beteiligungen anderer Organe indiziert. Angesichts der Tatsache, dass es sich bei der Schuppenflechte um eine Autoimmun-Erkrankung (s. o.), also eine entzündliche, systemische Erkrankung mit dem zusätzlichen Risiko assoziierter Co-Morbiditäten handelt, spielt die systemische Behandlung eindeutig die größere Rolle. Eine kosmetische (topische) Behandlung kann für eine systemische Erkrankung keine zufriedenstellende Lösung sein. Neuere Daten legen nahe, dass eine frühe systemische Therapie nicht nur die Schuppenflechte selbst verbessert, sondern auch das mit Schuppenflechte assoziierte kardiovaskuläre Risiko vermindert.[49] Da das Immunsystem der Betroffenen durch die Erkrankung beeinträchtigt ist und hinzukommende immunmodulatorische oder immunsuppressive Therapien die körpereigene Abwehr gegen verschiedene Krankheitserreger zusätzlich schwächen, erkranken die Patienten häufiger an Infektionskrankheiten. Im Durchschnitt verlaufen die Infektionen außerdem auch schwerer als bei immungesunden Personen.[27][50] Deshalb gehören Menschen mit Psoriasis zu den Risikopatienten für viele Infektionskrankheiten, wie etwa Pneumonie (ausgelöst etwa durch Pneumokokken) oder Meningitis (ausgelöst durch Meningokokken). Aus diesem Grund empfiehlt die Ständige Impfkommission (STIKO) den Immunschutz vor Beginn einer systemischen Therapie durch Impfungen zu komplettieren bzw. aufzufrischen.[27][50] Während einer laufenden systemischen Therapie sind Impfungen stets von ärztlichen Einzelfallentscheidungen abhängig.[27]
Die folgende Liste orientiert sich an der Häufigkeit der Verschreibung systemischer Therapien in Deutschland laut dem deutschen Psoriasis-Register:[51]
Fumarsäureester
Eine Mischung aus unterschiedlichen Fumarsäureestern (Fumarsäuredimethylester und Fumarsäuremonoethylester-Salze) ist als Medikament unter dem Handelsnamen Fumaderm® seit 1994 verfügbar.[52][53] Behandlungen mit diesem Medikament werden bei mittelschwerem bis schwerem Befall vorgenommen, wobei es zu einer Abnahme des Schweregrades der Erkrankung im Mittel um 50–80 % kommt.[54] Nach Empfehlung der deutschen S3-Leitlinie zur Therapie der Psoriasis vulgaris eignen sich Fumarsäureester besonders zur Langzeittherapie. Ein weiterer Vorteil der Therapie mit Fumarsäureestern liegt in den geringen Arzneimittelinteraktionen.[54] Fumarsäuredimethylester wirken immunmodulatorisch (antientzündlich) und sind die Antipsoriatika mit der längsten Erfahrung im Einsatz (nämlich seit 1959).[55] Dadurch, dass die Entzündung zurückgeht, gehen auch die Schuppen zurück.
Die wichtigsten unerwünschten Arzneimittelwirkungen sind vorübergehende Magen-Darm-Beschwerden, Diarrhoen, kolikartige Bauchschmerzen und Hitzewallungen.[56] Ferner kann die Zahl der weißen Blutkörperchen im Blut abnehmen (Leuko-/Lymphozytopenie). Sollte die Anzahl der weißen Blutkörperchen stark abfallen, muss die Dosis reduziert oder die Therapie unterbrochen werden. Wenn die Therapie trotz stark reduzierter Anzahl weißer Blutkörperchen fortgeführt wird, besteht das Risiko opportunistischer Infektionen, wie beispielsweise der progressiven multifokalen Leukenzephalopathie (PML), die mitunter sogar tödlich verlaufen kann. Ärzte kontrollieren daher das Blutbild in regelmäßigen Abständen. Es gibt keine wissenschaftlichen Hinweise auf ein DMF-assoziiertes Risiko für PML. Das vorteilhafte Nutzen-Risiko-Verhältnis von Fumaderm® bei der oralen Behandlung der mittelschweren bis schweren Psoriasis insbesondere für die Langzeiterhaltungstherapie wurde in den entsprechenden Leitlinien zur Therapie der Psoriasis hervorgehoben.[52] Die Effekte bei Psoriasisarthritis sind nicht ausreichend untersucht, es gibt aber Hinweise auf eine Wirksamkeit[57] und in aktueller klinischer Praxis werden Fumarsäureester bei Patienten mit Plaque Psoriasis und milder Psoriasisarthritis eingesetzt.[58] Fumarsäureester sind die am häufigsten verschriebenen systemischen Psoriasis-Therapien in Deutschland.[51]
Methotrexat
In niedriger Dosis (bis zu 25 mg/Woche) verwendet ist Methotrexat (MTX, zahlreiche Generika) weltweit das am häufigsten verwendete Medikament zur innerlichen Behandlung der Psoriasis. In Deutschland wird es am zweithäufigsten eingesetzt.[51] Es unterdrückt das Immunsystem. Unerwünschte Arzneimittelwirkungen betreffen die Leber, Nieren und das blutbildende System des Knochenmarks. Lange galt, dass MTX besonders gut bei Psoriasisarthritis wirksam ist, allerdings konnte eine im Jahr 2012 publizierte randomisierte placebokontrollierte Studie keinen solchen Effekt zeigen.[59]
Biopharmazeutika
Bei den Biopharmazeutika unterscheidet man zwei Typen: die TNF-Blocker Adalimumab[60], Infliximab und Etanercept sowie die Interleukin-Hemmer wie den Interleukin-12/23-Hemmer Ustekinumab und den Interleukin-17A-Hemmer Secukinumab, der Interleukin-17A neutralisiert.[61] Es handelt sich dabei um biotechnologisch hergestellte Substanzen, die entweder zur Gruppe der monoklonalen Antikörper (Adalimumab, Infliximab, Secukinumab und Ustekinumab) oder der Gruppe der Fusionsproteine (Etanercept) gehören. Diese Substanzen werden bei Patienten eingesetzt, bei denen die klassischen systemischen Therapien (Methotrexat, Ciclosporin, Fumarsäureester) oder eine Lichttherapie nicht in Frage kommen oder unzureichend wirksam sind. Es gibt Hinweise, dass bei Psoriasisarthritis die TNF-α-Antagonisten ein Fortschreiten der Gelenkschäden verhindern können. Besonders die TNF-Blocker erhöhen das Infektionsrisiko unter der Therapie, auch das Risiko opportunistischer Infektionen, wie beispielsweise der PML.[62] Unter Ustekinumab kann eine besonders schwerwiegende Abschälung der Haut eintreten.[63] Da Adalimumab die Immunabwehr unterdrückt, ist auch hier das Risiko erhöht, an opportunistischen Infektionen zu erkranken.[64] Adalimumab wird in Deutschland zur Behandlung der Psoriasis am dritthäufigsten eingesetzt.[51] Die drei Proteine Adalimumab, Etanercept und Infliximab gelten – unter wirtschaftlichen Aspekten – als besonders erfolgreiche Medikamente und sind daher so genannte Blockbuster. Sie werden aber auch in anderen Indikationen eingesetzt (z. B. Psoriasisarthritis, Rheuma und Morbus Crohn).
Weitere Biopharmazeutika sind z. B. Ixekizumab, Brodalumab, Guselkumab, Tildrakizumab, Risankizumab; darüber hinaus befinden sich zahlreiche in klinischer Prüfung. Der noch im Zulassungsverfahren befindliche monoklonale humanisierte IgG1-Antikörper Bimekizumab inhibiert selektiv sowohl Interleukin-17A als auch Interleukin-17F.[65]
Apremilast
Der Phosphodiesterase-Hemmer Apremilast (Handelsname: Otezla, Hersteller: Amgen, ehemals Celgene) ist seit Januar 2015 zur Behandlung der mittelschweren bis schweren chronischen Psoriasis zugelassen. Apremilast ist der erste für diese Indikation zugelassene orale PDE-4-Hemmer und wird zur Behandlung von Patienten eingesetzt, bei denen andere systemische Therapien nicht angesprochen haben oder nicht vertragen wurden. Die Substanz wurde ebenfalls zur Behandlung von Psoriasisarthritis bei Erwachsenen zugelassen.[61][66]
Retinoide
Die Vitamin-A-Abkömmlinge wie zum Beispiel Acitretin werden gerne mit UV-Bestrahlungen kombiniert, für synergistische Effekte dieser Kombinationstherapie gibt es jedoch keine ausreichenden Belege.[54] Wichtig ist, dass diese Stoffe bei Frauen bis zu zwei Jahre nach der Behandlung zu einer Missbildung des Kindes in der Schwangerschaft führen können.
Kortikoide
Die hier verwendeten Tabletten oder Spritzen wirken kurzfristig lindernd. Es können jedoch auch ein Rückschlag (ein sog. Rebound-Phänomen) und weitere gravierende Nebenwirkungen auftreten. Die innerliche Therapie der Psoriasis mit Kortikoiden wird heute nicht mehr empfohlen.
Ciclosporin
Die immunsuppressive Substanz Ciclosporin ist zur Behandlung von schwersten therapieresistenten Formen einer Psoriasis zugelassen. Eine Langzeittherapie (länger als maximal ein bis zwei Jahre) ist auf Grund der potentiellen Nebenwirkungen wie Nierenschädigung und Bluthochdruck, aber auch aufgrund der Möglichkeit eines erhöhten Krebsrisikos nicht indiziert.[54]
Chirurgische Therapieoptionen
Die Entfernung der Gaumenmandeln scheint einem guten Teil der Patienten mit Psoriasis guttata, Psoriasis vulgaris oder Psoriasis pustulosa palmoplantaris Besserung zu bringen. Darauf weisen Fallstudien, Fallserien und eine randomisierte kontrollierte Studie hin. Patienten waren großteils Japaner.[67]
Behandlung der Nagel-Psoriasis
Für die Nagel-Psoriasis gibt es bislang keine zugelassene Behandlungsmethode. Allerdings hat sich die fixe Kombination von Calcipotriol und Betamethason im Off-Label-Use bewährt. Dies wird auch durch Studienergebnisse untermauert, die eine deutliche Reduktion der Nagel-Psoriasis und positive Effekte auf Hyperkeratose und Onycholyse zeigen konnten.[68]
Alternativmedizinische Behandlungsverfahren
Gegen Psoriasis werden eine Reihe alternativmedizinischer Therapien angewendet, beispielsweise Supplementation verschiedener Stoffe oder Substanzen aus der sogenannten Traditionellen chinesischen Medizin.
Akupunkturbehandlungen zeigen keine über den Placeboeffekt hinausgehende Wirksamkeit.[69][70] Umgekehrt können Hautreize z. B. durch Akupunkturnadeln aufgrund des Köbner-Phänomens zu Psoriasis-Plaques führen.[71]
Eine Supplementierung mit Fischöl zeigt bei kontrollierten Studien keine Wirksamkeit, weder eine orale Supplementation noch die intravenöse Zufuhr von Omega-3-Fettsäuren wird empfohlen.[72] Dagegen kann eine hypokalorische Diät und das Erreichen des Normalgewichts nützlich bei der Behandlung von Psoriasis sein. Eine Wirksamkeit bei Mutterkraut, Nachtkerzenöl, Eigenharnbehandlung oder Halotherapie (Verwendung von Salz für medizinische Zwecke) konnte nicht gezeigt werden.[73] Für eine über den Placeboeffekt hinausgehende Wirksamkeit der Homöopathie bei Psoriasis liegen keine belastbaren Belege vor.[74][75]
Impfungen
Ein umfassender Impfschutz ist für Menschen mit Psoriasis aus drei Gründen besonders wichtig:
Erstens können Infektionskrankheiten Psoriasisschübe auslösen. Regelmäßige Impfauffrischungen verringern demnach das Risiko eines erneuten Schubs. Zweitens werden immunmodulatorische oder immunsuppressive Therapieansätze gegen Psoriasis angewendet. In der Folge ist das Immunsystem zusätzlich geschwächt und das Risiko für verschiedene impfpräventable Infektionskrankheiten steigt. Drittens erhöht sich mit der Schwächung des Immunsystems auch die Gefahr schwerer bis tödlicher Verläufe solcher Infektionen.[27][50]
Die Ständige Impfkommission (STIKO) am Robert Koch-Institut (RKI) zählt Patienten mit Schuppenflechte daher zu den Risikogruppen für verschiedene opportunistische Erreger. Idealerweise sollten Menschen mit Psoriasis deshalb, wie alle immungeschwächten Patienten, einen vollständigen Status bezüglich altersentsprechender Standardimpfungen aufweisen, sofern das gesundheitlich möglich ist.[27][50] Dabei sollte möglichst nicht während eines akuten Psoriasisschubs, sondern davor bzw. danach geimpft werden, um eine Verschlechterung der Hautsituation zu vermeiden.[27]
Wichtig ist zusätzlich die Unterscheidung zwischen Tot- und Lebendimpfstoffen:
Impfungen mit Totimpfstoffen sind bei Patienten mit Psoriasis und Psoriasisarthritis mit und ohne immunsuppressive Therapie in der Regel sicher. Das liegt daran, dass bei der Impfung mit Totimpfstoffen auch bei geschwächtem Immunsystem kein erhöhtes Risiko für unerwünschte Wirkungen besteht. Zwar kann der Impferfolg eingeschränkt sein, trotzdem wird bei einem Großteil der immungeschwächten Patienten ein ausreichender Impfschutz erreicht. Um sicherzugehen, kann der Impferfolg nach erfolgter Totimpfstoff-Gabe durch einen Bluttest überprüft werden.[27][76]
Die Deutsche Dermatologische Gesellschaft empfiehlt deshalb in ihrem Leitfaden zusätzlich zur Grundimmunisierung auch Indikationsimpfungen gegen die saisonale Influenza, Pneumokokken und Zoster-Viren, sowie, je nach Begleitrisiken, gegen Hepatitis B und Meningokokken der Serogruppen A, B, C, W, Y.[77]
Lebendimpfstoffe sollten während einer immunsuppressiven Therapie dagegen nur in Ausnahmefällen und nach individueller Risiko-Nutzen-Abschätzung gegeben werden. Die Gabe attenuierter Impfviren erhöht das Risiko schwerer bis tödlicher Komplikationen. Deshalb sollte spätestens vor Beginn einer systemischen Therapie die Immunisierung mit Lebendimpfstoffen entsprechend der STIKO-Empfehlungen abgeschlossen sein. Lebendimpfstoffe werden beispielsweise zum Schutz gegen Masern, Mumps, Röteln und Gelbfieber eingesetzt. Da zu den typischen Reiseimpfungen auch Lebendimpfstoffe gehören, empfiehlt sich ggf. die frühzeitige Kontaktaufnahme zu einem Reisemediziner.[27][50]
Als Infektionsprävention, insbesondere gegen Erkrankungen, gegen die immunsupprimierte Personen nicht geimpft werden können, gilt außerdem der umfassende Impfschutz von direkten Kontaktpersonen.[27][50]
Bezüglich eines kausalen Zusammenhangs zwischen dem Neu-Auftreten einer Autoimmunkrankheit bzw. dem Schub einer bestehenden Krankheit und einer Impfung mit einem in Deutschland zugelassenen Tot- oder Lebendimpfstoff gibt es keine wissenschaftliche Evidenz.[27]
Gesundheitsökonomische Aspekte
Die Behandlung der Psoriasis hat sich durch den Einsatz von Biologika erheblich verteuert: 2017 beliefen sich die Kosten konventioneller Therapien auf 1000 bis 5000 Euro im Jahr, während für Biologika 16.000 bis zu 25.000 Euro je Patient und Jahr aufgewendet werden mussten.[78][79]
Siehe auch
- Deutscher Psoriasis Bund
- Psoriasis-Netz
- Lichen ruber planus („Knötchenflechte“)
- Seborrhoisches Ekzem
Literatur
- S3-Leitlinie Therapie der Psoriasis vulgaris der Deutschen Dermatologischen Gesellschaft. In: AWMF online (Stand 2021)
- S2k-Leitlinie Therapie der Psoriasis bei Kindern und Jugendlichen der Deutschen Dermatologischen Gesellschaft. In: AWMF online (Stand 2022)
- Globaler Bericht zur Schuppenflechte. (PDF) Deutsche Übersetzung des „Global Report on Psoriasis“ 2016. In: PsoNet e. V. WHO, 2016, abgerufen am 14. Januar 2024.
- Gernot Rassner: Dermatologie: Lehrbuch und Atlas. 9. Auflage. Elsevier, Urban & Fischer, München 2009, ISBN 978-3-437-42763-3.
- Heinrich Schlange-Schöningen, G. Saalmann: Die Psoriasis. Geschichte und Therapie vom Altertum bis zur Gegenwart. Herford 1998.
- Dietrich Abeck: Häufige Hautkrankheiten in der Allgemeinmedizin. 3. Auflage. Springer, 2020, ISBN 978-3-662-57446-1, S. 123–131, doi:10.1007/978-3-662-57447-8.
- Peter Fritsch, Thomas Schwarz: Dermatologie Venerologie. 3. Auflage. Auflage, 2018, ISBN 978-3-662-53646-9, S. 362–383, doi:10.1007/978-3-662-53647-6.
- Ulrich Mrowietz, Kristian Reich: Psoriasis – neue Erkenntnisse zur Pathogenese und Therapie. In: Deutsches Ärzteblatt. 106. Jg., Nr. 1–2, 2009, S. 11–19 (aerzteblatt.de).
Weblinks
- Schuppenflechte (Psoriasis), Gesundheitsinformation.de
- Schuppenflechte (Psoriasis), Gesund.bund.de
- psonet.de: Regionale Psoriasisnetze in Deutschland
- Psoriasis-Netz
Einzelnachweise
- ↑ a b HautinForm. Das Magazin aus der Hautarztpraxis. Berufsverband der Deutschen Dermatologen e. V. (uptoderm.de ( des vom 16. Dezember 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.) 3-2013, S. 8.
- ↑ Psoriasis (Übersicht) – Fachbereich Dermatologie – Altmeyers Enzyklopädie. Abgerufen am 28. Oktober 2017.
- ↑ Benedikt Ignatzek: Psoriasis (Schuppenflechte). In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin/New York 2005, ISBN 3-11-015714-4, S. 1190.
- ↑ Jin Bu et al.: Epidemiology of Psoriasis and Comorbid Diseases: A Narrative Review. In: Frontiers in Immunology. Band 13, 2022, doi:10.3389/fimmu.2022.880201/full (englisch).
- ↑ a b Giovanni Damiani et al.: The Global, Regional, and National Burden of Psoriasis: Results and Insights From the Global Burden of Disease 2019 Study. In: Frontiers in Medicine. Band 8, 16. Dezember 2021, S. 743180, doi:10.3389/fmed.2021.743180, PMID 34977058, PMC 8716585 (freier Volltext) – (englisch).
- ↑ a b c Globaler Bericht zur Schuppenflechte. (PDF) Deutsche Übersetzung des „Global Report on Psoriasis“ 2016. In: PsoNet e. V. WHO, 2016, abgerufen am 13. Januar 2024.
- ↑ a b Anne Dietel: Psoriasis im Genitalbereich. In: Lifeline – Das Gesundheitsportal. 20. Januar 2009 (lifeline.de [abgerufen am 12. Juli 2018]).
- ↑ S. Sano, K. S. Chan, S. Carbajal u. a.: Stat3 links activated keratinocytes and immunocytes required for development of psoriasis in a novel transgenic mouse model. In: Nat. Med. Band 11, Nr. 1, Januar 2005, S. 43–49, doi:10.1038/nm1162, PMID 15592573.
- ↑ Empfindliche Stellen – Psoriasis Forum Berlin e. V. Abgerufen am 12. Juli 2018.
- ↑ S1-Leitlinie: Psoriasis des behaarten Kopfes, AWMF-Registernummer 013/074, Stand 09/2009.
- ↑ Uveitis gehäuft bei Psoriasis ( vom 12. Januar 2012 im Internet Archive)
- ↑ L. Raaby, O. Ahlehoff, A. de Thurah: Psoriasis and cardiovascular events: updating the evidence. In: Archives of dermatological research. Band 309, Nr. 3, April 2017, S. 225–228, doi:10.1007/s00403-016-1712-1, PMID 28213804.
- ↑ A. Egeberg, J. P. Thyssen u. a.: Risk of Myocardial Infarction in Patients with Psoriasis and Psoriatic Arthritis: A Nationwide Cohort Study. In: Acta dermato-venereologica. [elektronische Veröffentlichung vor dem Druck] März 2017, doi:10.2340/00015555-2657, PMID 28350413.
- ↑ T. V. Korotaeva, D. S. Novikoya, E. Y. Loginova: [Cardiovascular risk in patients with psoriatic arthritis]. In: Terapevticheskii arkhiv. Band 88, Nummer 5, 2016, S. 102–106, PMID 27458624 (Review).
- ↑ Häufung von Herzinfarkt bei Psoriasis ( vom 15. Dezember 2013 im Internet Archive)
- ↑ D. Simon, F. Faustini, A. Kleyer: Analysis of periarticular bone changes in patients with cutaneous psoriasis without associated psoriatic arthritis. In: Ann Rheum Dis. 2015 Feb 4. pii: annrheumdis-2014-206347. doi:10.1136/annrheumdis-2014-206347, PMID 25653201.
- ↑ A. B. Kimball, C. Jacobson, S. Weiss, M. Vreeland, Y. Wu: The psychosocial burden of psoriasis. In: American Journal of Clinical Dermatology. 2005. 6 (6), S. 383–392.
- ↑ K. D. Wuepper, S. N. Coulter, A. Haberman: Psoriasis vulgaris: a genetic approach. In: Journal of Investigative Dermatology. 1990 Nov, 95 (5), S. 2S–4S, PMID 2230199.
- ↑ Ingrid Moll: Duale Reihe Dermatologie. 6. Auflage, Thieme, Stuttgart 2005.
- ↑ V. Bordignon, S. Bultrini u. a.: High prevalence of latent tuberculosis infection in autoimmune disorders such as psoriasis and in chronic respiratory diseases, including lung cancer. In: Journal of biological regulators and homeostatic agents. Band 25, Nummer 2, 2011 Apr-Jun, S. 213–220, ISSN 0393-974X, PMID 21880210.
- ↑ Gernot Rassner: Dermatologie Lehrbuch und Atlas. 7. Auflage. Urban Fischer Verlag, S. 50.
- ↑ Thomas Schwarz, Peter Fritsch: Erythematosquamöse/hyperkeratotische Hautkrankheiten. In: Dermatologie Venerologie. Springer, Berlin/Heidelberg 2018, ISBN 978-3-662-53646-9, S. 361–390, doi:10.1007/978-3-662-53647-6_8 (springer.com [abgerufen am 9. Januar 2019]).
- ↑ Natalie Garzorz‐Stark, Linda Krause, Felix Lauffer, Anne Atenhan, Jenny Thomas, Sebastian P. Stark, Regina Franz, Stephan Weidinger, Anna Balato, Nikola S. Mueller, Fabian J. Theis, Johannes Ring, Carsten B. Schmidt‐Weber, Tilo Biedermann, Stefanie Eyerich, Kilian Eyerich: A novel molecular disease classifier for psoriasis and eczema. In: Experimental Dermatology. Band 25, Nr. 10, Oktober 2016, ISSN 0906-6705, S. 767–774, doi:10.1111/exd.13077 (wiley.com [abgerufen am 9. Juni 2025]).
- ↑ Felix Fischer, Anais Doll, Deniz Uereyener, Sophie Roenneberg, Christina Hillig, Lucca Weber, Verena Hackert, Martin Meinel, Ali Farnoud, Peter Seiringer, Jenny Thomas, Philipp Anand, Larissa Graner, Franziska Schlenker, Roland Zengerle, Pontus Jonsson, Manja Jargosch, Fabian J. Theis, Carsten B. Schmidt-Weber, Tilo Biedermann, Michael Howell, Kristian Reich, Kilian Eyerich, Michael Menden, Natalie Garzorz-Stark, Felix Lauffer, Stefanie Eyerich: Gene Expression–Based Molecular Test as Diagnostic Aid for the Differential Diagnosis of Psoriasis and Eczema in Formalin-Fixed and Paraffin-Embedded Tissue, Microbiopsies, and Tape Strips. In: Journal of Investigative Dermatology. Band 143, Nr. 8, 1. August 2023, ISSN 0022-202X, S. 1461–1469.e5, doi:10.1016/j.jid.2023.02.015, PMID 36889660 (jidonline.org [abgerufen am 9. Juni 2025]).
- ↑ PsorX (CE-IVD) – ein Durchbruch für entzündliche Hautkrankheiten. Dermagnostix GmbH, abgerufen am 9. Juni 2025.
- ↑ Heinrich Dickel, Andrea Bauer, Randolf Brehler, Vera Mahler, Hans F. Merk, Irena Neustädter, Klaus Strömer, Thomas Werfel, Margitta Worm, Johannes Geier: German S1 guideline: Contact dermatitis. In: JDDG: Journal der Deutschen Dermatologischen Gesellschaft. Band 20, Nr. 5, Mai 2022, ISSN 1610-0379, S. 712–734, doi:10.1111/ddg.14734 (wiley.com [abgerufen am 9. Juni 2025]).
- ↑ a b c d e f g h i j k Norbert Wagner, Frauke Assmus, Gabriele Arendt, Erika Baum, Ulrich Baumann: Impfen bei Immundefizienz: Anwendungshinweise zu den von der Ständigen Impfkommission empfohlenen Impfungen. (IV) Impfen bei Autoimmunkrankheiten, bei anderen chronisch-entzündlichen Erkrankungen und unter immunmodulatorischer Therapie. In: Bundesgesundheitsblatt - Gesundheitsforschung - Gesundheitsschutz. Band 62, Nr. 4, April 2019, S. 494–515, doi:10.1007/s00103-019-02905-1.
- ↑ Ektope pustulöse Psoriasis nach Anwendung von Shampoo. PMID 15811028.
- ↑ Generalisierte pustulöse Psoriasis nach Anwendung von Shampoo. PMID 9249288.
- ↑ a b Thomas Schwarz, Peter Fritsch: Erythematosquamöse/hyperkeratotische Hautkrankheiten. In: Dermatologie Venerologie. Springer, Berlin/Heidelberg 2018, ISBN 978-3-662-53646-9, S. 361–390, doi:10.1007/978-3-662-53647-6_8 (springer.com [abgerufen am 11. Januar 2019]).
- ↑ a b c S3-Leitlinie Therapie der Psoriasis vulgaris der Deutschen Dermatologische Gesellschaft. In: AWMF online (Stand 2021)
- ↑ Luger u. a.: Dermatology. 2008, Band 217, S. 321–328.
- ↑ Welche pflanzlichen Stoffe wirken bei Schuppenflechte? Mahonia aquifolium – Berberin. In: Psoriasis-Netz. 16. November 2018, abgerufen am 13. März 2025.
- ↑ Doc Fischer - Sendung vom 12. März 2025. In: ARD Mediathek. Doc Fischer, abgerufen am 13. März 2025 (Video-Beitrag ab Minute 37:16).
- ↑ Giannis-Aimant Moustafa, Eleni Xanthopoulou, Elena Riza, Athena Linos: Skin disease after occupational dermal exposure to coal tar: a review of the scientific literature. In: International Journal of Dermatology. Band 54, Nr. 8, 2015, ISSN 1365-4632, S. 868–879, doi:10.1111/ijd.12903, PMID 26183242.
- ↑ Dermatological exposure to coal tar and bladder cancer risk: A case-control study. In: Urologic Oncology: Seminars and Original Investigations. Band 33, Nr. 1, 1. Januar 2015, ISSN 1078-1439, S. 20.e19–20.e22, doi:10.1016/j.urolonc.2013.12.006 (sciencedirect.com [abgerufen am 11. Januar 2019]).
- ↑ Universität München, 12. Mai 2011: uni-muenchen.de: Warum Vitamin D bei Schuppenflechte hilft (9. Februar 2014)
- ↑ James E. Frampton, Esther S. Kim: Calcipotriol/Betamethasone Dipropionate Foam: A Review in Plaque Psoriasis. In: Drugs. Band 76, Nr. 15, 1. Oktober 2016, ISSN 1179-1950, S. 1485–1492, doi:10.1007/s40265-016-0643-7.
- ↑ Peinemann F, Harari M, Peternel S, Chan T, Chan D, Labeit AM, Gambichler T.: Indoor salt water baths followed by artificial ultraviolet B light for chronic plaque psoriasis. In: The Cochrane Database of Systematic Reviews. 2020. Jahrgang, Nr. 5, Mai 2020, S. CD011941, doi:10.1002/14651858.CD011941.pub2, PMID 32368795 (cochranelibrary.com).
- ↑ S. Ozcelik, H. H. Polat, M. Akyol, A. N. Yalcin, D. Ozcelik, Marufihah M. Kangal: Hot spring with fish and psoriasis treatment. In: The Journal of Dermatology. 2000 Jun, 27(6), S. 386–390.
- ↑ M. Grassberger, W. Hoch: Ichthyotherapy as alternative treatment for patients with psoriasis: a pilot study. In: Evid Based Complement Alternat Med. 2006 Dec;3(4), S. 483–438.
- ↑ Klaus Wolff: Psoriasis und PUVA. In: Deutsche medizinische Wochenschrift. Band 104, Nr. 44, 1979, S. 1543–1546.
- ↑ Robert S Stern: Psoralen and Ultraviolet A Light Therapy for Psoriasis. In: The New England Journal of Medicine. Band 357, 2007, S. 682–690.
- ↑ Tamar E C Nijsten, Robert S Stern: The increased risk of skin cancer is persistent after discontinuation of psoralen+ultraviolet A: a cohort study. In: The Journal of Investigative Dermatology. Band 121, Nr. 2, August 2003, ISSN 0022-202X, S. 252–258, doi:10.1046/j.1523-1747.2003.12350.x, PMID 12880415.
- ↑ A. Philipp u. a.: Interferential current is effective in palmar psoriaris: an open prospective trial. In: European Journal of Dermatology. April–Mai 2000, 10 (3), S. 195–198, PMID 10725817
- ↑ O. Fakhri: Use of low voltage electric therapy in the treatment of psoriasis. In: Archives of Dermatological Research. Band 282, Nr. 3. 1990, S. 203–205, PMID 236914
- ↑ Interferenzstrom zur Behandlung der Psoriasis. Auf: Psoriasis-Netz.
- ↑ U. A. Walker u. a.: Analgesic and disease modifying effects of interferential current in psoriatic arthritis. In: Rheumatol Int. Band 26, Nr. 10, August 2006, S. 904–907. Epub 2006 Jan 24. PMID 16432686.
- ↑ K. Reich: The concept of psoriasis as a systemic inflammation: implications for disease management. In: Journal of the European Academy of Dermatology and Venereology. Band 26, Suppl 3, 2012, S. 3–11, doi:10.1111/j.1468-3083.2011.04410.x, PMID 22356630.
- ↑ a b c d e f Ständige Impfkommission (STIKO): Empfehlungen der Ständigen Impfkommission (STIKO) beim Robert Koch-Institut 2021. 26. August 2021, doi:10.25646/8824 (rki.de [abgerufen am 12. Oktober 2021]).
- ↑ a b c d Psobest – Das deutsche Psoriasis-Register
- ↑ a b Stellungnahme zur Therapie der Psoriasis mit Fumarsäureestern im Zusammenhang mit dem Auftreten von PML, Fumarsäureester: PML in der Psoriasis-Behandlung – Dt. Ärzteblatt vom 26. April 2013.
- ↑ Peter Altmeyer, Claus-Michael Nüschel: Fumarate zur Behandlung der Psoriasis. In: Deutsches Ärzteblatt 1996; 93(48) (Digitalisat).
- ↑ a b c d A. Nast: S3 – Leitlinie zur Therapie der Psoriasis vulgaris. In: AWMF Online. (awmf.org ( vom 28. Februar 2013 im Internet Archive) [PDF]).
- ↑ M. Meissner, E. M. Valesky u. a.: Dimethyl fumarate – only an anti-psoriatic medication? In: Journal der Deutschen Dermatologischen Gesellschaft. Band 10, Nummer 11, November 2012, S. 793–801. doi:10.1111/j.1610-0387.2012.07996.x. PMID 22897153. (Review).
- ↑ U. Mrowietz, P. Altmeyer, T. Bieber, M. Röcken, R. E. Schopf, W. Sterry: Treatment of psoriasis with fumaric acid esters (Fumaderm). In: Journal der Deutschen Dermatologischen Gesellschaft. Band 5, Nr. 8, 2007, S. 716–717, PMID 17659047.
- ↑ A. J. Peeters, B. A. Dijkmans, J. G. van der Schroeff: Fumaric acid therapy for psoriatic arthritis. A randomized, double-blind, placebo-controlled study. In: Br J Rheumatol. Band 31, Nr. 7, 1992, S. 502–504, PMID 1628175.
- ↑ A. Roll, K. Reich, A. Boer: Use of fumaric acid esters in psoriasis. In: Indian Journal of Dermatology, Venereology and Leprology. Band 73, Nr. 2, 2007, S. 133–137, PMID 17456929.
- ↑ G. H. Kingsley, A. Kowalczyk, H. Taylor, F. Ibrahim, J. C. Packham, N. J. McHugh, D. M. Mulherin, G. D. Kitas, K. Chakravarty, B. D. Tom, A. G. O’Keeffe, P. J. Maddison, D. L. Scott.: A randomized placebo-controlled trial of methotrexate in psoriatic arthritis. In: Rheumatology (Oxford). Band 51, Nr. 8, 2012, S. 1368–1377, doi:10.1093/rheumatology/kes001, PMID 22344575.
- ↑ Sandoz GmbH: Fachinformation. (PDF) In: Hexal. Sandoz, 1. März 2021, abgerufen am 8. September 2021.
- ↑ a b Psoriasis: Zwei neue Medikamente in der EU zugelassen, Pharmazeutische Zeitung vom 21. Januar 2015, abgerufen am 26. März 2015.
- ↑ Classification of immunosuppressive therapies by PML risk. In: Nature Reviews Rheumatology. 11, 2015, S. 119–123, doi:10.1038/nrrheum.2014.167, abgerufen am 30. März 2015.
- ↑ Ustekinumab: Auftreten einer exfoliativen Dermatitis (Erythrodermie) und Exfoliation der Haut. (PDF; 189 kB), RHB Stelara 21. November 2014, abgerufen am 30. März 2015.
- ↑ Nebenwirkungen von Adalimumab auf Wikipedia
- ↑ Neuer Antikörper übertrumpft Ustekinumab, PZ vom 15. März 2021, abgerufen am 17. Mai 2021.
- ↑ Oral OTEZLA® (apremilast) Approved by the European Commission for the Treatment of both Patients with Psoriasis and Psoriatic Arthritis. PM von Celgene vom 16. Januar 2015, abgerufen am 26. März 2015.
- ↑ Wiggin Wu, Maya Debbaneh, Homayoun Moslehi, John Koo, Wilson Liao: Tonsillectomy as a Treatment for Psoriasis: A Review. In: The Journal of dermatological treatment. Band 25, Nr. 6, Dezember 2014, S. 482–486, doi:10.3109/09546634.2013.848258, PMC 4620715 (freier Volltext).
- ↑ D. Rigopoulos u. a.: Treatment of Nail Psoriasis with a Two-Compound Formulation of Calcipotriol plus Betamethasone Dipropionate Ointment. In: Dermatology. 2009, 218, S. 338–341.
- ↑ Chung-Jen Chen, Hsin-Su Yu: Acupuncture, electrostimulation, and reflex therapy in dermatology. In: Dermatologic Therapy. Band 16, Nr. 2, 2003, S. 87–92, doi:10.1046/j.1529-8019.2003.01619.x, PMID 12919109 (englisch).
- ↑ David Goldschmitt, Gunthram Heidbreder: [Acupuncture treatment in psoriasis]. In: Die Medizinische Welt. Band 32, Nr. 5, 30. Januar 1981, S. 158–159, PMID 7207150.
- ↑ Jerome Ormond Kirschbaum: Koebner phenomenon following acupuncture. In: Archives of Dermatology. Band 106, Nr. 5, November 1972, S. 767, doi:10.1001/archderm.1972.01620140101033, PMID 4635811 (englisch).
- ↑ Helfen Fischöl und Akupunktur gegen Schuppenflechte? In: Ärztezeitung. 8. November 2018, abgerufen am 10. Juni 2024.
- ↑ Edzard Ernst: Heilung oder Humbug?: 150 alternativmedizinische Verfahren von Akupunktur bis Yoga. 1. Auflage. Springer, Berlin 2020, ISBN 978-3-662-61708-3, S. 151; 152; 167, doi:10.1007/978-3-662-61709-0.
- ↑ Josef Smolle: Homeopathy in dermatology. In: Dermatologic Therapy. Band 16, Nr. 2, 2003, S. 93–97, doi:10.1046/j.1529-8019.2003.01616.x, PMID 12919110 (englisch).
- ↑ Aijing Shang et al.: Are the clinical effects of homoeopathy placebo effects? Comparative study of placebo-controlled trials of homoeopathy and allopathy. In: The Lancet. Band 366, Nr. 9487, 27. August 2005, S. 726–732, doi:10.1016/S0140-6736(05)67177-2, PMID 16125589 (englisch).
- ↑ Deutscher Psoriasis Bund e. V.: Schutzimpfungen bei Psoriasis. In: psoriasisbund.de. Deutscher Psoriasis Bund e. V., abgerufen am 12. Oktober 2021.
- ↑ Sophia Mohme, Marc Schmalzing, Cornelia S. L. Müller, Thomas Vogt, Matthias Goebeler: Impfen bei Immunsuppression: ein Leitfaden für die dermatologische Praxis. In: JDDG: Journal der Deutschen Dermatologischen Gesellschaft. Band 18, Nr. 7, Juli 2020, S. 699–725, doi:10.1111/ddg.14156_g.
- ↑ Die Schuppenflechte und ihr Preis. 2. Mai 2017, abgerufen am 9. Juli 2021 (deutsch).
- ↑ Monika Holthoff-Stenger: Biologika bei Schuppenflechte. 2. Januar 2020, abgerufen am 9. Juli 2021.
Auf dieser Seite verwendete Medien
Autor/Urheber: Ich selber, David Croll / Keimzelle, Lizenz: CC BY-SA 3.0
Psoriasisplaque kleinflaechig
Autor/Urheber: JVO27, Lizenz: CC BY-SA 4.0
A photograph showing the effects of psoriasis on the toenails.
Autor/Urheber: Userm1970, Lizenz: CC BY-SA 3.0
Psoriasis am Ellebogen,http://www.paul-hat-schuppenflechte.de
Autor/Urheber: Julia, Lizenz: CC BY-SA 3.0
Typische Psoriasis am linken Oberschenkel
- andere Versionen: psoliebei.jpg
Autor/Urheber: Der ursprünglich hochladende Benutzer war Eisfelder in der Wikipedia auf Deutsch, Lizenz: CC BY-SA 3.0
Psoriasisplaque; Eisfelder 12-2004, GNU FDL
Autor/Urheber: User:The Wednesday Island (of the English Wikipedia), Lizenz: CC BY-SA 3.0
Psoriasis of the back.









