Protonierter Wasserstoff
Protonierter Wasserstoff oder auch das Trihydrogeniumkation H3+ ist ein ionisiertes Molekül. Es besteht aus drei Wasserstoffkernen und zwei Elektronen. Das Kation ist das einfachste dreiatomige Molekül, das nur zwei Valenzelektronen besitzt. Es ist nur bei niedrigen Temperaturen und geringen Drücken stabil. Die beiden Elektronen sind gleichermaßen an die drei Kerne gebunden, damit ist es das einfachste Beispiel für eine Zwei-Elektronen-Drei-Zentren-Bindung.
Vorkommen
Protonierter Wasserstoff ist eins der häufigsten Ionen im interstellaren Raum, im interstellaren Medium ist es wegen der tiefen Temperaturen und der geringen Dichte stabil. In der Gasphasenchemie des interstellaren Mediums spielt H3+ eine herausgehobene Rolle.
Geschichte
H3+ wurde von J. J. Thomson 1911 entdeckt.[1] Während er Plasmen mit einer Frühform eines Massenspektrometers untersuchte, konnte er eine größere Menge von Teilchen mit einem Masse-zu-Ladung-Verhältnis von 3 nachweisen. Seiner Ansicht nach müsste es sich dabei entweder um H3+ oder um C4+ gehandelt haben. Da C4+ sehr ungewöhnlich wäre und da das Signal in reinem Wasserstoff ausgeprägter war, legte er sich auf H3+ fest.
T. R. Hogness und E. G. Lunn entdeckten 1925 verschiedene Reaktionswege zur Entstehung von H3+.[2] Auch sie verwendeten ein Massenspektrometer, um Wasserstoffentladungen zu studieren. Sie fanden heraus, dass die Menge an H3+ linear mit dem Wasserstoffdruck anstieg und die Menge an H2+ abnahm. Zusätzlich fand man etwas H+ bei jedem Wasserstoffdruck.
1961 schlugen D. W. Martin et al. vor, dass H3+ im interstellaren Medium vorhanden sein könnte. Sie begründeten das mit der großen Menge an vorhandenem Wasserstoff und damit, dass der rückwärtige Reaktionsweg exotherm ist (≈1.5 eV).[3] Dies führte Watson, Herbst und Klemperer 1973 zu der Vermutung, dass H3+ verantwortlich für die Bildung vieler beobachteter Molekülionen ist.[4][5]
Erst im Jahr 1980 wurde das erste Spektrum von H3+ (die ν2-Bande mithilfe der Frequenzmodulations-Detektionstechnik) von Takeshi Oka aufgezeichnet.[6] Emissionslinien des H3+ wurden in den späten 1980er und in den 1990er Jahren in der Ionosphäre der Planeten Jupiter, Saturn und Uranus entdeckt.[7][8][9]
Im Jahre 1996 wurde H3+ endgültig von Geballe und Oka im interstellaren Medium in zwei Gaswolken in Blickrichtung auf GL 2136 bzw. W33A nachgewiesen.[10] Im Jahre 1998 wurde H3+ auch von McCall et al. in einer diffusen interstellaren Wolke in Blickrichtung auf Cyg OB2 #12 entdeckt.[11] Im Jahre 2006 wurde von Oka publiziert, dass H3+ überall im interstellaren Raum zu finden ist und dass die zentrale molekulare Zone (central molecular zone, CMZ) die millionenfache Konzentration an H3+ wie das sonstige interstellare Medium enthält.[12]
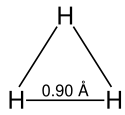
Struktur


Die Anordnung der Wasserstoffkerne entspricht einem gleichseitigen Dreieck. Das Molekül hat als Resonanzstruktur eine Zwei-Elektronen-Drei-Zentren-Bindung. Die Stärke der Bindung wurde zu 4,5 eV berechnet.[13] Dieses Molekül ist ein gutes Beispiel dafür, dass Delokalisierung zur Stabilität eines Moleküls beiträgt.
Bildung
Der Hauptreaktionsweg bei der Erzeugung von H3+ ist die Reaktion des Diwasserstoff-Kations H2+ mit H2.[14]
- H2+ + H2 → H3+ + H
Die H3+-Konzentration ist der geschwindigkeitsbestimmende Faktor dieser Reaktion. H2+ wird im interstellaren Raum auf natürliche Weise durch die Ionisierung von H2 unter Bestrahlung mit kosmischer Strahlung erzeugt. Die Photonen der kosmische Strahlung besitzen so viel Energie, dass nur ein Bruchteil benötigt wird, um ein H2-Molekül zu ionisieren. In interstellaren Wolken hinterlässt die kosmische Strahlung somit eine ganze Spur an H2+ und daher auch an H3+. Im Labor wird H3+ in Plasmaentladungszellen mit einer Spannung, die mindestens dem Ionisierungspotential von H2 entspricht, durch denselben Mechanismus erzeugt.
Zerfall
Es gibt mehrere Zerfallsreaktionen für H3+.[14] Der dominante Zerfallsweg in interstellaren Wolken ist der Protonentransfer durch einen neutralen Stoßpartner. Das Molekül, das dafür in Frage kommt, ist Kohlenmonoxid (CO), das zweithäufigste Molekül im Weltall.
- H3+ + CO → HCO+ + H2
Das wesentliche Produkt dieser Reaktion ist HCO+, ein wichtiges Molekül der Astrochemie. Durch seine große Polarität und seine große Häufigkeit ist es leicht mit Mitteln der Radioastronomie detektierbar.
H3+ kann auch mit atomarem Sauerstoff reagieren und dabei OH+ und H2 bilden:
- H3+ + O → OH+ + H2
OH+ reagiert dann normalerweise mit H2 und bildet folglich hydrierte Moleküle.
- OH+ + H2 → OH2+ + H
- OH2+ + H2 → OH3+ + H
Die möglichen Folgereaktionen von OH3+ und H2 im interstellaren Raum sind nicht exotherm. Der häufigste Zerfalls-Reaktionsweg von OH3+ ist die dissoziative Rekombination, die zu vier möglichen Kombinationen von Reaktionsprodukten führt: H2O + H, OH + H2, OH + 2H, und O + H2 + H. Obwohl Wasser ein mögliches Reaktionsprodukt wäre, ist es nicht sehr häufig.
H3+ zerfällt in Gaswolken mit 75 % Wahrscheinlichkeit in drei Wasserstoffatome und nur zu 25 % Wahrscheinlichkeit in atomaren und molekularen Wasserstoff.
Ortho/Para-H3+

Das häufigste Molekül in dichten interstellaren Wolken ist H2. Wenn ein H3+ Molekül mit H2 kollidiert, hat man keine stöchiometrische Ausbeute. Es kann jedoch Protonentransfer stattfinden, der den Spin der zwei Moleküle verändert, abhängig vom Kernspin des Protons. Zwei verschiedene Spin-Konfigurationen sind möglich, ortho und para. Ortho-H3+ hat drei Protonen mit parallelen Spins, so dass sich ein Gesamtspin von 3⁄2 ergibt. Para-H3+ hat zwei Protonen mit parallelem Spin und ein Proton mit antiparallelem Spin, so dass sich ein Gesamtspin von 1⁄2 ergibt. Analog dazu hat auch H2 zwei Spinzustände, ortho und para, wobei ortho-H2 einen Gesamtkernspin von 1 und para-H2 einen Gesamtkernspin von 0 hat. Wenn ortho-H3+ und para-H2 kollidieren, ändert das übertragene Proton den Gesamtkernspin des Moleküls, so dass man dann ein para-H3+ und ein ortho-H2 erhält.[14]
Spektroskopie
Die Spektroskopie von H3+ ist eine Herausforderung. Das reine Rotationsspektrum ist ziemlich schwach.[15] Ultraviolettes Licht ist zu energiereich und würde das Molekül spalten. Im Rotationsschwingungsspektrum (IR) kann man H3+ sehen. Man sieht die Schwingung ν2 von H3+ als asymmetrische Bande, da das Molekül ein schwaches Dipolmoment hat. Seit der Aufzeichnung von Okas Spektrum[6] sind über 900 Absorptionslinien im Infrarotbereich gemessen worden. H3+-Emissionslinien sind bei der Beobachtung der Atmosphäre des Planeten Jupiter gemessen worden. Die H3+ Emissionslinien sind die Linien, die man bei der Messung von molekularem Wasserstoff diesem nicht zuordnen konnte.
Astronomische Detektion
H3+ wurde in zwei Typen von Himmelskörpern entdeckt: Bei den Jupitermonden und in interstellaren Wolken. Bei den Jupitermonden wurde es in der Ionosphäre des Planeten entdeckt, in der Region, wo die hochenergetische Sonneneinstrahlung die Partikel der Atmosphäre ionisiert. Da in diesem Teil der Atmosphäre ein hoher Anteil Wasserstoff vorhanden ist, kann dort die Sonnenstrahlung eine beträchtliche Menge H3+ produzieren. Das bedeutet: in einer Breitbandstrahlungsquelle wie der Sonne kann viel H3+ in höhere Energieniveaus angehoben werden und danach durch spontane oder stimulierte Emissionen relaxieren.
Planetenatmosphären
Die Detektion von H3+ wurde als erstes von Drossart im Jahre 1989 publiziert,[7] der das Ion in der Ionosphäre des Jupiter entdeckte. Er fand insgesamt 23 H3+-Linien mit einer Dichte von 1.39 × 109/cm2. Mit Hilfe dieser Linien konnte er die Temperatur von H3+ auf ungefähr 1100 °C bestimmen, was vergleichbar ist mit den Temperaturen, die für die Emissionslinien von H2 ermittelt wurden. 1993 wurde H2 von Gaballe beim Saturn[8] und von Trafton am Planeten Pluto entdeckt.[9]
Molekulare interstellare Wolken
H3+ wurde erst im Jahre 1996 im interstellaren Raum detektiert, als Geballe & Oka die Detektion von H3+ in zwei Gaswolken in Blickrichtung auf GL2136 bzw. W33A nachwiesen.[10] Beide Quellen hatten Temperaturen von H3+ von ungefähr 35 K (−238 °C) und eine Dichte von ungefähr 1014/cm2. Seitdem wurde H3+ in zahlreichen anderen Wolkensichtlinien, wie AFGL 2136,[16] Mon R2 IRS 3,[16] GCS 3-2,[17] GC IRS 3,[17] und in LkHα 101 detektiert.[18]
Diffuse interstellare Wolken
Überraschend wurden drei H3+-Linien 1998 von McCall in einer diffusen Wolkensichtlinie von Cygnus OB2-12 entdeckt.[11] Vor 1998 war vermutlich die Dichte von H2 zu gering, um eine detektierbare Menge an H3+ zu produzieren. McCall detektierte eine Temperatur von ungefähr 27 K (−246 °C) und eine Säulendichte von ≈1014/cm2, dieselbe Dichte, die Geballe & Oka entdeckten. Seitdem wurde H3+ in vielen anderen diffusen Wolkensichtlinien nachgewiesen, wie beispielsweise in GCS 3-2,[17] GC IRS 3,[17] und ζ Persei.[19]
Steady-state-Modell-Vorhersagen
Um die Weglänge von H3+ in diesen Wolken zu bestimmen,[12] nahm Oka ein „steady-state-Modell“, um die Dichte und den Anteil an H3+ in diffusen und dichten Wolken zu bestimmen. Diffuse und dichte Wolken haben den gleichen Bildungsmechanismus für H3+ aber unterschiedliche Zerfallsmechanismen. In dichten Wolken ist der Protenentransfer an CO der dominate Abbauweg, dies deckt sich mit der vorhergesagten Dichte von 10−4 cm−3 in dichten Wolken.
- n(H3+) = (ζ / kCO)[n(H2) / n(CO)] ≈ 10−4/cm3
- n(H3+) = (ζ / ke)[n(H2) / n(C+)] ≈ 10−6/cm3
In diffusen Wolken ist der dominierende Zerfallsmechanismus die dissoziative Rekombination. Dies stimmt überein mit der Dichte von 10−6/cm3 in diffusen Wolken. Da die Dichte für diffuse und dichte Wolken grob geschätzt in der gleichen Größenordnung liegen, müssen diffuse Wolken eine 100-fache Weglänge der dichten Wolken haben. Daher kann man mit einer H3+-Probe aus diesen Wolken deren relative Dichte bestimmen.
Einzelnachweise
- ↑ Thomson, J. J.: Rays of Positive Electricity. In: Proceedings of the Royal Society A. 89. Jahrgang, Nr. 607, 1913, S. 1–20, doi:10.1098/rspa.1913.0057, bibcode:1913RSPSA..89....1T.
- ↑ Hogness, T. R., Lunn, E. G.: The Ionization of Hydrogen by Electron Impact as Interpreted by Positive Ray Analysis. In: Physical Review volume=26. 1925, S. 44–55, doi:10.1103/PhysRev.26.44.
- ↑ Martin, D. W., McDaniel, E. W., Meeks, M. L.: On the Possible Occurrence of H3+ in Interstellar Space. In: Astrophysical Journal. 134. Jahrgang, 1961, S. 1012, doi:10.1086/147232.
- ↑ Watson, W. D.: The Rate of Formation of Interstellar Molecules by Ion-Molecule Reactions. In: Astrophysical Journal. 183. Jahrgang, 1973, S. L17, doi:10.1086/181242.
- ↑ Herbst, E., Klemperer, W.: The Formation and Depletion of Molecules in Dense Interstellar Clouds. In: Astrophysical Journal. 185. Jahrgang, 1973, S. 505, doi:10.1086/152436.
- ↑ a b Oka, T.: Observation of the Infrared Spectrum of H3+. In: Physical Review Letters. 45. Jahrgang, Nr. 7, 1980, S. 531–534, doi:10.1103/PhysRevLett.45.531.
- ↑ a b Drossart, P.: Detection of H3+ on Jupiter. In: Nature. 340. Jahrgang, Nr. 6234, 1989, S. 539, doi:10.1038/340539a0.
- ↑ a b Geballe, T.: Detection of H3+ Infrared Emission Lines in Saturn. In: Astrophysical Journal. 408. Jahrgang, Nr. 2, 1993, S. L109, doi:10.1086/186843.
- ↑ a b Trafton, L. M.: Detection of H3+ from Uranus. In: Astrophysical Journal. 405. Jahrgang, 1993, S. 761, doi:10.1086/172404.
- ↑ a b Geballe, T. R., Oka, T.: Detection of H3+ in Interstellar Space. In: Nature. 384. Jahrgang, Nr. 6607, 1996, S. 334–335, doi:10.1038/384334a0, PMID 8934516.
- ↑ a b McCall, B. J.: Detection of H3+ in the Diffuse Interstellar Medium Toward Cygnus OB2 No. 12. In: Science. 279. Jahrgang, Nr. 5358, 1998, S. 1910–1913, doi:10.1126/science.279.5358.1910.
- ↑ a b T. Oka: Interstellar H3+. In: PNAS. 103. Jahrgang, Nr. 33, 2006, S. 12235–12242, doi:10.1073/pnas.0601242103, PMID 16894171, PMC 1567864 (freier Volltext), bibcode:2006PNAS..10312235O.
- ↑ McCall, B. J.: Dissociative Recombination of Rotationally Cold H3+. In: Physical Review A. 70. Jahrgang, Nr. 5, 2004, S. 052716, doi:10.1103/PhysRevA.70.052716.
- ↑ a b c Herbst, E.: The Astrochemistry of H3+. In: Philosophical Transactions of the Royal Society A. 358. Jahrgang, Nr. 1774, 2000, S. 2523–2534, doi:10.1098/rsta.2000.0665.
- ↑ Watson, J.K.G: Forbidden rotational spectra of polyatomic molecules. In: Journal of Molecular Spectroscopy. 40. Jahrgang, Nr. 3, 1971, S. 546–544, doi:10.1016/0022-2852(71)90255-4, bibcode:1971JMoSp..40..536W.
- ↑ a b B. J. McCall: Observations of H3+ in Dense Molecular Clouds. In: Astrophysical Journal. 522. Jahrgang, 1999, S. 338–348, doi:10.1086/307637, bibcode:1999ApJ...522..338M.
- ↑ a b c d Goto, M.: Absorption Line Survey of H3+ toward the Galactic Center Sources I. GCS 3-2 and GC IRS3. In: Astron. Soc. Japan. 54. Jahrgang, 2002, S. 951.
- ↑ S. D. Brittain: Interstellar H3+ Line Absorption toward LkHα 101. In: Astrophysical Journal. 606. Jahrgang, Nr. 2, 2004, S. 911–916, doi:10.1086/383024, bibcode:2004ApJ...606..911B.
- ↑ B. J. McCall: An Enhanced Cosmic-ray Flux towards ζ Persei Inferred from a Laboratory Study of the H3+-e− Recombination Rate. In: Nature. 422. Jahrgang, Nr. 6931, 2003, S. 500–2, doi:10.1038/nature01498, PMID 12673244, arxiv:astro-ph/0302106, bibcode:2003Natur.422..500M.
Auf dieser Seite verwendete Medien
Autor/Urheber: CCoil (talk), Lizenz: CC BY-SA 3.0
MO diagram of Trihydrogen cation
This figure shows structure of H3+. The arrangement of the hydrogen atoms in the ion is equilateral triangle. Length between two H atoms is about 9.0 × 10-11 m, which is derived from the rotational constants(B0 = 43cm-1, C0 = 20cm-1).