Proteus (Bakterien)
| Proteus | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Elektronenmikroskopische Aufnahme von Proteus penneri, der Balken entspricht 200 nm = 0,2 µm. | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Proteus | ||||||||||||
| Hauser 1885 emend. Hyun et al. 2016 |
Proteus ist eine Gattung von Bakterien und ist nach dem griechischen Meeresgott Proteus benannt, der in der Odyssee Homers als äußerlich höchst wandelbar charakterisiert wird. Dies trifft auch auf die Bakterien zu: Die Länge und Funktion der Zellen von Proteus-Arten ist variabel; es können sogenannte „Schwärmzellen“ gebildet werden, die das „Schwärm-Phänomen“ verursachen.
Bakterien der Gattung Proteus kommen weit verbreitet in verschiedenen Lebensräumen wie Böden und Gewässern vor. Sie sind in der Lage, tote Biomasse zu verwerten und zählen somit zu den Saprobionten. Sie verfügen hierzu über zahlreiche Enzyme, beispielsweise die Urease. Sie sind auch im Darmtrakt von Tieren und Menschen sowie in Fäkalien vorhanden. Einige Vertreter der Gattung Proteus können unter Umständen auch krankheitserregend wirken, sie gelten als fakultativ pathogen. Sie können beispielsweise Harnwegsinfektionen verursachen.
Die Gattung Cosenzaea gilt nach phylogenetischen Untersuchungen als Synonym der Gattung Proteus (Stand 2024). Eine Infektion mit Proteus ist zu unterscheiden vom Proteus-Syndrom, einer sehr seltenen schweren angeborenen Wachstumsstörung, die mit den Bakterien nur den Namen gemeinsam hat.
Merkmale
Erscheinungsbild
Die Zellen von Vertretern der Gattung Proteus sind stäbchenförmig mit einem Durchmesser von 0,4 bis 0,8 µm und sehr variabler Länge. Sie sind mit gleichmäßig über die Körperoberfläche verteilten Flagellen (peritrich) begeißelt und damit aktiv beweglich (motil).[1][2] Der Gram-Test verläuft negativ, Proteus zählt daher zur Gruppe der gramnegativen Bakterien.[3]
Schwärm-Phänomen

Proteus zeigt ein deutliches Schwärmverhalten, das durch Dimorphismus („Zweigestaltigkeit“) der Zellen erklärt werden kann. In flüssigen Nährmedien liegen die Zellen in Form kurzer Stäbchen mit einer Länge von 1 bis 2 µm vor, die sich durch ihre peritriche Begeißelung (die Flagellen sind gleichmäßig über die Zelloberfläche verstreut) fortbewegen können. Sie werden „Schwimmzellen“ genannt. Auf festen Nährböden werden daraus lange (20 bis 80 µm), besonders dicht begeißelte Zellen („Schwärmzellen“) gebildet, die sich auf der Oberfläche des Nährbodens in der sehr dünnen, durch Synärese gebildeten Flüssigkeitsschicht fortbewegen können („Schwärmen“). Dadurch breitet sich die anfänglich enger begrenzte Kolonie schnell über die Oberfläche des Nährbodens aus. Dabei kommt es zum Abwechseln von Schwärmbewegung und lokaler Vermehrung mit einem kürzeren Morphotyp (Konsolidierung).[4] Dadurch wird die Oberfläche von einer großen Kolonie überzogen, die terrassenartig abgestuft ist.[2]

Die Entwicklung von Schwimm- zu Schwärmzellen erfolgt, wenn die Drehbewegung der Flagellen durch Kontakt mit einer Oberfläche gehemmt wird. Die Zugabe von gegen die Flagellen gerichteten Antikörpern führt ebenfalls zu diesem Ergebnis. Bei dieser Antigen-Antikörper-Reaktion werden die Flagellen als H-Antigene bezeichnet (vergleiche Abschnitt Chemotaxonomie). Auch die Lipopolysaccharide in der Äußeren Membran der Zellen sind für das Schwärm-Phänomen von Bedeutung. Der als O6-Antigen bezeichnete Polysaccharidteil der Lipopolysaccharide ist eine Voraussetzung für die Bildung der Schwärmzellen. Mutanten von Proteus mirabilis, die ein Lipopolysaccharid ausbilden, das nur aus Lipid A und der Kernregion besteht, ohne das O-spezifische Polysaccharid, sind nicht in der Lage, zu schwärmen.[2][5] Die Replikation der DNA erfolgt ohne Bildung neuer Zellwände und Septieren der Zellen, was zu sehr langen polyploiden Zellen führt.[4] Der genaue molekulare Hintergrund ist noch unklar, aber sogenannte SulA-Proteine, die von Escherichia coli bekannt sind, sind vermutlich involviert.[5]
Die Umwandlung der Schwärmzellen zurück zu Schwimmzellen erfolgt, wenn die lokale Zelldichte niedrig ist. Dazu müssen die Zellen in der Lage sein, über chemische Kommunikation die Populationsdichte zu messen, dies nennt man Quorum sensing. Die Suche nach den als Signalmolekül genutzten Autoinduktoren ist noch nicht abgeschlossen. Autoinducer-1 (AI-12) wird von den Zellen nicht gebildet und Autoinducer-2 (AI-2) spielt beim Schwärm-Phänomen keine Rolle. Hingegen sind Ölsäure, Glutamin und Putrescin als Signalmoleküle erkannt worden, ohne dass der Wirkmechanismus vollständig geklärt ist.[2] Eingeleitet wird die Bildung von Schwärmzellen neben der Inhibition der Flagellenrotation durch die Anhäufung extrazellulären Putrescins und Interaktionen von O-Antigenen mit einer Oberfläche. Ein Schlüsselereignis im Prozess der Schwärmerzellenbildung ist die Hochregulierung des transkriptionalen Regulatorgen FlhD2C2, das das flagelläre Regulon und zusätzliche Gene aktiviert.[6][7]
Wachstum und Stoffwechsel
Die Vertreter der Gattung Proteus sind fakultativ anaerob, d. h. sie können mit oder ohne Sauerstoff wachsen. Der Katalase-Test verläuft bei ihnen positiv, der Oxidase-Test negativ.[8] Weiterhin ist ihr Stoff- und Energiewechsel als chemoorganotroph und heterotroph zu kennzeichnen, sie benutzen organische Verbindungen als Energiequelle und ebenso zum Aufbau zelleigener Stoffe. Sie leben saprophytisch und verwerten tote Biomasse.
Bakterien der Gattung Proteus sind mesophil, d. h. sie bevorzugen mittlere Temperaturen, das bakterielles Wachstum erfolgt im Temperaturbereich von 10–37 °C, optimal bei etwa 30 °C. Im Hinblick auf den pH-Wert sind sie als neutrophil zu kennzeichnen, sie wachsen bei einem pH-Wert von 5 bis 9, optimal bei einem pH-Wert von 7 bis 8. Sie tolerieren einen Massenanteil von 0–10 % an Natriumchlorid (NaCl) im Nährmedium, optimal sind 1–2 % NaCl.[8]
Als Kohlenstoff- und Energiequellen verwerten sie verschiedene Kohlenhydrate, z. B. Glucose, Maltose und Saccharose, oft unter Säure- und Gasbildung, dabei führen sie unter anoxischen Bedingungen (ohne Sauerstoff) Gärungen durch, beispielsweise die gemischte Säuregärung. Das Disaccharid Lactose (Milchzucker) können sie nicht verwerten, da ihnen das Enzym β-Galactosidase fehlt. Weiterhin reduzieren sie Nitrat zu Nitrit.[1]
Proteus ist zudem charakterisiert durch die Fähigkeit zur Hydrolyse von Gelatine (Gelatine-Verflüssigung), die Schwefelwasserstoff-Bildung aus schwefelhaltigen Aminosäuren und Proteus kann mit dem vorhandenen Enzym Urease Harnstoff in Ammoniak und Kohlenstoffdioxid spalten, was zu einer Erhöhung des pH-Wertes im Medium führt. Die meisten Vertreter der Gattung verfügen über eine Lipase, die die Lipide des Maiskeimöls hydrolytisch spaltet.[1] Weitere Informationen sind im Abschnitt Nachweise zu finden.
Chemotaxonomie

Bestandteile der Bakterienzelle wirken als Antigene: Es kommen einmal die sogenannten somatischen O-Antigene vor und weiterhin die durch die Flagellen begründeten H-Antigene. Die somatischen O-Antigene beruhen auf den Lipopolysacchariden in der Äußeren Membran der Zellen.
Die Bezeichnung und die zelluläre Zuordnung der Antigene ist bei dem für Salmonellen angewendeten Kauffmann-White-Schema beschrieben. Die Unterscheidung der Serotypen wird in der Routine-Diagnostik nicht angewendet.[9] Die O- und H-Antigene sind am Schwärm-Phänomen beteiligt.
Proteus-Arten weisen in ihren Membranlipiden v. a. die folgenden Fettsäureketten auf: 28–30 % Palmitinsäure (eine gesättigte Fettsäure mit der Abkürzung C16:0), 15–36 % eines mit der verwendeten Analysenmethode nicht trennbaren Gemisches aus cis-Palmitoleinsäure (eine einfach ungesättigte Omega-n-Fettsäure – in diesem Fall Omega-7-Fettsäure – mit der Abkürzung C16:1 (ω−7)c) und/oder die dazu isomere Omega-6-Fettsäure mit der Abkürzung C16:1 (ω−6)c (systematischer Name: (10Z)-Hexadec-10-ensäure), sowie 16–19 % eines mit der verwendeten Analysenmethode nicht trennbaren Gemisches aus cis-Vaccensäure (eine einfach ungesättigte Omega-7-Fettsäure mit der Abkürzung C18:1 (ω−7)c) und/oder die dazu isomere Omega-6-Fettsäure mit der Abkürzung C18:1 (ω−6)c (systematischer Name: (12Z)-Octadec-12-ensäure). Die hauptsächlich vorkommenden Ubichinone sind Q-8 und Q-10.[8]
Genetik
Das Genom mehrerer Proteus-Arten ist sequenziert, darunter elf Stämme von Proteus mirabilis und drei Stämme von Proteus vulgaris. So hat das Genom des Stammes Proteus mirabilis HI4320 eine Größe von 4,06 Megabasenpaaren (Mbp) auf, was in etwa mit der Genomgröße von Escherichia coli vergleichbar ist. Es sind 3562 Proteine annotiert. Das sequenzierte Plasmid besitzt eine Größe von 0,04 Megabasenpaaren, und enthält 48 Gene. Die Ergebnisse der Sequenzierungen zeigen einen GC-Gehalt (den Anteil der Nukleinbasen Guanin und Cytosin) in der Bakterien-DNA von 38,9 %.[10]
Pathogenität
Einige Vertreter der Gattung Proteus können bei gesundheitlich geschwächten Personen krankheitserregend wirken, sie sind also fakultativ pathogene (opportunistische) Krankheitserreger. Sie kommen auch bei Gesunden häufig im Dickdarm vor und lösen nicht notwendigerweise Krankheiten aus. Entsprechend immungeschwächte Personen können unter folgenden, von diesen Bakterien verursachten Krankheitsbildern leiden: Harnwegsinfekt, Wundinfektion und Sepsis. Die Spezies Proteus mirabilis und Proteus vulgaris werden dabei am häufigsten isoliert. Bei Harnwegsinfektionen nimmt man an, dass die bei den Bakterien vorkommende Urease als Virulenzfaktor wirkt und durch die Erhöhung des pH-Wertes das bakterielle Wachstum ermöglicht wird. Auch die Bildung von Nierensteinen kann dadurch gefördert werden.[11]
Proteus hauseri, P. mirabilis, P. penneri und P. vulgaris werden durch die Biostoffverordnung in Verbindung mit der TRBA (Technische Regeln für Biologische Arbeitsstoffe) 466 der Risikogruppe 2 zugeordnet. Andere Proteus-Arten gehören der Risikogruppe 1 an (sie werden als apathogen angesehen) oder wurden noch nicht zugeordnet.[12]
Nachweise
Zur Isolierung der Bakterien aus Proben, z. B. Urin, werden üblicherweise Selektivnährmedien verwendet, die zur Isolierung und Unterscheidung von Vertretern der Enterobakterien geeignet sind, beispielsweise Eosin-Methylen-Blau-Agar (EMB-Agar), MacConkey-Agar oder VRB-Agar. Bakterien der Gattung Proteus wachsen typischerweise als Lactose-negative und gegebenenfalls Saccharose-positive Kolonien (sofern das Nährmedium Saccharose enthält, wie der EMB-Agar).[13]
Biochemische Nachweise
Biochemische Merkmale, wie beispielsweise die vorhandenen Enzyme und die daraus resultierenden Stoffwechseleigenschaften können in einer Bunten Reihe zur Identifizierung von Proteus-Arten bzw. Unterscheidung dieser von anderen Vertretern der Morganellaceae genutzt werden, insbesondere Providencia und Morganella, da diese ähnliche Stoffwechseleigenschaften aufweisen. Alle drei Gattungen produzieren das Enzym Phenylalanin-Desaminase aber keine Arginindihydrolase (ADH), können keine Malonsäure verstoffwechseln und bilden keine Säure bei Dulcitol-, D-Sorbitol- und L-Arabinose-Verstoffwechselung.[1] Im Unterschied zu den beiden Gattungen können Vertreter von Proteus Schwefelwasserstoff und Lipasen produzieren, Gelatine hydrolisieren, sie produzieren hingegen keine Säure bei Mannose-Verstoffwechselung.[5]
Eine systematische Übersicht aus dem Jahr 2000 von Vertretern der drei Gattungen ist Grundlage für die Ergebnisse in der folgenden Tabelle.[1]
| Testmethode, Merkmal | Proteus | Providencia | Morganella |
|---|---|---|---|
| „Schwärm-Phänomen“ | + (1) (2) | – (1) | – |
| Methylrotprobe | + | (+) (1) | (+) |
| Citratverwertung | d (1) | + | – |
| H2S-Bildung | d | – | – (3) |
| Urease | + | d | + |
| Hydrolyse von Gelatine (22 °C) | d | – | – |
| Lipase (Maiskeimöl) | d | – | – |
| Arginindihydrolase (ADH) | – | – | – |
| Lysindecarboxylase (LDC) | – | – | d |
| Ornithindecarboxylase (ODC) | d | – | d |
| Phenylalanin-Desaminase | + | + | + |
| Säurebildung aus L-Adonitol (4) | – | d | – |
| Säurebildung aus L-Arabinose | – | – | – |
| Säurebildung aus Dulcitol | – | – | – |
| Säurebildung aus myo-Inositol | – | d | – |
| Säurebildung aus Lactose | – | – | – |
| Säurebildung aus D-Mannose | – | + | + |
| Säurebildung aus D-Sorbitol | – | – | – |
Anmerkungen:
- + steht für ein positives, – für ein negatives Ergebnis; falls in Klammern gesetzt, gilt, dass die meisten Vertreter der Gattung (> 75 %), aber nicht alle dieses Ergebnis zeigen; die Angabe d (für different) bedeutet „variabel“, d. h., dass es sowohl Stämme gibt, die ein positives Ergebnis hervorrufen können, wie auch Stämme, die dies nicht tun; oder die positive Reaktion ist zu schwach, um sie klar erkennen zu können.
- Farblich abgesetzt sind Reaktionen, die zur Unterscheidung geeignet sind, zumindest in Kombination mit anderen.
- In der Übersicht von 2000 ist hier d angegeben, hingegen weist die Übersicht von Manos & Belas aus dem Jahr 2006 ein negatives Ergebnis auf.
- „Säurebildung aus …“: Dies sind Reaktionen, bei denen die Verwertung von Kohlenhydraten geprüft wird, aufgeführt sind Monosaccharide, Disaccharide und Zuckeralkohole. Bei der Verwertung von Kohlenhydraten wird durch einen pH-Indikator geprüft, ob beim Abbau Säuren entstehen.
Im Folgenden die Ergebnisse einiger biochemischer Tests einzelner Proteus-Arten, die – zumindest in Kombination mit anderen – zur Unterscheidung geeignet sind. Die 2016 und später erstbeschriebenen Spezies sind im rechten Teil der Tabelle einsortiert. Zu den Angaben +, – usw. siehe Anmerkungen oben. Die Angabe n. ü. bedeutet „nicht überprüft“.
| Testmethode, Merkmal | P. hauseri[14] | P. mirabilis[1] | P. penneri[1][14] | P. vulgaris[1][14] | P. alimentorum[15] | P. terrae subsp. cibarius[8] | P. columbae[16] | P. terrae subsp. terrae[15][16] |
|---|---|---|---|---|---|---|---|---|
| Indolbildung | + | – | – | + | + | + | + | + |
| Citratverwertung | – | d | – | d | – | – | – | – |
| H2S-Bildung | d | + | (–) | (+) | + | n. ü. | + | n. ü. |
| Hydrolyse von Gelatine (22 °C) | + | + | d | d | + | + | + | n. ü. |
| Lipase (Maiskeimöl) | – | + | d | (–) | n. ü. | n. ü. | n. ü. | n. ü. |
| Ornithindecarboxylase (ODC) | – | + | – | – | – | – | – | – |
| Äskulinspaltung | – | – | – | + | + | – | – | – |
| DNase (25 °C) | – | d | (–) | + | n. ü. | n. ü. | n. ü. | n. ü. |
| Säurebildung aus D-Fructose[8] | + | + | + | + | n. ü. | + | – | + |
| Säurebildung aus Maltose | + | – | + | + | + | + | + | + |
| Säurebildung aus L-Rhamnose | – | – | – | – | – | – | – | + |
| Säurebildung aus Saccharose | + | – | + | + | + | + | + | + |
| Säurebildung aus Salicin | – | – | – | + | + | – | – | – |
| Säurebildung aus Trehalose | – | + | d | – | n. ü. | + | + | + |
Diese Untersuchungen können für miniaturisierte Testsysteme (z. B. das API-20E-System) verwendet werden. Die Ergebnisse sind in der frei zugänglichen Datenbank BacDive der DSMZ (Deutsche Sammlung von Mikroorganismen und Zellkulturen) einsehbar, beispielsweise für Proteus vulgaris.[17] Auch gerätetechnisch automatisierte Systeme (z. B. das Vitek-System) basieren auf den Stoffwechseleigenschaften.[1]
Weitere Nachweise
Die Identifizierung mit Hilfe der MALDI-TOF-Methode in Kombination mit Massenspektrometrie (MS) gewinnt gerade in Laboren mit hohem Probendurchsatz zunehmend an Bedeutung. Auch hier ist üblicherweise die Isolierung der Bakterien aus dem Untersuchungsmaterial durch Kultivierung auf Nährböden der erste Schritt. Für die Identifizierung werden Datenbanken benötigt, die Spektren von Bakterienstrukturen enthalten, durch Wiedererkennung bestimmter Muster (engl. pattern) erfolgt die Zuordnung zu einer Gattung oder Spezies. Um die Spezifität der Identifizierung gerade bei medizinisch relevanten Bakterien zu verbessern, werden Biomarker für die Massenspektren verwendet. Als Biomarker dienen bestimmte Proteine innerhalb der Bakterienzellen, vor allem ribosomale Proteine, da sie im eingesetzten Probenmaterial reichlich vorhanden sind und stark konserviert durch Gene im Bakterienchromosom codiert werden.[18]
2017 erfolgte ein Vergleich der Identifizierungsergebnisse mittels MALDI-TOF MS unter Verwendung von Biomarkern und konventionellen, biochemischen Methoden (Vitek 2). Bei 222 gramnegativen Bakterien aus insgesamt 383 Isolaten ergibt sich durch MALDI-TOF MS eine korrekte Identifizierung der Gattung von 97,6 % und eine korrekte Identifizierung der Spezies von 97,4 %. Diese Werte sind besser im Vergleich zur konventionellen Identifizierung mit 95,7 % bzw. 88,0 %. In den 383 Isolaten kamen 14 Vertreter der Gattung Proteus vor, die mittels MALDI-TOF MS alle korrekt auf Gattungsebene identifiziert werden (100 %). Darunter gibt es sieben korrekte Identifizierungen von P. mirabilis (100 %) und sieben korrekte Identifizierungen von P. penneri/vulgaris (100 %). Die Spezifität der Identifizierung durch konventionelle Methoden auf Gattungsebene liegt ebenfalls bei 100 %, jedoch erfolgt nur in sechs von sieben Fällen die korrekte Identifizierungen von P. penneri/vulgaris. Diese Ergebnisse zeigen auch, dass die in Laboren routinemäßig verwendeten Verfahren keine Unterscheidung von P. penneri und P. vulgaris erlauben.[18]
Um die Untersuchungszeit weiter zu minimieren, gibt es aktuell Ansätze, für die Identifizierung mittels MALDI-TOF MS direkt das Untersuchungsmaterial – ohne vorherige Anzucht und damit Isolierung der Bakterien – zu verwenden. In einer Untersuchung aus dem Jahr 2019 wurden dazu Urinproben mit einem Volumen von jeweils 30 ml, die vermutlich Krankheitserreger von Harnwegsinfektionen enthielten, nach Anreicherung durch Zentrifugation und Waschschritten direkt für MALDI-TOF MS eingesetzt. Von den 1638 Urinproben enthielten 265 vor allem Bakterien einer Art, davon 184 Gramnegative, von denen 163 (88,6 %) auf Speziesebene korrekt identifiziert wurden. In sieben angereicherten Isolaten war P. mirabilis enthalten, dabei gibt es sechs korrekte Identifizierungen auf Speziesebene (85,7 %), in einem Fall nur auf Gattungsebene. Falls die Bakterien zuvor durch Kultivierung isoliert wurden, wurden alle sieben Isolate korrekt als P. mirabilis identifiziert. Die direkte Untersuchung mittels MALDI-TOF MS der aus den Urinproben angereicherten Bakterien dauert weniger als zwei Stunden, falls die Bakterien zuvor kultiviert werden, dauert das Verfahren insgesamt 18–48 Stunden.[19]
Systematik und Taxonomie
Äußere Systematik
Bereits in den 1960er Jahren wurde die nahe Verwandtschaft der zu dem Zeitpunkt bekannten Gattungen Proteus, Providencia und Morganella anhand phänotypischer Merkmale aufgezeigt. Sie wurden im Tribus Proteeae geführt.[1] Seit Etablierung der Ordnung der Enterobacterales 2016 gehören sie mit weiteren Gattungen zur Familie der Morganellaceae. Die Enterobacterales werden zu der Klasse der Gammaproteobacteria gestellt, welche wiederum zum Phylum der Pseudomonadota zählt.
Innere Systematik
Derzeit (März 2024) sind zehn benannte Arten sowie eine Reihe von unbenannten Genotypen bekannt. Proteus vulgaris ist die Typusspezies der Gattung Proteus Hauser 1885 (Approved Lists 1980) emend. Hyun et al. 2016. Die Arten sind (Stand März 2024):[20][21]
- Proteus alimentorum Dai et al. 2018[15]
- Proteus cibi Dai et al. 2019[22]
- Proteus columbae Dai et al. 2018[16]
- Proteus faecis Dai et al. 2019[22]
- Proteus hauseri O'Hara et al. 2000
- Proteus mirabilis Hauser 1885
- Proteus myxofaciens Cosenza & Podgwaite 1966
- Proteus penneri Hickman et al. 1983
- Proteus terrae Behrendt et al. 2016[23]
- Proteus vulgaris Hauser 1885 (Approved Lists 1980) emend. Judicial Commission 1999.
Einige Synonyme und Umstellungen
| Taxonomie der Proteus vulgaris group | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||
| Veränderungen im Taxon Proteus vulgaris nach O'Hara et al. (2000)[14] |
Die Art Proteus myxofaciens ist genetisch recht verschieden von den anderen Spezies der Gattung, daher erfolgte 2011 ihre Ausgliederung als Cosenzaea myxofaciens in eine eigene Gattung Cosenzaea,[25] welche weiterhin zu der Familie Morganellaceae gestellt wird, jedoch sind außer C. myxofaciens keine weiteren Cosenzaea-Arten beschrieben.[20] Neuere phylogenetische Untersuchungen, bei denen das Bakteriengenom betrachtet wurde, ergeben Übereinstimmungen, wie sie innerhalb einer Gattung üblich sind, so dass das Basonym Proteus myxofaciens zu bevorzugen ist.[24] Die gleiche Untersuchung führte weiterhin zu der Aussage, dass sich P. terrae und P. cibarius auf Artebene nicht genügend unterscheiden und daher als Subspezies der gleichen Art klassifiziert werden.[24]
Die Klassifizierung der Gattungen Proteus, Providencia und Morganella im Tribus Proteeae in den 1960er Jahren zeigt die anfängliche Schwierigkeit, bestimmte Taxa sicher einer Gattung zuzuordnen. Dementsprechend ergeben sich zahlreiche Synonyme. Bei Morganella morganii (Winslow et al. 1919)Fulton 1943 und Proteus morganii (Winslow et al. 1919)Yale 1939, bei Providencia rettgeri (Hadley et al. 1918)Brenner et al. 1978 und Proteus rettgeri (Hadley et al. 1918)Rustigian andStuart 1943 sowie bei Providencia alcalifaciens (de Salles Gomes 1944)Ewing 1962 und Proteus inconstans (Ornstein 1920)Shaw andClarke 1955 handelt es sich jeweils um homotypische Synonyme, da beide Arten den gleichen Typusstamm aufweisen.[20]
Die erste Verwendung des Gattungsnamens „Proteus“ in der bakteriologischen Nomenklatur stammt von Gustav Hauser im Jahre 1885, der zwei Typen dieser Organismen beschrieb, die er aus verfaultem Fleisch isolierte, Proteus mirabilis und Proteus vulgaris.[20] Dieser Organismus hat also eine lange Geschichte in der Mikrobiologie. In den letzten Jahrzehnten hat das Taxon Proteus, insbesondere Proteus vulgaris, einige Änderungen in der Taxonomie durchgemacht. 1982 wurde Proteus vulgaris in drei Gruppen (engl. biogroups) auf der Grundlage der Indolproduktion, der Verwertung von Salicin und der Äskulinspaltung getrennt. Die erste Gruppe (biogroup 1) verhält sich in allen drei Reaktionen negativ und wurde als eine neue Art abgetrennt (Proteus penneri). Die zweite Gruppe (biogroup 2) verhält sich in allen drei Reaktionen positiv und verblieb als Proteus vulgaris. Die dritte Gruppe (biogroup 3) verhält sich positiv im Indol-Test, aber negativ für die Verwertung von Salicin und die Äskulinspaltung. Genetische Untersuchungen im Jahr 1995 mit Hilfe der DNA-Hybridisierung führten zur Aufgliederung der biogroup 3 in vier Taxa (Genomspezies 3 bis 6), die zunächst bis zu einer besseren Charakterisierung nicht als Arten beschrieben worden sind; eine davon (Genomspezies 3) wurde im Jahr 2000 als Proteus hauseri beschrieben.[14] Hyun et al. haben 2016 mit der Erstbeschreibung von P. cibarius (aktuell: P. terrae subsp. cibarius) auch eine erweiterte Beschreibung (Emendation) der Gattung Proteus veröffentlicht.[8][21]
Vorkommen

Bakterien der Gattung Proteus kommen als Saprophyten weit verbreitet in verschiedenen Habitaten wie Böden und Gewässern vor, die organisches Material wie tote Biomasse und Ausscheidungen von Lebewesen enthalten. Auch im Darmtrakt von Tieren und Menschen sowie in Fäkalien sind diese Bakterien vorhanden.[2]
In einem 2016 in der wissenschaftlichen Fachzeitschrift Microbial Ecology veröffentlichten Beitrag[9] werden über 150 wissenschaftliche Artikel zum Thema „Bedeutung und Funktionen von Proteus spp. Bakterien in der natürlichen Umgebung“ ausgewertet: Sie kommen im gesamten Magen-Darm-Trakt gesunder Menschen vor. Bei einer brasilianischen Studien mit gleich vielen Frauen wie Männern wurden die Bakterien wie folgt im entsprechenden Teil des Gastrointestinaltraktes gefunden: Magen 8 %, Duodenum (Zwölffingerdarm) 45 %, Jejunum (Leerdarm) 45 %, Ileum (Krummdarm) 20 %, Blinddarm (Caecum) 12 %, Dickdarm: aufsteigendes Colon 33 %, Quercolon 37 %, absteigendes Colon 25 %, Colon sigmoideum 35 % und Enddarm 30 %. Die höchsten Konzentrationen der Bakterien, ausgedrückt als koloniebildende Einheiten (KbE) pro Milliliter finden sich im Ileum mit 106, in den verschiedenen Bereichen des Dickdarms mit 105 bis 107 und im Enddarm mit 107 KbE pro Milliliter.[9]
Auch bei zahlreichen Tieren – sowohl Wildtiere wie domestizierte – finden sich Bakterien der Gattung Proteus im Darm, darunter Gorillas, Marderhunde, Ratten, Flughunde, Vögel, Schlangen, Alligatoren, Schildkröten, Amphibien, Fische, Insekten, „Meeresfrüchte“ wie beispielsweise Muscheln, Garnelen oder Krabben; Haushunde, Hauskatzen, Hausschweine, Hauspferde, Hausesel, Hausrinder und Geflügel.[9] Nicht bei allen dokumentierten Funden wird die Proteus-Spezies angegeben, wenn dies der Fall ist, finden sich Angaben zu P. mirabilis, P. vulgaris group (inklusive des später als eigene Art abgetrennten P. hauseri und der Genomspezies) und P. penneri. Proteus mirabilis wurde eher bei Haushunden, Hausrindern und Vögeln isoliert, während Proteus vulgaris u. a. bei Hausschweinen und wechselwarmen Tieren gefunden wurde.[2]
Die 2016 und später erstbeschriebenen Spezies bzw. Subspezies wurden überwiegend aus Lebensmitteln und Tieren isoliert: P. alimentorum aus Schweinefleisch und Hummer,[15] P. terrae subsp. cibarius aus Jeotgal,[8] ein gesalzenes, fermentiertes Gericht aus Meeresfrüchten, das bereits namensgebend für Angehörige der grampositiven Gattung Jeotgalicoccus ist, P. cibi aus einem Kaltgericht in der chinesischen Provinz Fujian,[22] P. columbae aus Taubenfleisch,[16] P. faecis aus Krebstieren, Eiern und Enten, weiterhin aus humanmedizinischen Proben (Faeces und Sputum).[22] P. terrae subsp. terrae wurde in einer Bodenprobe (Torferde eines Moorgebietes) gefunden.[23]
In medizinischen Proben wie Urin und Wunden wurde P. mirabilis nachgewiesen, selten auch andere Vertreter der Gattung, sofern überhaupt eine genaue Identifizierung der Art stattfand. Etwa 80–90 % der durch Proteus spp. verursachten Infektionen sind auf P. mirabilis zurückzuführen. Eine vergleichende Untersuchung von Kotproben gesunder Menschen und Patienten, die an Durchfall leiden, ergab, dass P. mirabilis häufiger aus den Proben der erkrankten als der gesunden Menschen isoliert werden konnte. Eine mögliche Erklärung dafür ist, dass die Diarrhoe durch andere pathogene Krankheitserreger verursacht wird, aber P. mirabilis dadurch die Gelegenheit erhält, sich opportunistisch zu vermehren. Hingegen wurde bei P. vulgaris kein Unterschied bezüglich des Auftretens in den beiden Personengruppen festgestellt.[9]
Bedeutung
Ökologie
Bakterien der Gattung Proteus sind als Saprophyten am Abbau organischer Verbindungen (tote Biomasse) in der Umwelt beteiligt. Das Vorhandensein verschiedener Enzyme ermöglicht ihnen dabei den Abbau von Harnstoff (durch die Urease), die Hydrolyse von Proteinen (durch proteolytische Enzyme) und die oxidative Desaminierung von Aminosäuren.[2] Sie wirken als Destruenten im Stickstoffkreislauf mit und wandeln dabei stickstoffhaltige organische Verbindungen (Proteine, Aminosäuren, Harnstoff) in anorganische Stoffe um, den enthaltenen Aminostickstoff in Ammonium-Ionen, wobei diese Produkte wieder als Nährstoffe von Pflanzen genutzt werden können.[9]
In der Rhizosphäre können sie das Wachstum bestimmter Pflanzen positiv beeinflussen. Ein Stamm von P. vulgaris aus dem Erdboden einer Teeplantage produziert Siderophore, wodurch die Bioverfügbarkeit von Eisenionen für die Teepflanze (Camellia sinensis) verbessert wird. Auch antimykotische Substanzen werden von diesem Stamm produziert, die im Test gegen den pathogenen Schimmelpilz Fusarium moniliformae wirken und somit das Wachstum der damit infizierten Leguminosen fördern. In Böden und Gewässern, die mit Schwermetallen belastet sind, findet man Vertreter der Gattung (darunter P. mirabilis und P. vulgaris), die resistent gegen Kupfer, Chrom, Cobalt, Cadmium, Zink und Quecksilber sind. In einigen Fällen lässt sich sogar nachweisen, dass die Bakterien den Gehalt an Chrom(VI)-Verbindungen im Wasser reduzieren können.[9]
Die ökologische Beziehung von Bakterien der Gattung Proteus und den von ihnen besiedelten Tieren ist in vielen Fällen noch unklar, dennoch lassen sich Beispiele für opportunistische Infektionen, Kommensalismus wie auch Symbiose finden. Stämme von P. mirabilis können bei Hauskatzen, Haushunden und Hauseseln Harnwegsinfektionen verursachen. Proteus-Bakterien gehören bei Tieren zur Normalflora, dies trifft auf zahlreiche Vögel, inklusive Geflügel als Nutztiere, zu, beispielsweise Sperlinge, Amseln, Raben und Krähen (Corvus spp.), Weißstörche (Ciconia ciconia) oder Hausgänse. Die Bakterien finden sich in der Kloake, in den Exkrementen und manchmal im Schnabel.[9]
Bei zahlreichen Vertretern der Fliegen (unter anderem die Stubenfliege Musca domestica, die Gemeine Stechfliege Stomoxys calcitrans und verschiedene Schmeißfliegen Lucilia spp.) sind diese Bakterien ein Hauptbestandteil des Mikrobioms im Verdauungssystem wie auch der Körperoberfläche. Die Fliegen dienen als Vektor, durch den die Bakterien auf andere Lebewesen übertragen werden. Eine Hypothese betrifft Botenstoffe, die „Reichs-übergreifend“ wirken (engl. interkingdom signal) – im Sinne der Taxa Tiere und Bakterien – und basiert auf der ökologischen Beziehung von P. mirabilis und der Goldfliege Lucilia sericata als Wirt. Bei den Signalstoffen handelt es sich um volatile Verbindungen wie Putrescin, die von P. mirabilis beim Abbau stickstoffhaltiger toter Biomasse produziert werden. Putrescin trägt zum Verwesungsgeruch bei und lockt die Goldfliege zum Kadaver. Gleichzeitig ist Putrescin ein extrazellulärer Botenstoff, der für das Schwärm-Phänomen der Bakterienzellen nötig ist.[9]
Stämme von P. mirabilis und P. vulgaris gehören zur symbiotischen Darmflora des Indischen Riesenflughundes (Pteropus giganteus) und spielen gemeinsam mit anderen Enterobakterien eine wichtige Rolle bei dessen Verdauung. Die Mikroorganismen produzieren Enzyme (Cellulasen und Xylanasen), die die in der pflanzlichen Nahrung enthaltene Cellulose bzw. Xylane abbauen, wodurch die Metabolite vom Wirtstier verwendet werden können.[9]
Medizinische Bedeutung
Proteus-Bakterien sind Teil der normalen Darmflora des Menschen; einige Vertreter können allerdings bei bereits gesundheitlich geschwächten Personen krankheitserregend wirken, sie zählen also zu den opportunistischen Krankheitserregern. Sie können hierbei z. B. Harnwegsinfekt, Nierenbeckenentzündung, Zystitis und Prostatitis auslösen. Auch eine Gastroenteritis kann auftreten, falls stark kontaminierte Lebensmittel verzehrt wurden. Infektionen mit Proteus-Bakterien treten relativ häufig während eines Krankenhausaufenthalts (nosokomial) auf und können dann auch zu Wundinfektionen (z. B. bei Verbrennungen) oder Sepsis führen. Harnwegsinfektionen treten oftmals bei Harnstau (obstruktive Uropathien), nach operativen Eingriffen an den ableitenden Harnwegen oder bei längerfristiger Verwendung von Blasenkathetern auf. Die Spezies P. mirabilis, P. vulgaris und P. penneri werden am häufigsten aus medizinischem Untersuchungsmaterial von menschlichen Patienten isoliert.[11][26]
Ein Problem bei Harnwegsinfektionen, insbesondere bei Patienten mit Katheter ist die Bildung eines Biofilms durch das schnelle Wachstum. Erschwerend kommt hinzu, dass in von Proteus dominierten Biofilmen eine Bildung von Kristallen durch Biomineralisation des Harnstoffs stattfindet, was zur Krustenbildung und schlussendlich Verstopfung der Katheter führt.[27]
In einem 2016 veröffentlichten Bericht des ECDC (Europäisches Zentrum für die Prävention und die Kontrolle von Krankheiten) über in Intensivstationen erworbene Harnwegsinfektionen (engl. urinary tract infections, UTI) sind Bakterien der Gattung Proteus für 5,4 % der Fälle verantwortlich. Nur für Deutschland betrachtet liegt die Quote mit 7,9 % höher.[28]
Antibiotikaresistenzen und wirksame Antibiotika
Natürliche Resistenzen der Proteus-Arten P. mirabilis, P. penneri und P. vulgaris bestehen gegenüber den Antibiotika Tetracyclinen, Tigecyclin, Colistin und Nitrofurantoin.[29] Stämme von P. mirabilis reagieren im Allgemeinen empfindlicher auf Antibiotika als Stämme von P. vulgaris, P. penneri und P. hauseri.[1] So ist P. mirabilis grundsätzlich empfindlich gegenüber Ampicillin und den Cephalosporinen Cefazolin und Cefuroxim (Leitsubstanzen der Cephalosporine der 1. und 2. Generation), während P. penneri und P. vulgaris dagegen eine natürliche Resistenz aufweisen.[29] Zumindest bei P. vulgaris wird die Bildung von β-Lactamasen als Ursache dafür gesehen.[26] Allerdings kann die Resistenz der Bakterienstämme zeitlich und regional variieren. Deshalb ist zumindest bei schwerwiegenden Infektionen oder Therapieversagen eine Überprüfung der Resistenz gegenüber bestimmten Antibiotika, also das Durchführen eines Antibiogramms sinnvoll, um ein wirksames Antibiotikum zur Therapie zu identifizieren.[26][29]
P. mirabilis ist grundsätzlich empfindlich gegenüber Aminopenicillinen (Ampicillin und Amoxicillin) und Ureidopenicillinen (Piperacillin), Cephalosporinen, beispielsweise Cefazolin, Cefoxitin (1. Generation); Cefuroxim (2. Generation); Cefotaxim, Ceftazidim, Ceftizoxim, Ceftriaxon (3. Generation) und Cefepim (4. Generation), Aminoglykosid-Antibiotika (Amikacin, Gentamicin und Tobramycin), Imipenem aus der Gruppe der Carbapeneme, Ciprofloxacin aus der Gruppe der Fluorchinolone sowie Cotrimoxazol. Bei während eines Krankenhausaufenthalts (nosokomial) auftretenden Infektionen mit P. mirabilis wurde eine Resistenz gegen Ciprofloxacin beobachtet. Bereits 1979 wurde über zum Teil erworbene Resistenzen einzelner Stämme von P. mirabilis berichtet, dies betraf u. a. die Antibiotika Ampicillin, Cefalotin, Chloramphenicol, Carbenicillin, Colistin, Cotrimoxazol und zahlreiche Aminoglykosid-Antibiotika (darunter Streptomycin und Gentamicin).[1]
P. penneri und P. vulgaris sind grundsätzlich empfindlich gegenüber Cefoxitin und Breitspektrum-Cephalosporinen (Cefotaxim, Ceftazidim, Ceftizoxim, Ceftriaxon, Cefepim), Aztreonam, Aminoglykosid-Antibiotika, Ciprofloxacin und Imipenem. Außerdem können β-Lactamase-Inhibitoren wie Tazobactam zum Einsatz kommen. Mögliche Resistenzen betreffen die Cephalosporine Cefazolin, Cefprozil, Cefuroxim, Cefamandol, Cefdinir, Cefoperazon, Loracarbef und die zu den Penicillinen gehörenden Ureidopenicilline und Ampicillin.[1]
Die meisten Proteus-Arten reagieren empfindlich auf Chinolon-Antibiotika und Breitspektrum-Cephalosporine der 2. und 3. Generation. Zur Therapie der unkomplizierten Harnwegsinfektion mit Proteus-Arten wird auch gelegentlich Cotrimoxazol empfohlen.[30][31]
Quellen
Literatur
- Caroline Mohr O'Hara, Frances W. Brenner, J. Michael Miller: Classification, Identification, and Clinical Significance of Proteus, Providencia, and Morganella. In: Clinical Microbiology Reviews. Band 13, Nr. 4. American Society for Microbiology, Washington Oktober 2000, S. 534–546, doi:10.1128/cmr.13.4.534-546.2000, PMID 11023955, PMC 88947 (freier Volltext).
- Dominika Drzewiecka: Significance and Roles of Proteus spp. Bacteria in Natural Environments. In: Microbial Ecology. Band 72, Nr. 4, Januar 2016, S. 741–758, doi:10.1007/s00248-015-0720-6, PMID 26748500, PMC 5080321 (freier Volltext).
Einzelnachweise
- ↑ a b c d e f g h i j k l m C. M. O'Hara, F. W. Brenner, J. M. Miller: Classification, identification, and clinical significance of Proteus, Providencia, and Morganella. In: Clinical Microbiology Reviews. Band 13, Nr. 4, Oktober 2000, S. 534–546, doi:10.1128/cmr.13.4.534-546.2000, PMID 11023955, PMC 88947 (freier Volltext).
- ↑ a b c d e f g Antoni Różalski, Agnieszka Torzewska, Magdalena Moryl, Iwona Kwil, Agnieszka Maszewska, Kinga Ostrowska, Dominika Drzewiecka, Agnieszka Zabłotni, Agata Palusiak, Małgorzata Siwińska, Paweł Staçzek: Proteus sp. – an opportunistic bacterial pathogen – classification, swarming growth, clinical significance and virulence factors. In: Folia Biologica et Oecologica. Band 8, Nr. 1, Dezember 2012, S. 1–17 (sciendo.com).
- ↑ George M. Garrity: Bergey's manual of systematic bacteriology. 2. Auflage. Springer, New York, 2005, Volume 2: The Proteobacteria, Part B: The Gammaproteobacteria ISBN 0-387-24144-2
- ↑ a b J.N. Schaffer, M.M. Pearson MM.: Proteus mirabilis and urinary tract infections. In: Microbiol Spectrum. Band 3, Nr. 5, 2015, S. UTI-0017–2013, doi:10.1128/microbiolspec.UTI-0017-2013.
- ↑ a b c J. Manos, R. Belas: The Genera Proteus, Providencia, and Morganella. In: Prokaryotes. Band 6, 2006, S. 245–269, doi:10.1007/0-387-30746-x_12.
- ↑ Randy M. Morgenstein, Bree Szostek & Philip N. Rather: Regulation of gene expression during swarmer cell differentiation in Proteus mirabilis. In: FEMS Microbiol Rev. Band 34, 2010, S. 753–763, doi:10.1111/j.1574-6976.2010.00229.x.
- ↑ Chelsie E. Armbruster and Harry L. T. Mobley: Merging mythology and morphology: the multifaceted lifestyle of Proteus mirabilis. In: Nat. Rev. Microbiol. Band 10, Nr. 11, 2012, S. 743–754, doi:10.1038/nrmicro2890.
- ↑ a b c d e f g h Dong-Wook Hyun, Mi-Ja Jung, Min-Soo Kim, Na-Ri Shin, Pil Soo Kim, Tae Woong Whon, Jin-Woo Bae: Proteus cibarius sp. nov., a swarming bacterium from Jeotgal, a traditional Korean fermented seafood, and emended description of the genus Proteus. In: International Journal of Systematic and Evolutionary Microbiology. Band 66, Nr. 6, Juni 2016, S. 2158–2164, doi:10.1099/ijsem.0.001002.
- ↑ a b c d e f g h i j Dominika Drzewiecka: Significance and Roles of Proteus spp. Bacteria in Natural Environments. In: Microbial Ecology. Band 72, Nr. 4, Januar 2016, S. 741–758, doi:10.1007/s00248-015-0720-6, PMID 26748500, PMC 5080321 (freier Volltext).
- ↑ Proteus. In: Website Genome des National Center for Biotechnology Information (NCBI). Abgerufen am 8. Februar 2021.
- ↑ a b Enterobakterien, Proteus. In: Helmut Hahn, Stefan H. E. Kaufmann, Thomas F. Schulz, Sebastian Suerbaum (Hrsg.): Medizinische Mikrobiologie und Infektiologie. 6. Auflage. Springer Verlag, Heidelberg 2009, ISBN 978-3-540-46359-7, S. 237, 250.
- ↑ TRBA (Technische Regeln für Biologische Arbeitsstoffe) 466: Einstufung von Prokaryonten (Bacteria und Archaea) in Risikogruppen. In: Webseite der Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA). 25. August 2015, S. 347, abgerufen am 27. März 2024 (letzte Änderung vom 20. März 2023).
- ↑ EMB-Agar. In: Website Merck Millipore. Abgerufen am 26. Dezember 2019.
- ↑ a b c d e C. M. O'Hara, F. W. Brenner, J. M. Miller, B. Holmes, P. A. Grimont, J. L. Penner, A. G. Steigerwalt, D. J. Brenner, B. C. Hill, P. M. Hawkey: Classification of Proteus vulgaris biogroup 3 with recognition of Proteus hauseri sp. nov., nom. rev. and unnamed Proteus genomospecies 4, 5 and 6. In: International Journal of Systematic and Evolutionary Microbiology. Band 50, Nr. 5, September 2000, S. 1869–1875, doi:10.1099/00207713-50-5-1869.
- ↑ a b c d Hang Dai, Yonglu Wang, Yujie Fang, Zhenzhou Huang, Biao Kan, Duochun Wang: Proteus alimentorum sp. nov., isolated from pork and lobster in Ma’anshan city, China. In: International Journal of Systematic and Evolutionary Microbiology. Band 68, Nr. 4, April 2018, S. 1390–1395, doi:10.1099/ijsem.0.002689.
- ↑ a b c d Hang Dai, Yonglu Wang, Yujie Fang, Tao Xiao, Zhenzhou Huang, Biao Kan, Duochun Wang: Proteus columbae sp. nov., isolated from a pigeon in Ma’anshan, China. In: International Journal of Systematic and Evolutionary Microbiology. Band 68, Nr. 2, Februar 2018, S. 552–557, doi:10.1099/ijsem.0.002541.
- ↑ Deutsche Sammlung von Mikroorganismen und Zellkulturen (DSMZ): Proteus vulgaris, Type Strain. In: Webseite BacDive. Abgerufen am 23. Dezember 2019.
- ↑ a b Ali Kassim, Valentin Pflüger, Zul Premji, Claudia Daubenberger, Gunturu Revathi: Comparison of biomarker based Matrix Assisted Laser Desorption Ionization-Time of Flight Mass Spectrometry (MALDI-TOF MS) and conventional methods in the identification of clinically relevant bacteria and yeast. In: BMC Microbiology. Band 17, Mai 2017, S. 128 (online), doi:10.1186/s12866-017-1037-z, PMID 28545528, PMC 5445374 (freier Volltext).
- ↑ Wei Li, Enhua Sun, Ying Wang, Hongwei Pan, Y. i. Zhang, Yong Li, Xin Zhang, Chen Li, Lutao Du, Chuanxin Wang: Rapid Identification and Antimicrobial Susceptibility Testing for Urinary Tract Pathogens by Direct Analysis of Urine Samples Using a MALDI-TOF MS-Based Combined Protocol. In: Frontiers in Microbiology. Band 10, Juni 2019, S. 1182 (online), doi:10.3389/fmicb.2019.01182, PMID 31231323, PMC 6560049 (freier Volltext).
- ↑ a b c d Aidan C. Parte, Joaquim Sardà Carbasse, Jan P. Meier-Kolthoff, Lorenz C. Reimer, Markus Göker: List of Prokaryotic names with Standing in Nomenclature (LPSN) moves to the DSMZ. In: International Journal of Systematic and Evolutionary Microbiology. Band 70, Nr. 11, 1. November 2020, S. 5607–5612, doi:10.1099/ijsem.0.004332 (dsmz.de [abgerufen am 27. März 2024]).
- ↑ a b Conrad L. Schoch et al.: NCBI Taxonomy: a comprehensive update on curation, resources and tools. In: Database: The Journal of Biological Databases and Curation. Band 2020, 1. Januar 2020, S. baaa062, PMID 32761142 (nih.gov [abgerufen am 27. März 2024]).
- ↑ a b c d Hang Dai, Aiping Chen, Yubao Wang, Binghuai Lu, Yonglu Wang, Jianhui Chen, Ying Huang, Zhenpeng Li, Yujie Fang, Tao Xiao, Hongyan Cai, Zongjun Du, Qiang Wei, Biao Kan, Duochun Wang: Proteus faecis sp. nov., and Proteus cibi sp. nov., two new species isolated from food and clinical samples in China. In: International Journal of Systematic and Evolutionary Microbiology. Band 69, Nr. 3, 2019, S. 852–858, doi:10.1099/ijsem.0.003248.
- ↑ a b U. Behrendt, J. Augustin, C. Spröer, J. Gelbrecht, P. Schumann, A. Ulrich: Taxonomic characterisation of Proteus terrae sp. nov., a N2O-producing, nitrate-ammonifying soil bacterium. In: Antonie van Leeuwenhoek. Band 108, Nr. 6, Dezember 2015, S. 1457–1468, doi:10.1007/s10482-015-0601-5.
- ↑ a b c d Undine Behrendt, Sonja Wende, Steffen Kolb, Andreas Ulrich: Genome-based phylogeny of the genera Proteus and Cosenzaea and description of Proteus terrae subsp. terrae subsp. nov. and Proteus terrae subsp. cibarius subsp. nov. In: International Journal of Systematic and Evolutionary Microbiology. Band 71, Nr. 3, 6. Juni 2019, doi:10.1099/ijsem.0.004651.
- ↑ Giovanni M. Giammanco, Patrick A. D. Grimont, Francine Grimont, Martine Lefevre, Giuseppe Giammanco, Sarina Pignato: Phylogenetic analysis of the genera Proteus, Morganella and Providencia by comparison of rpoB gene sequences of type and clinical strains suggests the reclassification of Proteus myxofaciens in a new genus, Cosenzaea gen. nov., as Cosenzaea myxofaciens comb. nov.. In: International Journal of Systematic and Evolutionary Microbiology. Band 61, Juli 2011, S. 1638–1644. doi:10.1099/ijs.0.021964-0.
- ↑ a b c Herbert Hof, Rüdiger Dörries: Duale Reihe: Medizinische Mikrobiologie. 3. Auflage. Thieme Verlag, Stuttgart 2005, ISBN 978-3-13-125313-2, S. 11–12, 289–296, 399–400.
- ↑ Reham Wasfi, Samira M. Hamed, Mai A. Amer & Lamiaa Ismail Fahmy: Proteus mirabilis Biofilm: Development and Therapeutic Strategies. In: Front. Cell. Infect. Microbiol. Band 10, 2020, S. 414, doi:10.3389/fcimb.2020.00414.
- ↑ Healthcare-associated infections acquired in intensive care units - Annual Epidemiological Report for 2016. (PDF; 962 KB) ECDC Surveillance Report. Europäisches Zentrum für die Prävention und die Kontrolle von Krankheiten (ECDC), Mai 2018, S. 1–11, abgerufen am 24. Mai 2018 (englisch).
- ↑ a b c R. Leclercq et al.: EUCAST expert rules in antimicrobial susceptibility testing. In: Clinical Microbiology and Infection. Band 19, Nr. 2. Wiley-Blackwell, Februar 2013, ISSN 1469-0691, S. 141–160, doi:10.1111/j.1469-0691.2011.03703.x, PMID 22117544 (wiley.com).
- ↑ Zeitschrift für Chemotherapie 4-2006 ( vom 12. März 2014 im Internet Archive)
- ↑ "Wirkstoff Aktuell", Ausgabe 2/2012 ( vom 7. November 2014 im Internet Archive)
Weblinks
Auf dieser Seite verwendete Medien
Autor/Urheber: (of code) -xfi-, Lizenz: CC BY-SA 3.0
The Wikispecies logo created by Zephram Stark based on a concept design by Jeremykemp.
Autor/Urheber:
- Bacteria-.svg: JrPol
- derivative work: Matthias M.
schematische Darstellung eines Bakteriums aus der Familie der Enterobacteriaceae mit Abkürzungen für die Antigenstrukturen: K (Kapsel), O (somatisch), F (Fimbrien), H (Flagellen)
Strukturformel von Palmitoleinsäure
The gastrointestinal tract, also called the digestive tract, alimentary canal, or gut, is the system of organs within multicellular animals that takes in food, digests it to extract energy and nutrients, and expels the remaining waste.
Autor/Urheber: Microrao, Lizenz: CC BY-SA 4.0
Proteus swarming on Blood agar
Autor/Urheber: Murray J. Tipping, Karine A. Gibbs, Lizenz: CC BY-SA 4.0
Phasenkontrastbilder von Proteus mirabilis. Links erste aktive Schwarmphase, rechts Beginn der Konsolidierungsphase, 1,5 Stunden später.
Electron micrograph of Proteus penneri
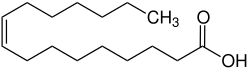
Cis-Vaccensäure
Autor/Urheber: Dr. Sahay, Lizenz: CC BY-SA 3.0
Proteus mirabilis appears as Gram negative rods after gram staining under bright field microscopy with 1000 times magnification
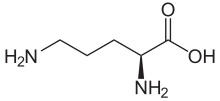
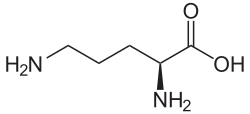
Struktur von L-Ornithin
Struktur von Palmitinsäure (Hexadecansäure)
Chemical structure of putrescine.